上海生物芯片有限公司
3 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
芯空一号快讯 | 结果全阴你也能发9分杂志---复发性胶质瘤中,PD-1免疫治疗为何彻底失效?
50 人阅读发布时间:2025-11-18 16:09

免疫检查点抑制剂(ICI)已经改变了多种癌症的治疗格局,但对于胶质母细胞瘤(GBM)这种侵袭性极强的脑部恶性肿瘤而言,免疫疗法的浪潮却迟迟没有掀起波澜。近期,丹麦哥本哈根大学与Rigshospitalet团队在 Acta Neuropathologica (IF9.3)发表研究,利用GeoMx DSP(Digital Spatial Profiling)空间转录组技术,深入解析了PD-1阻断治疗在复发性GBM中的分子反应。
结果令人意外:无论是肿瘤细胞还是肿瘤相关巨噬细胞都未展现出可检测的转录学变化。
1、研究背景
PD-1/PD-L1通路抑制剂通过解除T细胞抑制,实现对肿瘤的免疫清除,已在黑色素瘤、肺癌等疾病中取得显著疗效。然而,在GBM中,这一策略的临床试验几乎全部以失败告终。既往研究虽提示PD-1抑制可能引起T细胞活化或干扰素信号上调,但结果不统一,且大多忽视了TAM等非T细胞群体的反应。GBM中,T细胞数量稀少,仅占肿瘤细胞的1–2%。相反,TAM占据免疫细胞的主导地位。因此,本研究旨在回答一个关键问题:PD-1单抗是否能在复发性GBM的主要细胞群(肿瘤细胞与TAM)中诱导出任何可检测的转录学变化?
2、研究设计
研究纳入30例复发性GBM患者,其中20例接受了临床试验的新辅助nivolumab(PD-1抑制剂)治疗,另有10例未接受免疫治疗作为对照组。研究团队构建了六个FFPE组织芯片(TMA),并通过GeoMx DSP平台使用Whole Transcriptome Atlas探针进行空间转录组分析。
每个区域使用SOX2标记肿瘤细胞、IBA1标记巨噬细胞。共获得449个ROI、708个AOI,平均每个ROI包含约1100个SOX2⁺细胞与245个IBA1⁺细胞,确保了分析的空间精度。
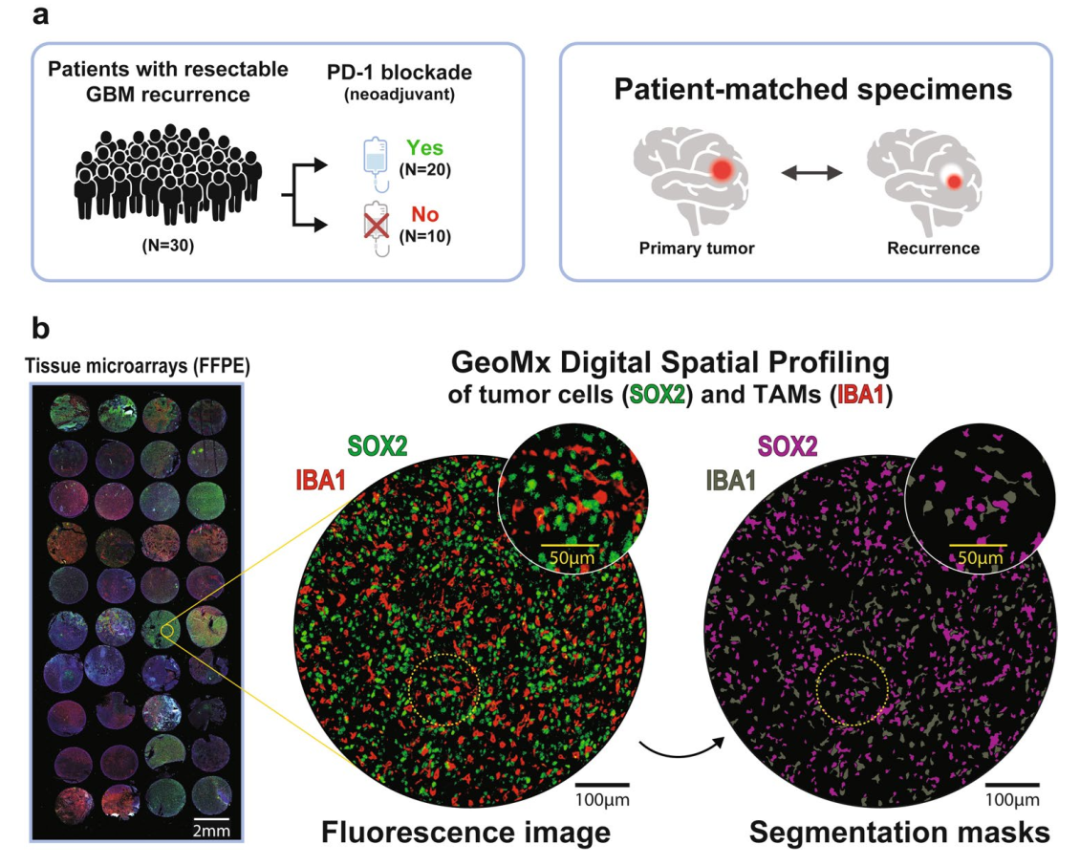
研究设计
3、主要发现
1.复发性GBM仍保持典型分子特征,但呈现显著异质性
全外显子/基因组测序结果显示,复发性GBM依旧保留了7号染色体扩增、10号染色体缺失等经典拷贝数异常,并伴随EGFR扩增、CDKN2A/B缺失、TERT启动子突变等常见驱动事件。但不同患者间的变异组合存在显著差异,提示复发GBM具有高度基因组异质性。在部分样本中,这些变异在原发灶中可检测到,但复发灶因肿瘤纯度下降或DNA降解而未被验证。
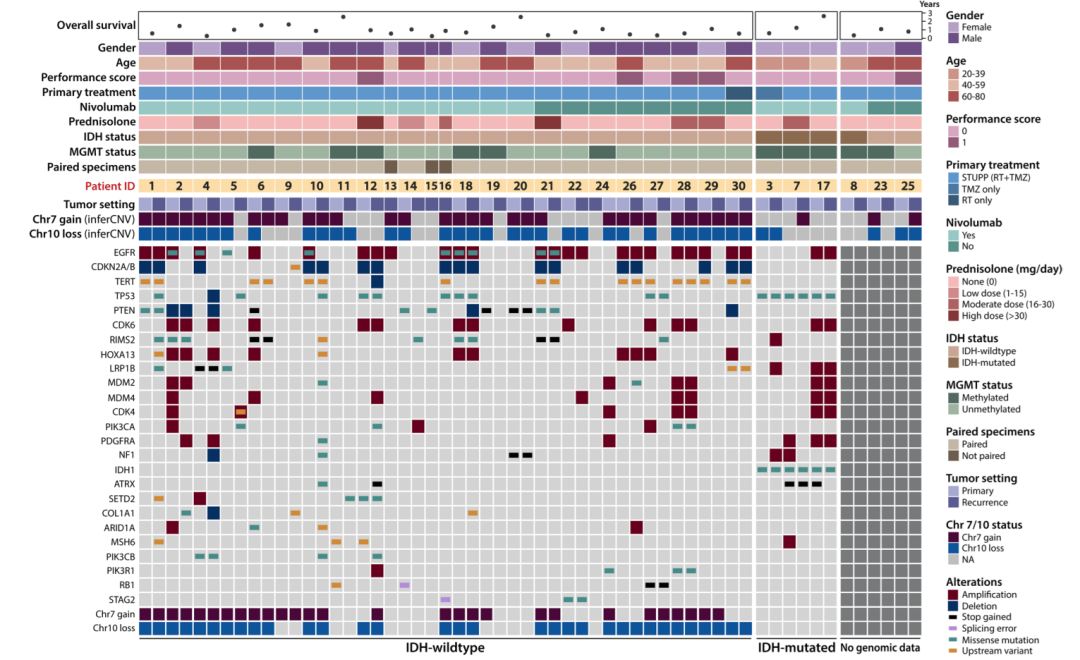
复发性GBM的临床特征和基因组改变的Oncoplot图
2.PD-1阻断未显著改变肿瘤纯度或PD-1蛋白表达
通过免疫组化与空间信号分割,研究发现复发性肿瘤中SOX2⁺区域比例显著下降,说明复发样本的肿瘤细胞密度较低、非肿瘤细胞比例上升。为避免非特异信号干扰,作者基于CNV分析与恶性基因特征筛选,排除了低纯度AOI,确保比较的准确性。在相同区域,利用IHC检测PD-1蛋白后发现,nivolumab治疗组复发样本中PD-1阳性细胞比例较原发样本略有提高,但与未治疗复发组相比差异不显著。这表明即便药物确实到达病灶,PD-1阻断仍未显著重塑免疫微环境或增强局部免疫反应。
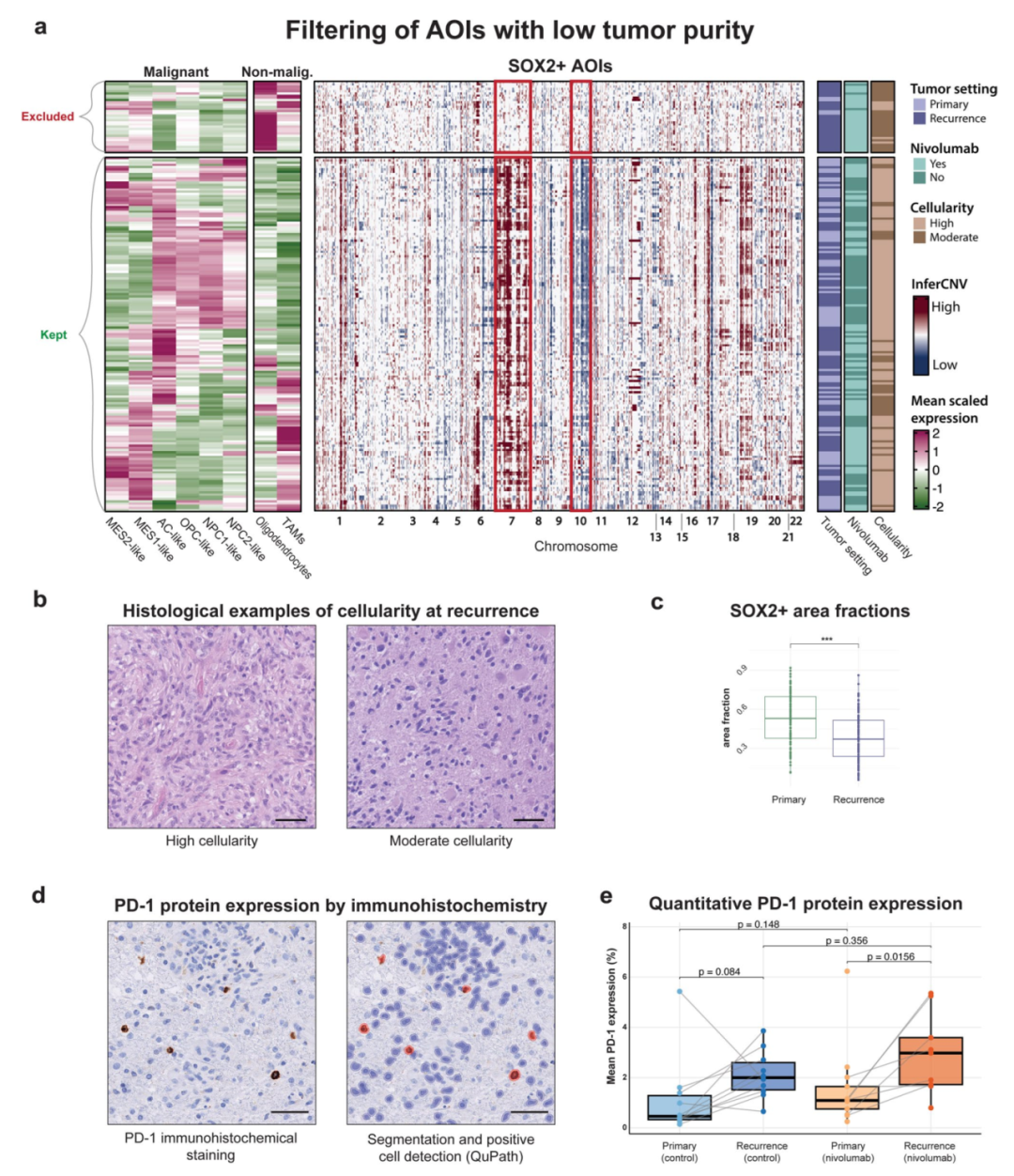
GBM样本中SOX2⁺区域和PD-1表达的组织水平评估
3.空间转录组揭示肿瘤细胞与TAM均未出现转录学变化
空间转录组结果清晰显示,SOX2⁺肿瘤细胞与IBA1⁺ TAM在转录谱上完全可区分,但nivolumab治疗并未带来任何聚类或表达差异。无论在肿瘤细胞还是TAM区段,差异基因分析均未检测到显著变化。进一步分析发现恶性细胞状态谱系(PN、MES、OPC、NPC)在两组间稳定不变。细胞周期(G1/S、G2/M)活性无变化,且干扰素信号与髓系转录程序也均未见上调。这些结果一致表明在复发性GBM中,PD-1单药治疗未能诱导可检测的基因表达变化,免疫微环境保持沉默,肿瘤细胞与TAM均对免疫干预不敏感。
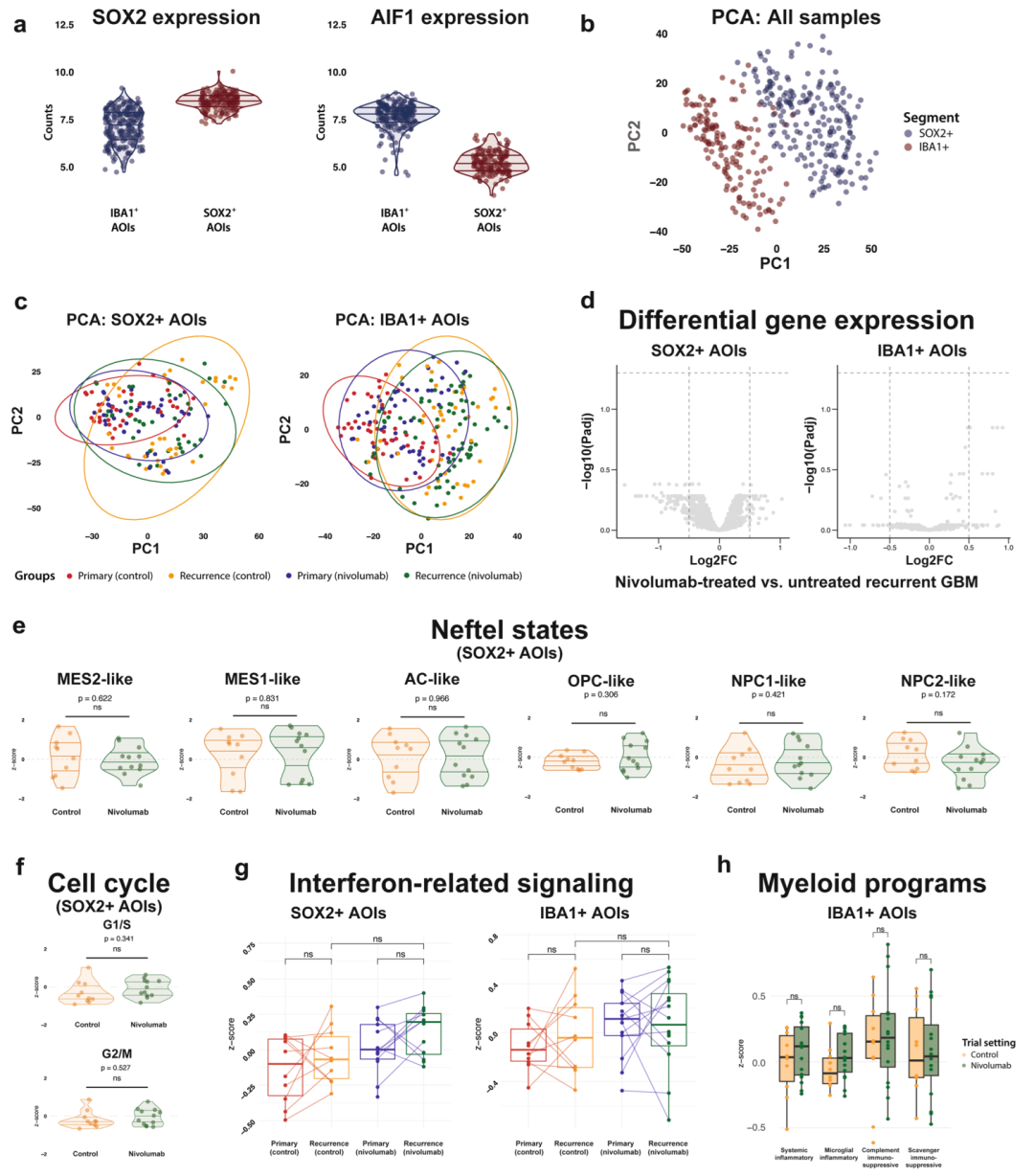
复发性GBM中PD-1阻断后肿瘤细胞(SOX2⁺)和TAM(IBA1⁺)的空间转录组学分析
4、总结与启示
本研究是迄今为止最系统的复发性GBM PD-1免疫治疗空间转录组分析之一。结果揭示尽管药物成功进入病灶并与PD-1结合,但并未在空间层面引起明显分子响应。作者指出,PD-1阻断的有限效应可能源于以下因素:
● GBM T细胞稀少,激活不足
● TAM主导的免疫抑制环境
● 血脑屏障限制药物与免疫细胞通路
● PD-1通路活化本身不足以打破多层免疫抑制
因此,研究者指出未来的治疗方向应当从单一PD-1通路干预转向更系统的免疫调控策略。一方面,可通过联合多通路免疫阻断以增强T细胞活化与持续免疫应答;另一方面,需靶向重塑肿瘤相关巨噬细胞的功能状态,改善其免疫抑制与代谢支持特征,从根本上重编程肿瘤微环境。同时,借助空间组学技术对患者进行分层与精准筛选,有望识别出真正具备免疫反应潜力的亚群,为未来GBM免疫治疗提供更具针对性的组合策略。