上海生物芯片有限公司
3 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
芯空一号快讯 | 免疫疗法为什么不灵了?单细胞空间平台SMI助力揭示Ewing肉瘤对免疫检查点抑制剂的三重抵抗机制!
50 人阅读发布时间:2025-09-11 14:05

一、文章背景
Ewing肉瘤(EwS)是一种好发于青少年的侵袭性骨肿瘤,尽管局灶期患者预后较好,但复发或转移后的治疗手段有限,生存率低,临床亟需新的治疗策略。免疫检查点抑制剂(ICIs)在多种癌症中取得成功,但在EwS中疗效甚微,其机制尚不清楚。由于EwS发病率低,缺乏系统研究治疗前后肿瘤微环境变化的样本。本研究利用SARC028临床试验中罕见的治疗前后配对活检样本,结合多重空间组学技术,系统揭示了EwS对PD-1单药免疫治疗抵抗的微环境机制。
二、研究设计
本研究依托SARC028临床试验的独特样本资源,系统分析了13位复发/难治性Ewing肉瘤(EwS)患者在免疫检查点抑制剂pembrolizumab治疗前与治疗8周后的肿瘤活检样本。共收集到37个组织切片,构建组织芯片(TMA),开展以下分析:
-
多重免疫荧光(mIF):定量肿瘤中不同免疫细胞亚群的浸润程度,包括CD4⁺、CD8⁺ T细胞,FOXP3⁺调节性T细胞,CD68⁺巨噬细胞,CD20⁺ B细胞,及CD45⁺总免疫细胞。
-
GeoMx DSP空间蛋白组:检测68种蛋白的表达,评估免疫调节变化。总共分析 48个区域,包括:肿瘤区(依据NKX2.2+ 识别)、CD8⁺ T细胞区、CD68⁺巨噬细胞区与非阳性间质区。
-
CosMx SMI空间转录组:通过单细胞水平的空间转录组图谱,识别细胞亚群与空间邻域。使用CosMx Human Universal Cell Characterization RNA Panel(1000-plex)
-
整合scRNA-seq数据:与已构建的EwS肿瘤微环境单细胞图谱整合,进行细胞注释。
本研究巧妙融合了三种空间组学技术,形成纵向-横向联动的分析框架:mIF用于定量免疫细胞浸润,揭示免疫细胞总体变化;GeoMx DSP空间蛋白组学进一步解析免疫调节蛋白的空间表达状态与治疗应答的关系,提供蛋白水平的动态信息;CosMx SMI空间转录组则在单细胞分辨率下描绘细胞类型组成、空间邻域结构及肿瘤亚群的功能状态,揭示免疫抵抗的关键机制。
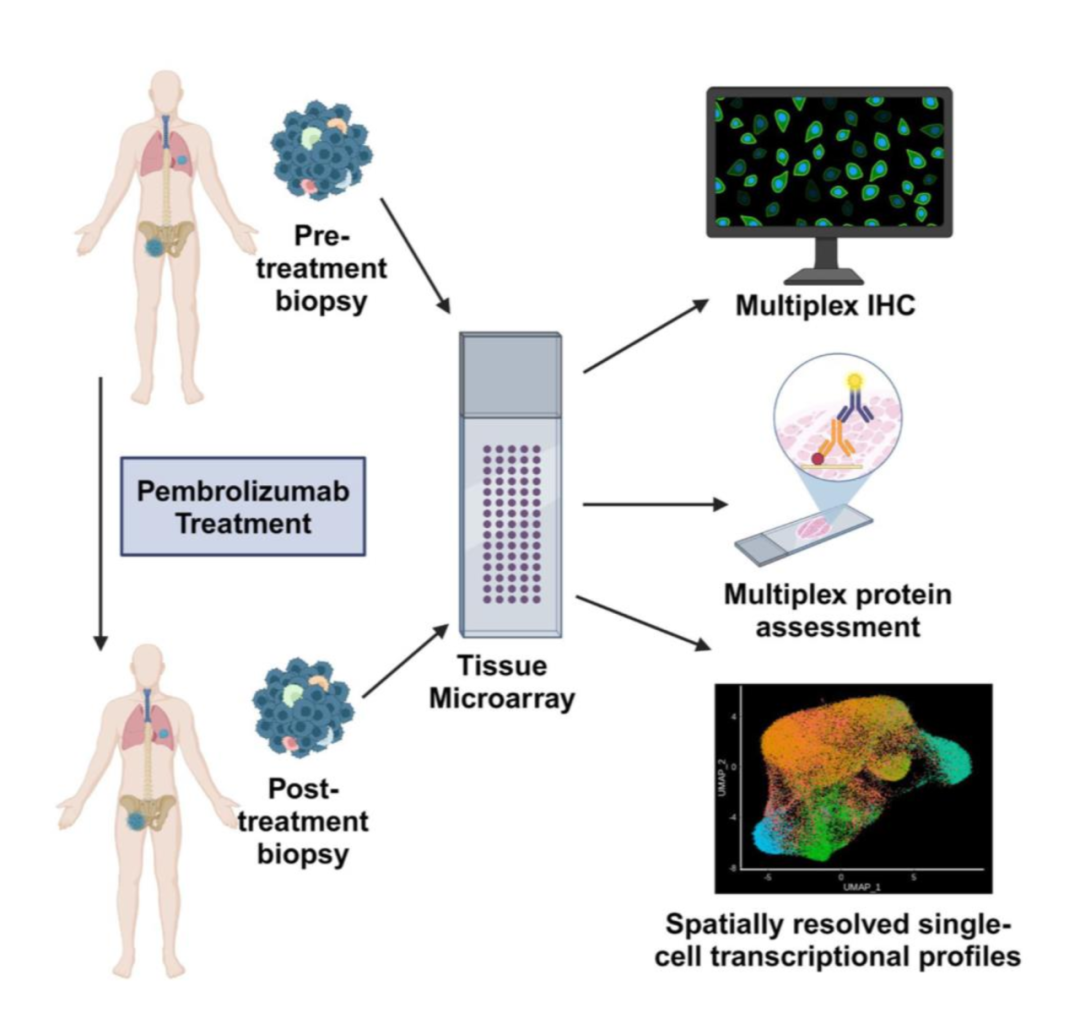
研究设计
三、核心发现
1.Pembrolizumab未能显著提升EwS肿瘤中免疫细胞浸润水平
研究通过多重免疫荧光分析治疗前后Ewing肉瘤肿瘤活检样本,评估T细胞、B细胞、巨噬细胞及调节性T细胞等免疫亚群的浸润水平。结果显示,pembrolizumab治疗前后,肿瘤组织中CD45⁺总免疫细胞数量并无显著变化,CD4⁺、CD8⁺、CD68⁺、FOXP3⁺等亚群数量也未见显著波动。在个体水平上,部分患者存在免疫细胞数量升高或下降的情况,但这种变化未与治疗后肿瘤体积变化显著相关。这一结果提示,单药抗PD-1治疗难以有效激活EwS患者的抗肿瘤免疫反应,可能由于其本底免疫细胞浸润水平低,或缺乏免疫激活所需的关键信号。
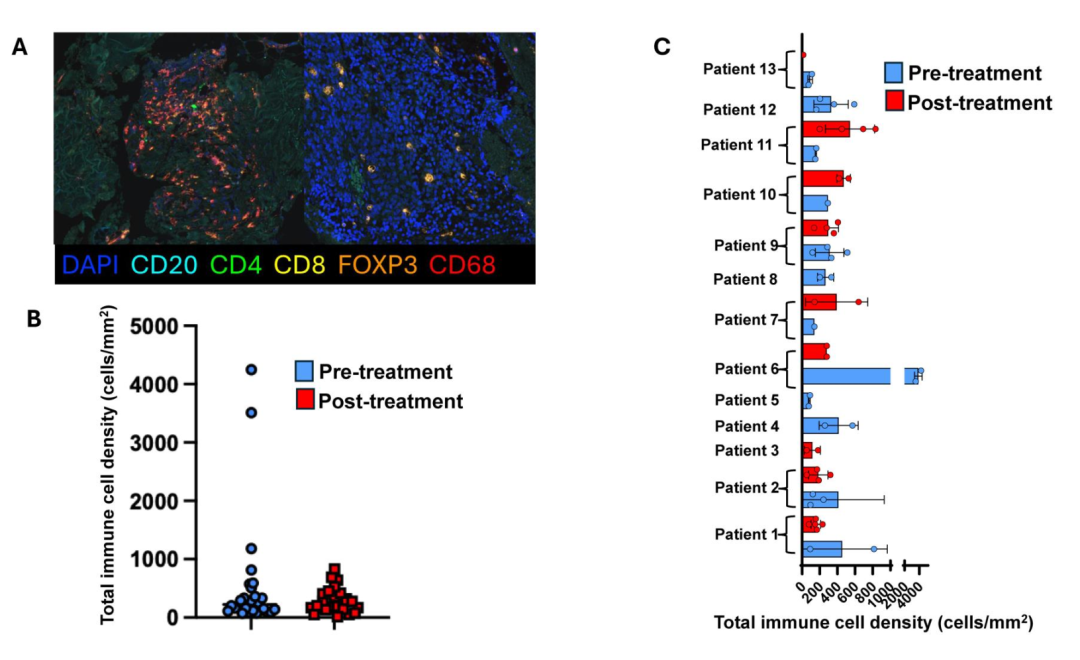
pembrolizumab治疗不会改变EwS总免疫细胞密度
2. 免疫检查点治疗诱导免疫抑制蛋白上调,提示潜在的免疫负反馈
通过GeoMx DSP空间蛋白质组技术对治疗前后肿瘤组织中多个ROI区域进行蛋白表达谱分析,发现治疗后样本中多个免疫抑制相关蛋白显著上调,包括CD163、FOXP3、CTLA4、IDO1、LAG3等。尽管整体蛋白表达谱未呈现大幅变化,仍可观察到特定免疫调控蛋白在肿瘤或间质区增强表达的趋势。这表明PD-1治疗在EwS中可能诱导了反向免疫调节效应,增强了免疫抑制状态。又或是加剧了TME中既有的抑制性信号,从而削弱了T细胞激活与持续效应。
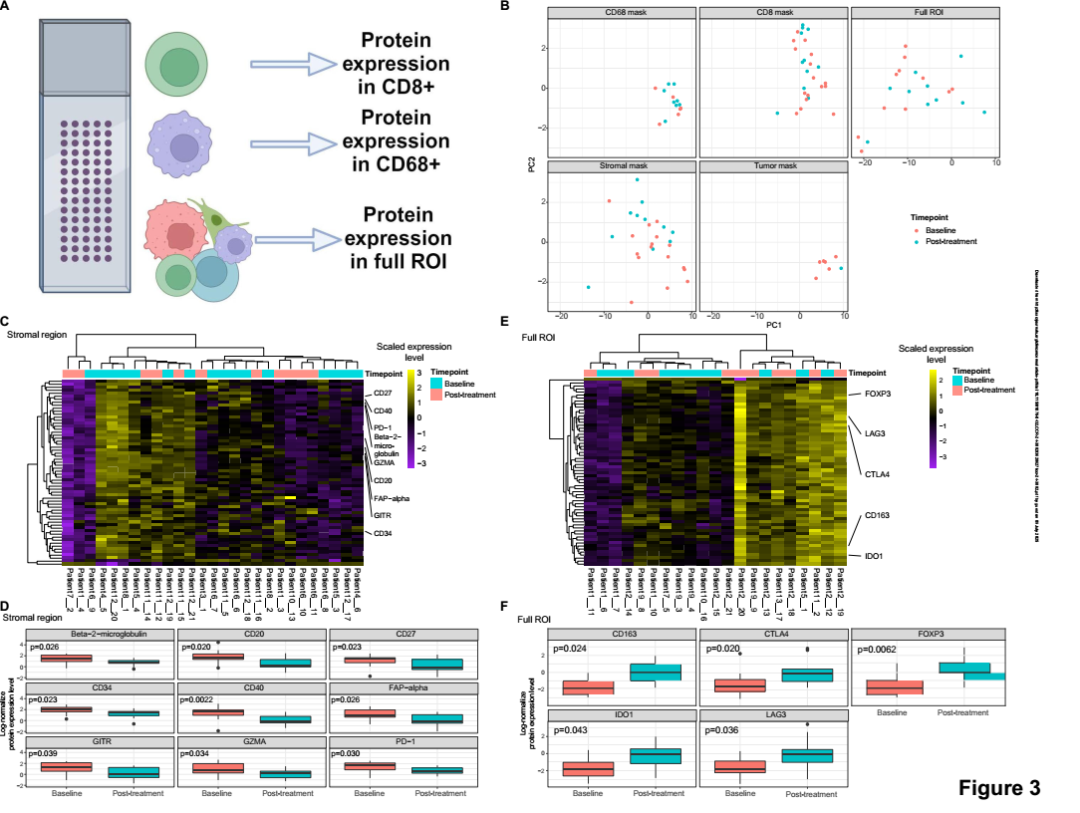
空间蛋白质组分析显示PD-1阻断治疗后免疫抑制相关蛋白表达上调
3. 空间邻域分析揭示免疫抵抗三联征--高TGF-β、低IFN响应、低HLA-I表达
结合CosMx SMI空间转录组数据与整合后的scRNA-seq参考图谱,研究构建了10种空间细胞邻域(cellular neighborhoods, CN)。其中CN10邻域在多个免疫治疗失败患者中反复出现,其主要由两类肿瘤细胞亚群(c1与c4)构成。这些肿瘤细胞亚群具有显著的TGF-β信号活性增强、HLA class I分子表达缺失、干扰素应答能力低下等特征。进一步分析显示,HLA-I表达水平与免疫细胞浸润程度及IFN信号呈正相关,且在EwS细胞系中可通过外源IFN-γ刺激恢复HLA-I表达。这提示CN10所代表的免疫抑制三联征极可能是导致EwS原发性抗PD-1治疗失败的核心机制,同时也指出了可能的逆转方向--靶向TGF-β、增强IFN响应与抗原呈递通路。

空间分辨的肿瘤邻域揭示驱动Ewing肉瘤抗PD-1治疗抵抗的免疫抑制轴
四、小结
这项研究提供了迄今为止最全面的Ewing肉瘤免疫微环境空间图谱,首次明确了治疗失败后肿瘤躲避免疫的三重机制:TGFβ激活、IFN反应缺失、HLA-I表达降低。该文章也提出了几点建议:
-
联合疗法是未来方向,例如联合TGFβ抑制剂、放疗、激活IFN通路等
-
考虑非HLA依赖的免疫策略,如CAR-T等
-
空间组学为研究罕见肿瘤疗效耐药提供新的研究路径
-
在免疫治疗临床试验中,动态获取患者治疗前后的肿瘤样本是至关重要的。