上海生物芯片有限公司
3 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
芯空一号快讯 | 脂肪记得你胖过!Nature文章揭示:炎症、压力、衰老,一切都藏在脂肪里
276 人阅读发布时间:2025-08-28 09:42

在全球肥胖人群超过10亿的大背景下,如何科学理解减重对代谢健康的影响,成为基础与临床研究共同关注的问题。我们知道减重能够显著改善胰岛素抵抗、心血管健康与慢性炎症,但这一过程在脂肪组织层面究竟发生了怎样的变化?有哪些细胞亚群在参与?又是哪些分子路径在主导?
近日,《Nature》发表了一项重磅研究,首次构建了一个涵盖171,247个细胞的人类皮下脂肪组织空间-单核图谱,对极度肥胖患者在减重手术前后脂肪组织的细胞构成、状态转变、调控机制进行了系统解析。研究揭示了减重引起的组织多层级重构,包括炎症缓解、代谢增强及衰老逆转,并发现即便减重后,一些炎症记忆仍然潜伏,可能预示着复胖风险。
样本采集
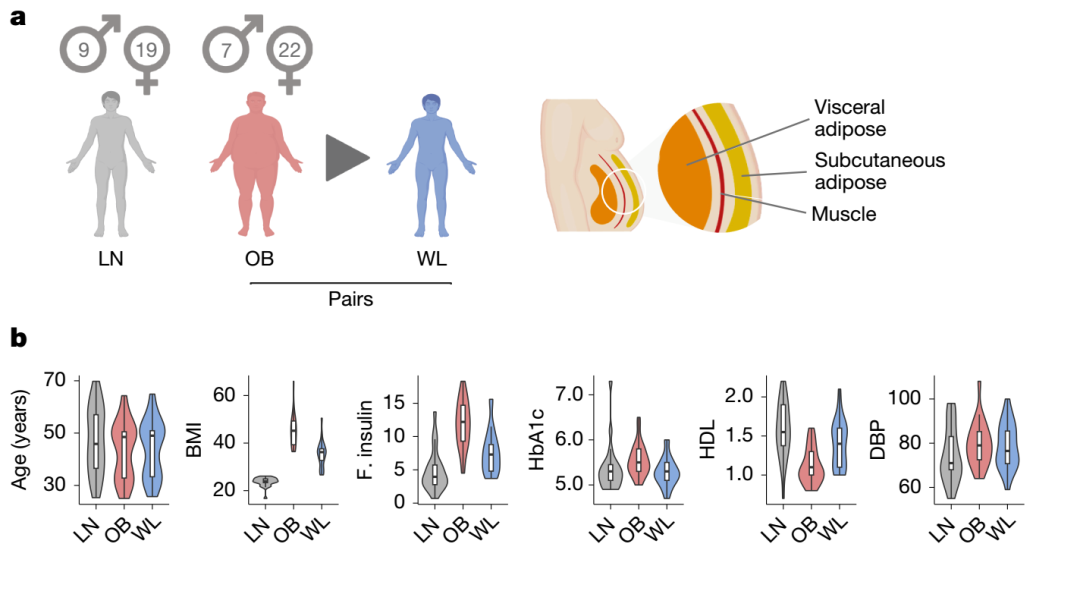
本研究聚焦于肥胖到减重全过程中脂肪组织的动态变化,纳入了以下三组人群:
1.极度肥胖组(OB):共25名受试者,均接受了减重代谢手术(bariatric surgery),提供了手术前后配对的皮下脂肪组织样本;
2.健康瘦人对照组(LN):共24名年龄性别匹配的瘦人志愿者,作为正常基线参考;
3.外部公开数据库补充组:整合了已发表的人类皮下脂肪组织图谱的13个样本(9个肥胖、4个瘦人),用于细胞类型注释与跨研究一致性验证。
研究重点分析腹部皮下脂肪组织(abdominal subcutaneous adipose tissue),因其在代谢综合征、心血管疾病中的病理作用更为显著。
样本采集
技术平台
单核RNA测序(single-nucleus RNA-seq):对来自上述三组共计70人样本中的145,000多个细胞核进行测序;
空间转录组测序(10x Visium):在瘦人、肥胖者、减重后人群中各选取4名,用于空间定位脂肪组织中各类细胞亚型的分布关系及微环境特征,累计获取约25,000个空间spot数据。
关键发现
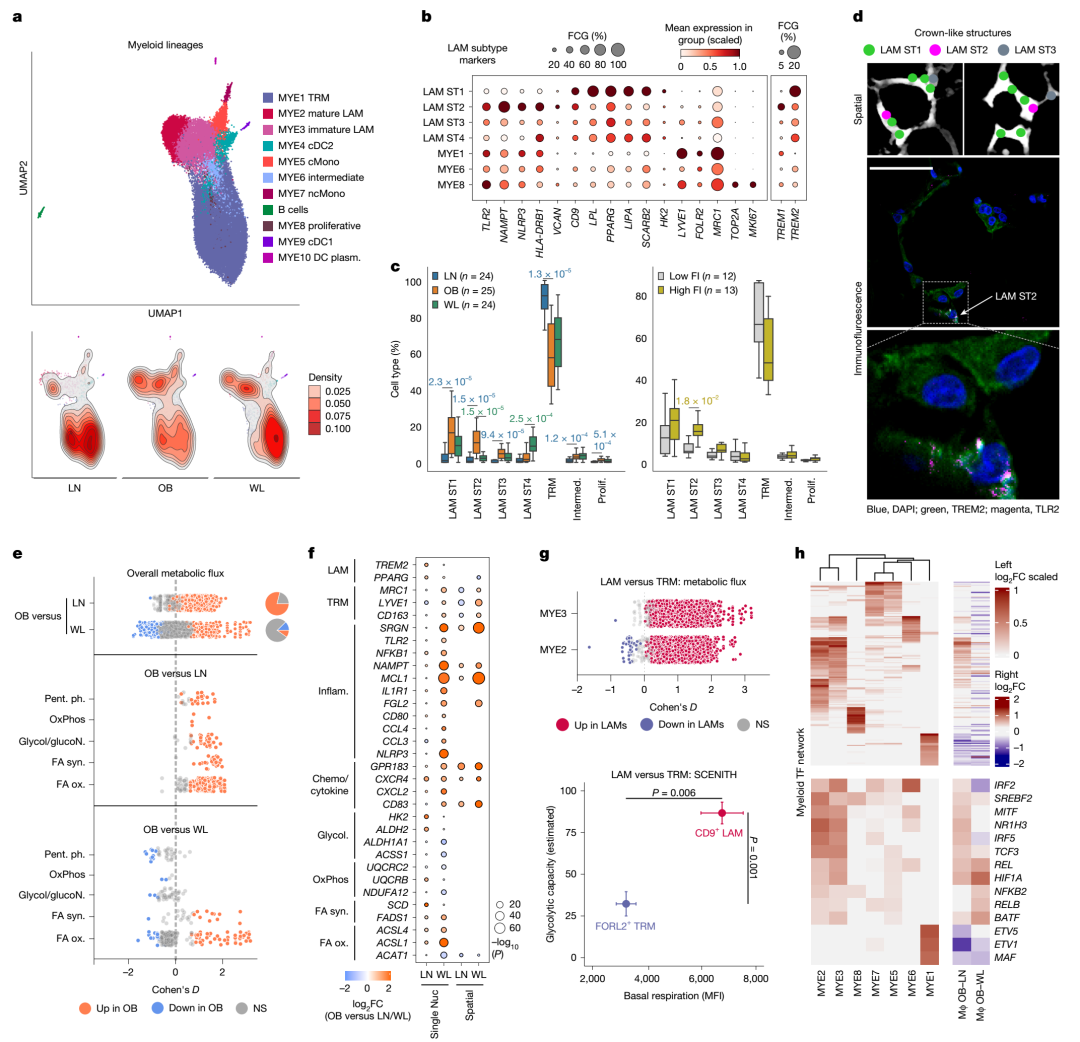
1.肥胖诱导脂质相关巨噬细胞富集及代谢重编程,减重虽抑炎但炎症印记依旧残留
肥胖组织的标志性病理特征之一是巨噬细胞的大量浸润,尤其是富含TREM2⁺/CD9⁺的脂质相关巨噬细胞(LAMs)。研究发现,LAMs在肥胖中数量显著升高,并可进一步分为代谢型(ST1)与炎症型(ST2)亚群。尽管减重可以有效降低LAM数量,并使其趋于代谢型,但炎症型LAM的基因特征依旧残留。代谢通路分析也显示,肥胖导致的脂肪酸氧化、合成及胆固醇代谢通路的过度激活并未在减重后完全逆转,表明脂肪组织的免疫代谢重编程具有较强的持久性。作者推测,这种未清零的炎症激活状态,可能为将来的复胖或代谢异常埋下隐患。
肥胖和减重的免疫细胞浸润、激活和重编程
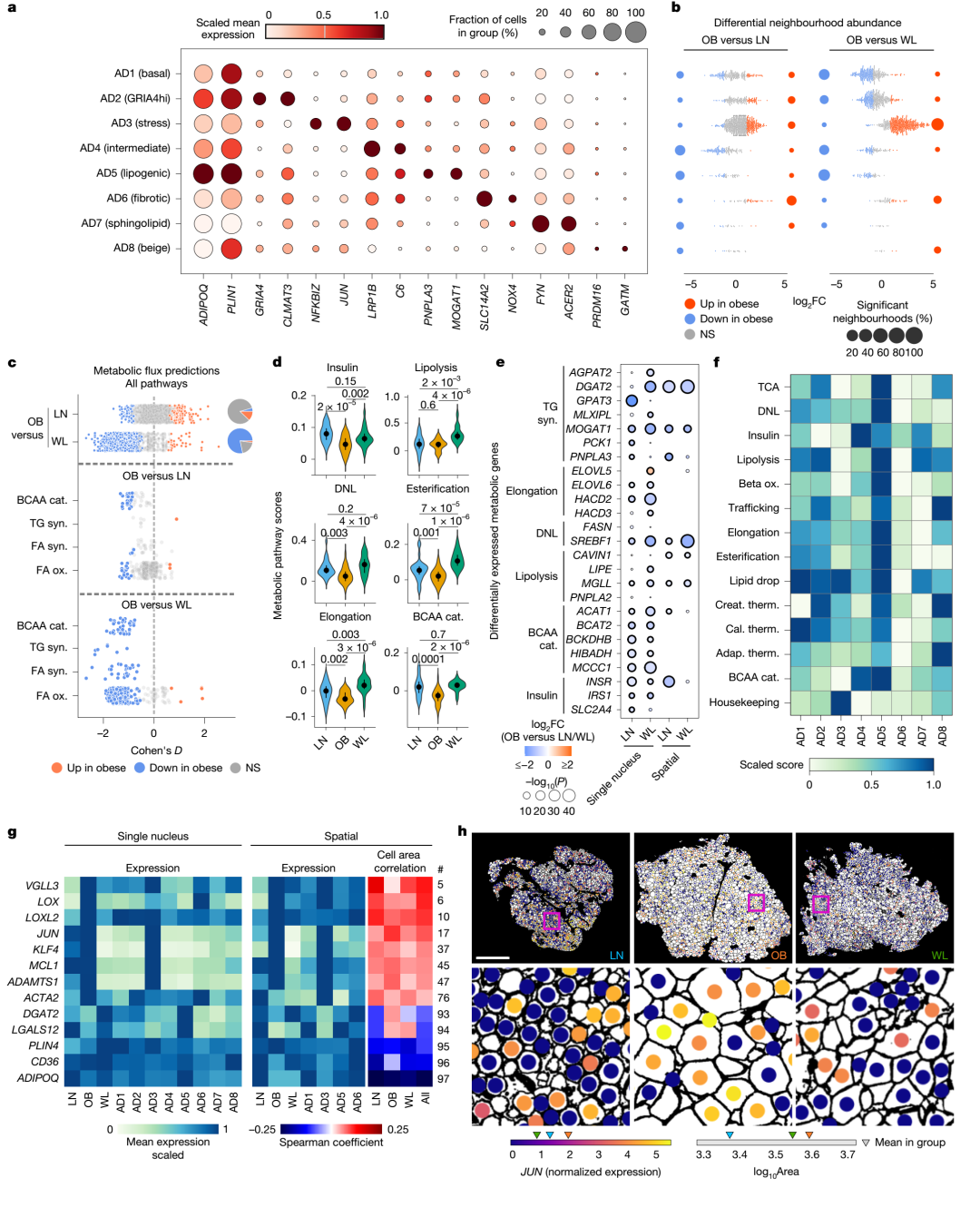
2.成熟脂肪细胞亚群在肥胖中向应激与纤维化谱系倾斜,减重显著增强代谢柔韧性与脂质循环能力
研究识别出8类成熟脂肪细胞亚群,其中高表达JUN与NFKBIZ 的AD3为典型的--压力型脂肪细胞,AD6则呈现纤维化特征。肥胖状态下,压力型与纤维型脂肪细胞显著增加,但AD5脂质合成型脂肪细胞则明显减少。减重后,这一分布趋势发生逆转,压力与纤维型细胞减少,脂质合成能力增强。同时,通过转录组代谢建模,作者发现减重促使脂肪细胞全局代谢通量激增,包括甘油三酯合成、脂肪酸代谢、BCAA代谢与热量生成等多通路活化。减重后脂肪细胞可能通过反复合成再降解甘油三酯,构建了一种高能耗、低毒性的脂质循环新模式,有望成为代谢健康改善的核心机制之一。
脂肪细胞和分子特征的动态调控
3.减重系统性抑制脂肪组织多细胞应激与衰老程式,展现强效去衰老潜力
研究进一步发现,肥胖导致脂肪组织中成熟脂肪细胞、前体细胞、血管内皮及周细胞等多个细胞亚群同时进入一种应激+早衰状态,表现为p21、NFKB1、IL1R1等典型衰老相关基因的上调。空间转录组研究显示,这些细胞常聚集于特定的高压力区域,形成应激小生态位。减重后,这些p21⁺衰老细胞几乎完全消失,并伴随着NAMPT、CXCL2等SASP因子的明显下调。此外,网络分析揭示AP-1家族、KLF4、SREBF1等多个转录因子可能协同调控这一衰老-应激-炎症-损伤的循环网络。作者认为,减重不仅是一种代谢干预,更可能具有强效去衰老潜力(想长寿,先减肥,是真的)。
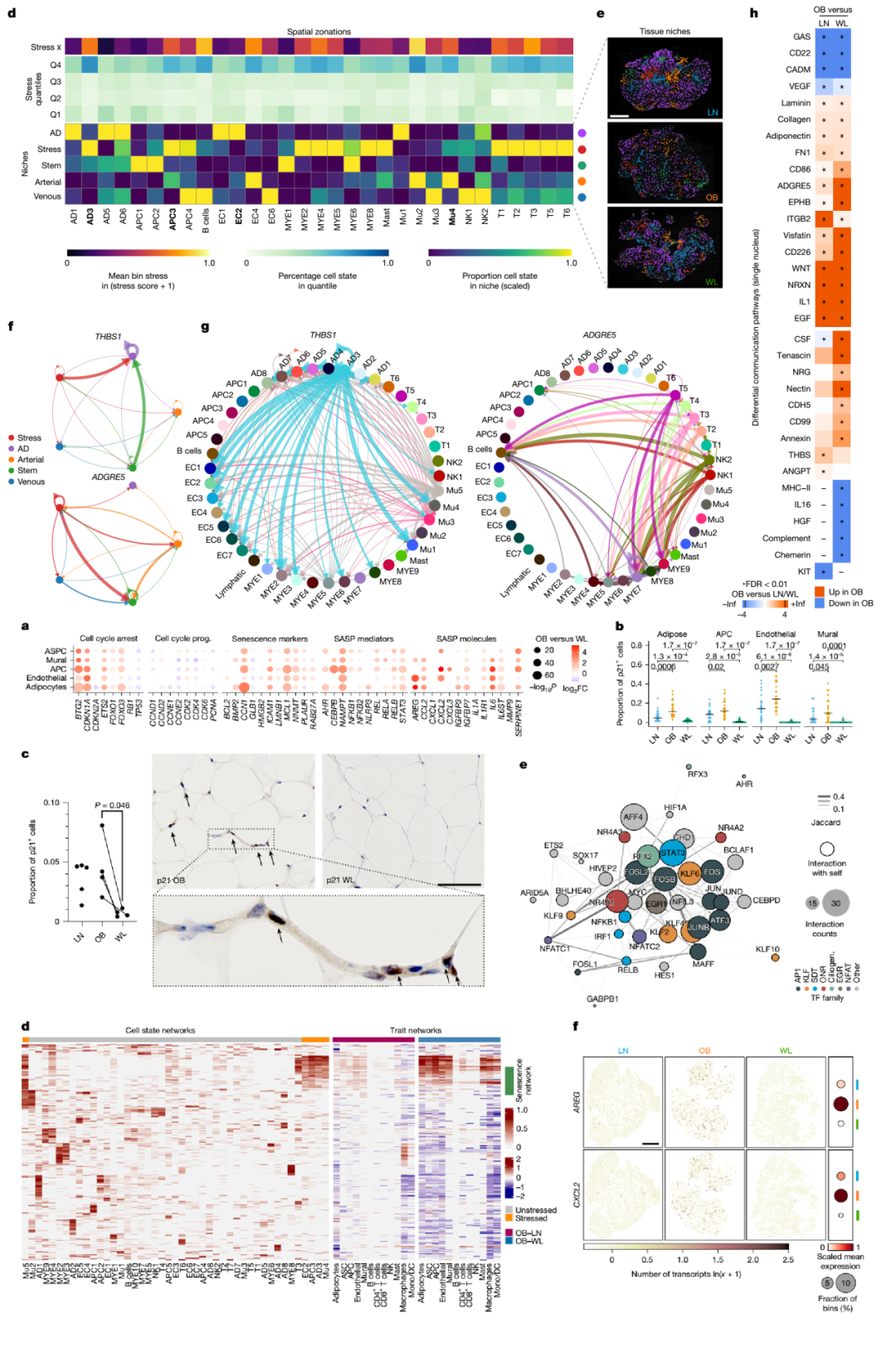
WL能有效逆转衰老
文章总结
本研究凭借大规模、配对的人体样本,结合单核与空间转录组技术,系统描绘了肥胖到减重过程中脂肪组织在细胞组成、空间结构、代谢通量与衰老状态等多层级的重塑轨迹。研究不仅揭示了脂肪组织中多谱系细胞对肥胖刺激的选择性、易损性,还发现减重带来的改善是多层级、部分可逆、但仍有残留印记的复杂过程。尤其是对免疫细胞代谢记忆、脂肪细胞压力谱系、以及去衰老效应的解读,为我们理解减重如何改善系统代谢健康提供了细节视角。
然而,作者也提出了一个耐人寻味的问题:当炎症型巨噬细胞的激活记忆仍残留,脂肪组织是否真的彻底痊愈? 减重是起点,不是终点。未来,如何在减重基础上进一步巩固组织代谢状态、干预复胖风险,仍是精准代谢治疗亟待解决的方向。