上海生物芯片有限公司
3 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
推荐产品
公司新闻/正文
化疗后T细胞为何失效?多组学研究揭示卵巢癌免疫治疗新突破
157 人阅读发布时间:2025-02-12 10:10

文章题目:化疗诱导卵巢癌中髓系细胞驱动的空间受限性T细胞衰竭
期刊:Cancer Cell IF:48.8
1 文章背景
抗肿瘤免疫对高级别浆液性卵巢癌(HGSC)的预后极为关键,然而其在标准化疗过程中的适应性变化却尚未被充分理解。肿瘤的发生与进展依赖于恶性细胞通过复杂的细胞间相互作用来逃避宿主免疫系统的监视,其中T细胞耗竭现象会导致T细胞功能减退,不过部分耗竭的T细胞可通过免疫检查点阻断(ICB)疗法重新激活。HGSC作为最常见的卵巢癌亚型,具有高度侵袭性,一线新辅助化疗(NACT)常用于治疗不可切除或伴有并发症的患者,但多数患者最终会产生治疗耐药性。空间技术的发展为深入探究肿瘤微环境提供了可能,鉴于ICB的疗效取决于相邻细胞间的空间相互作用,因此深入理解化疗期间肿瘤生态系统重塑的空间动态变化对于优化卵巢癌治疗策略具有重要意义。
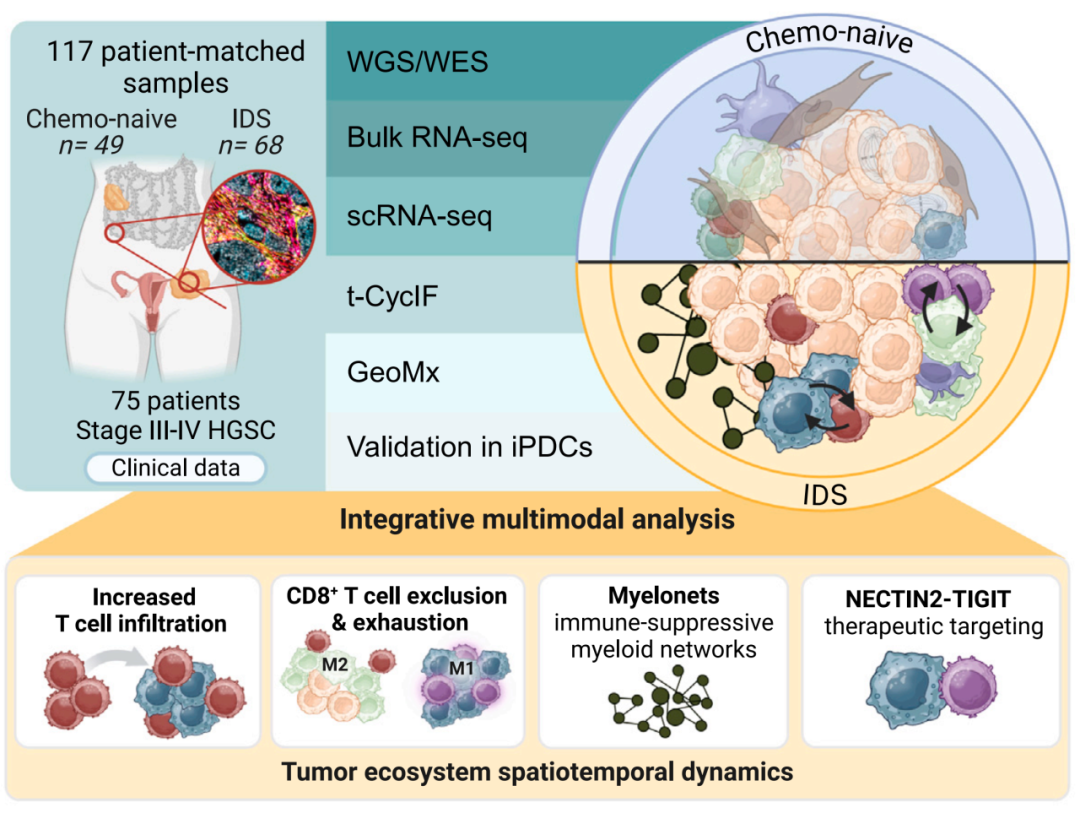
图形摘要
2 多组学技术
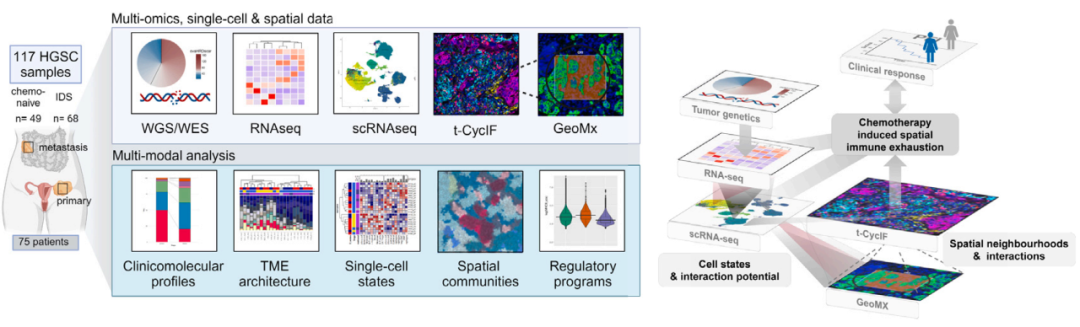
多组学技术路线
3 文章结论
化疗改变了卵巢癌肿瘤微环境,髓系细胞驱动的T细胞耗竭主要发生在“髓鞘网”(Myelonets)和肿瘤-基质界面等特定的空间区域。同时,化疗增强了巨噬细胞与CD8+T细胞之间的相互作用,且NECTIN2-TIGIT信号轴在临床前免疫检查点阻断反应中有预测作用,可能为改善卵巢癌治疗提供新的免疫治疗策略。
未接受化疗的样本和IDS样本之间的差异
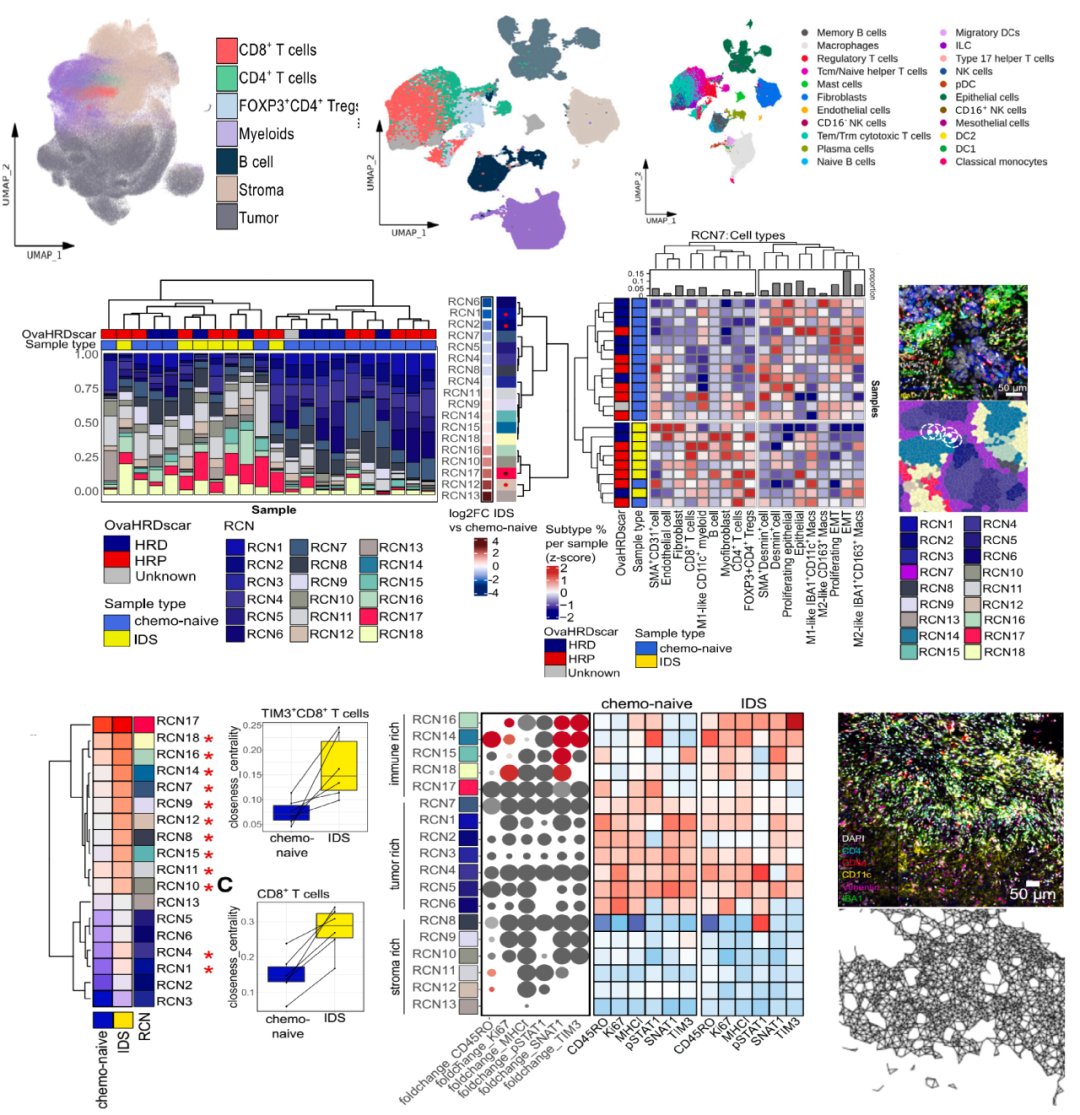
化疗对卵巢癌肿瘤微环境中细胞组成、分布及相互作用的影响
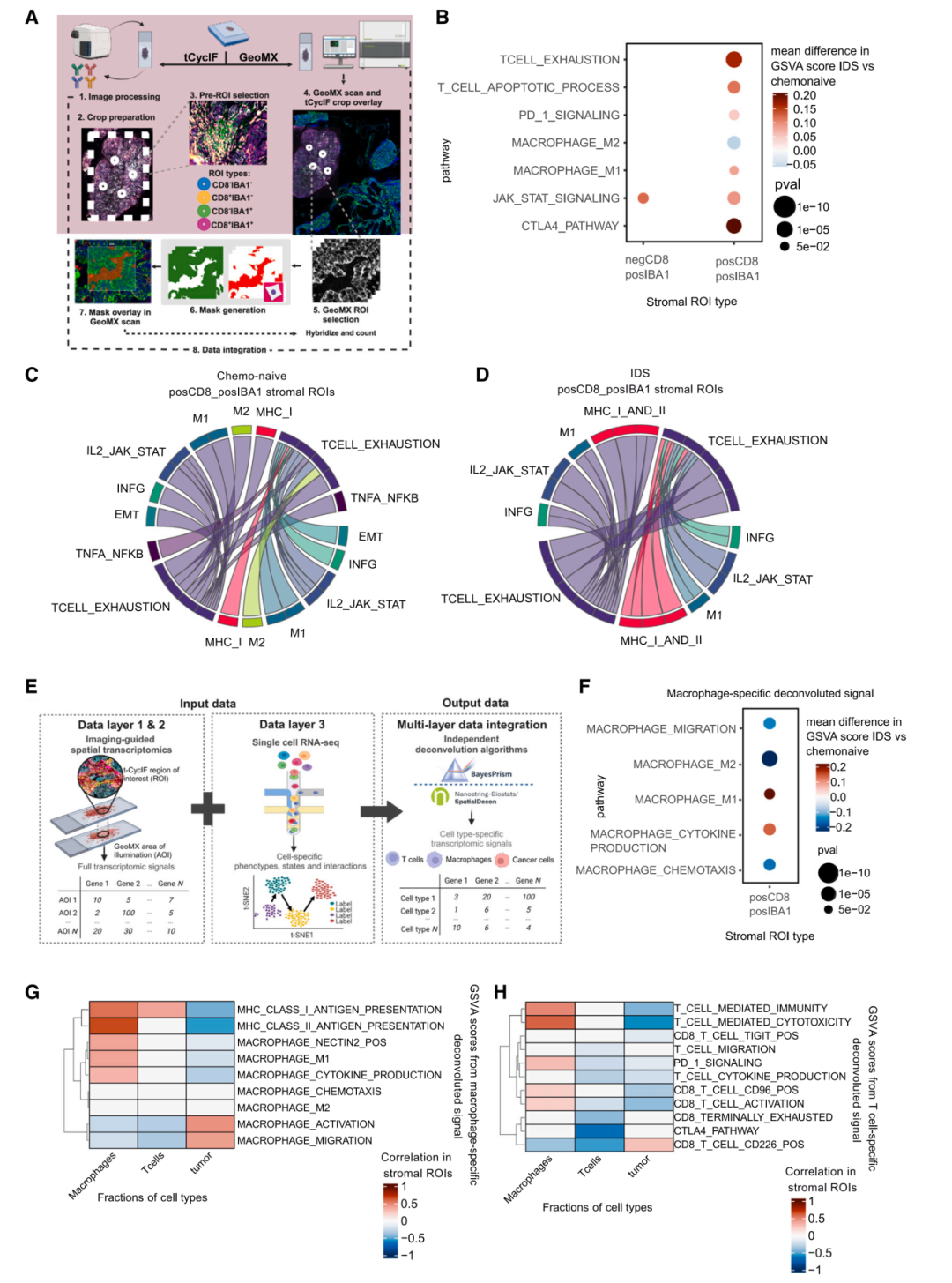
GeoMx空间转录组学揭示了不同CD8+T细胞和髓样细胞丰度区域之间通路活性的差异
通过功能性免疫学平台验证抗TIGIT和抗PD-1联合治疗在化疗后卵巢癌中的效果,揭示了NECTIN2-TIGIT信号轴在治疗响应中的关键作用。研究通过患者来源的免疫活性三维培养体系(iPDCs)发现,化疗后样本中的CD8+T细胞对抗TIGIT抗体(tiragolumab)单独或与抗PD-1抗体(pembrolizumab)联合治疗表现出显著的激活,伴随颗粒酶B、IFN-γ和Ki67表达增加。此外,化疗诱导的NECTIN2高表达髓系细胞与TIGIT+ CD8+T细胞的比例显著相关,而这一信号通路的活跃程度能够预测免疫检查点抑制剂(ICB)治疗的效果。结果进一步表明,TIGIT表达水平较高的CD8+T细胞在联合治疗中具有更强的响应潜力,这强化了靶向NECTIN2-TIGIT信号在化疗后免疫治疗中的价值。
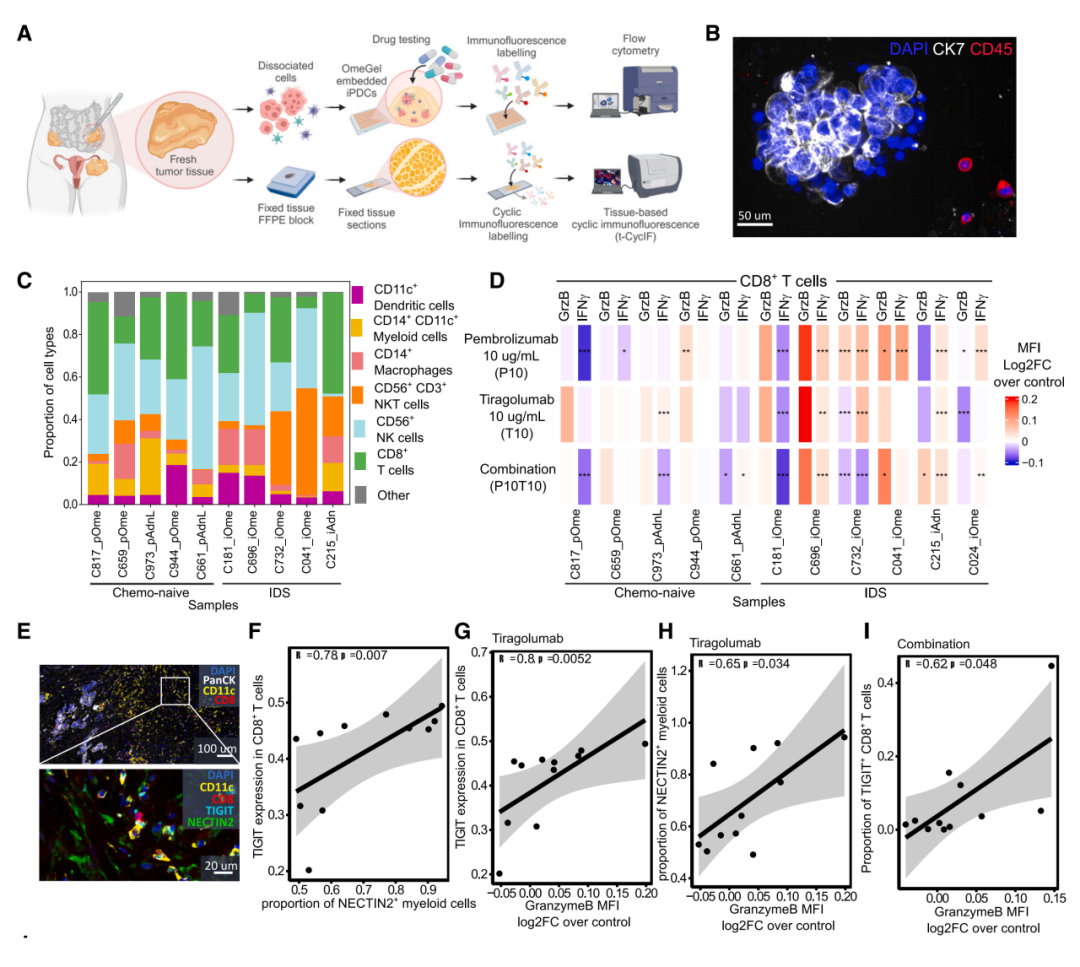
具有免疫能力的患者源培养物在抗TIGIT和抗PD-1治疗后显示T细胞活化
4 文章总结
本研究通过多组学分析深入探讨了化疗对卵巢癌肿瘤微环境的影响,揭示了化疗后CD8+T细胞的衰竭与髓系细胞的相互作用在卵巢癌免疫逃逸中的重要作用。研究发现,在髓系细胞密集的区域,化疗不仅导致CD8+T细胞的显著浸润,同时也引发了T细胞衰竭。髓系细胞与T细胞之间的相互作用通过NECTIN2-TIGIT信号轴增强,促进了T细胞的免疫抑制状态。此外,化疗改变了肿瘤微环境的空间结构,髓系细胞和CD8+T细胞的相互作用在肿瘤间质和髓系细胞丰富的区域尤为突出。研究进一步通过免疫治疗平台验证了抗TIGIT疗法在化疗后具有潜在的治疗效果,发现TIGIT高表达的CD8+T细胞在接受免疫检查点抑制剂治疗后表现出更强的激活响应。这些发现揭示了髓系细胞驱动的T细胞衰竭在化疗后的免疫逃逸中的核心作用,在化疗后患者中通过靶向NECTIN2-TIGIT信号轴可能有效改善免疫治疗反应,为卵巢癌免疫治疗提供了新的靶向策略。