江苏赛昂斯生物科技有限公司
3 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
技术资料/正文
小动物跑步机 | RhoA通过ERK信号通路与TPM4相互作用促进大鼠肌筋膜触发点疼痛
53 人阅读发布时间:2025-08-21 17:08

论文上线截图
抑郁症常发生在有其他合并症的患者中,特别是在慢性疼痛的情况下。目前,在慢性疼痛条件下抑郁症的分子机制和合适的动物模型研究尚不多见。血小板源性生长因子受体(PDGF/PDGFR)在神经保护中的作用存在矛盾,有待于进一步研究。在本研究中的MPS大鼠抑郁模型中,磷酸化PDGFR-α以及炎性因子水平显著上调。PDGFR-α或JAK2/STAT3抑制剂治疗可减轻MPS大鼠的抑郁行为,降低炎症因子水平。
这些结果表明,PDGFR-α可诱导MPS大鼠的神经炎症、自噬改变和抑郁行为,可能是由JAK2/STAT3信号通路介导。因此,PDGFR-α极有可能是治疗此类抑郁症的一个潜在靶点。
1. MPS大鼠表现出抑郁样表型,伴随海马中炎症因子表达增加和自噬水平降低
首先,文中建立MPS大鼠模型12周并每周测量体重1次。大鼠体重变化的结果显示,在相同的喂养条件下,与对照组相比,MPS大鼠的体重显著降低(图1a)。RandallSelitto测试的结果显示,MPS组的机械性退缩疼痛阈值从建模后第二周开始下降,并一直维持到构建结束(图1b)。这表明MPS大鼠在开始表现出持续的疼痛状态和缓慢的体重增加。(Randall-Selitto通常指鼠爪压力疼痛测试,是一种用于测量动物疼痛反应的技术,常用于基础疼痛研究和镇痛药效果测试。)
接下来使用经典抑郁症行为测试评估了MPS大鼠的抑郁样行为(图1c)。通过悬尾测试、强迫游泳以及蔗糖偏好试验的结果表明:与对照组大鼠相比,MPS大鼠悬尾实验的不动性增加、强迫游泳的时间减少以及蔗糖消耗减少,上述实验结果表明MPS大鼠动物表现出行为绝望。
此外,Western Blot的结果显示,相较于对照组大鼠,MPS大鼠海马中IL-1β、IL-6、TNF-α和p62的蛋白质水平显著增加,在MPS暴露12周后在大鼠中观察到BDNF、5HT1AR、LC3-II/LC3-I和Beclin1表达水平降低(图1d)。
这表明MPS大鼠表现出抑郁表型,伴有神经炎症和自噬水平降低,这有助于在大鼠中观察到的抑郁样行为。
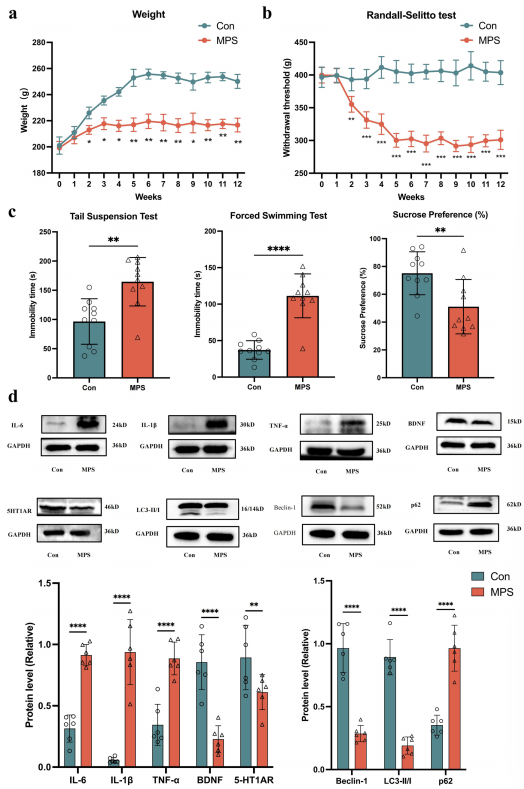
图1. MPS大鼠模型的建立及抑郁表型检测
2. MPS大鼠海马中p-PDGFR-α表达显著增加
免疫组织化学染色结果显示,p-PDGFR-α在MPS大鼠海马的各个亚区广泛表达,而在对照大鼠海马中无表达或低表达(图2a)。如蛋白质印迹分析结果所示,在海马内观察到p-PDGFR-α蛋白水平的显著增加(图2b)。这提示了p-PDGFR-α的升高可能与MPS大鼠抑郁样行为、神经炎症有关。
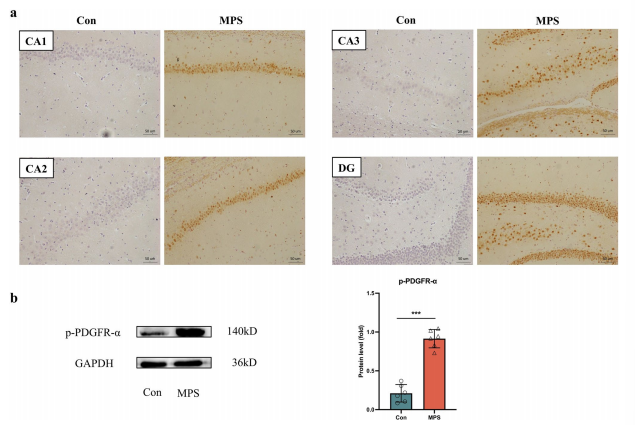
图2.正常大鼠和MPS大鼠海马p-PDGFR-α表达
3. MPS大鼠海马CA1、CA2、DG区尼氏体形态异常、数目减少
尼氏染色结果显示MPS大鼠的尼氏体固缩,数量减少且排列紊乱,与对照组相比,尼氏小体排列紊乱,部分尼氏小体破裂并深染(图3)。
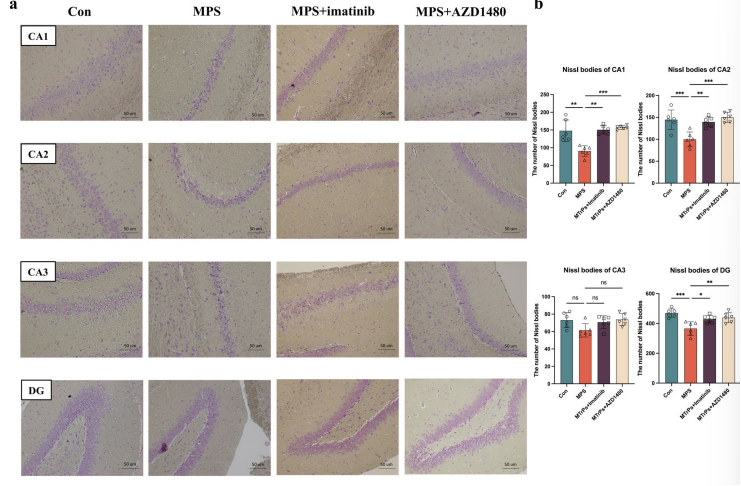
图3.尼氏染色法观察海马形态学及尼氏体计数
4. MPS大鼠海马自噬体数量减少
Western blot检测结果显示,LC3II/LC3-I和Beclin1表达水平降低,p62表达水平升高。这些自噬相关蛋白的表达变化为MPS大鼠海马自噬活性降低提供了证据。同时,电子显微镜图像显示MPS大鼠海马中自噬体的数量显著减少(图4)。
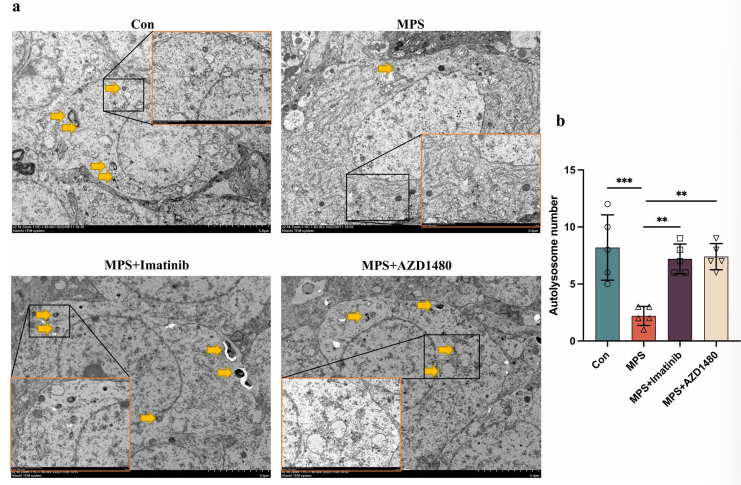
图4.抑制p-PDGFR-α或JAK2/STAT 3信号通路能恢复正常MPS大鼠海马中的自噬活性
5. MPS大鼠海马小胶质细胞和星形胶质细胞的活化
实验人员通过免疫荧光结果染色显示,MPS大鼠海马DG和CA1亚区中的GFAP表现出激活状态:细胞体增大,突触变短变厚,同时表达水平增加(图5)。Iba-1也是同样的趋势(图6)。鉴于之前的实验结果表明炎症因子水平有所增加,这表明神经炎症可能参与了MPS大鼠的抑郁样行为。因此,p-PDGFR-α表达的上调可能导致MPS大鼠海马内神经炎症的激活和自噬活性的抑制。
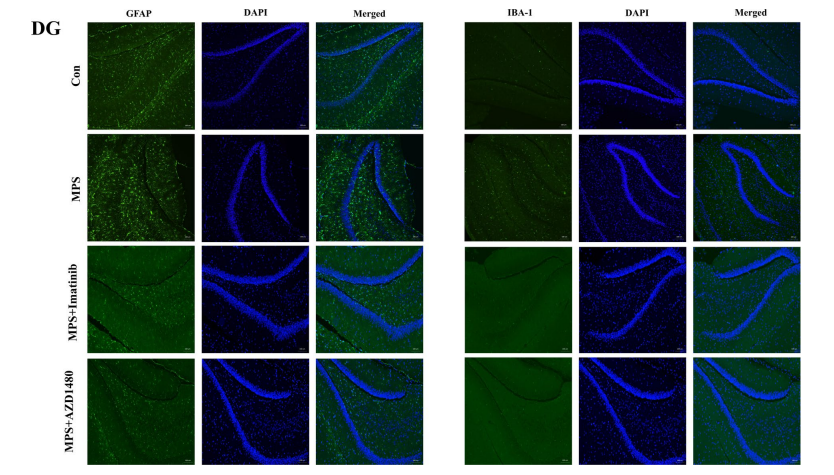
图5.抑制p-PDGFR-α或JAK2/STAT3信号通路可降低DG和CA1区GFAP的表达
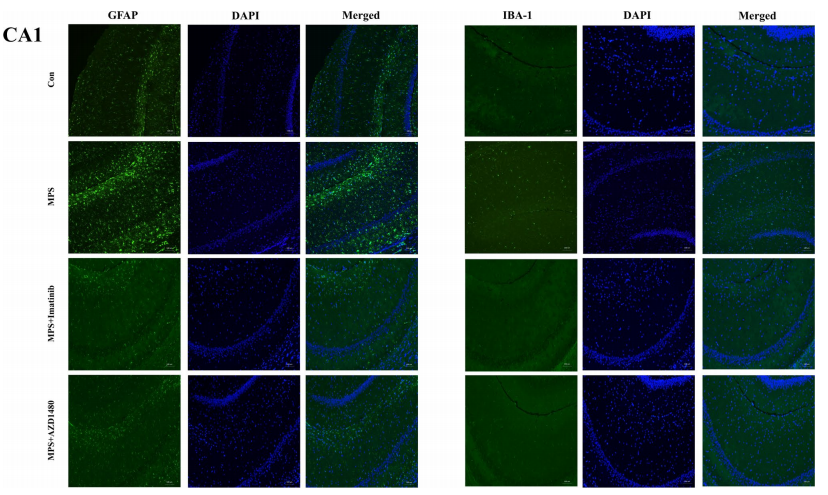
图6.抑制p-PDGFR-α或JAK2/STAT3信号通路可降低DG和CA1区Iba-1的表达
6. 抑制p-PDGFR-α或JAK2/STAT3信号通路可改善MPS大鼠的神经炎症、恢复自噬活性、增加尼氏体和改善抑郁样行为
此外,作者团队提出的一个问题是:p-PDGFR-α的上调是否有助于抑郁症的病理生理学?因此,作者团队在MPS大鼠中分别通过腹腔注射伊马替尼和AZD1480来实现对p-PDGFR-α和JAK2/STAT3信号通路的抑制。蔗糖偏好测试的结果显示,与MPS大鼠相比,抑制p-PDGFR-α或JAK2/STAT3的蔗糖消耗显著增加(图7a)。此外,在强迫游泳和悬尾试验中观察到抑制p-PDGFR-α或JAK2/STAT3的大鼠中不动性降低和游泳时间增加(图7a)。尼氏染色结果显示尼氏体数量明显增多,分布间隙明显缩小,排列更清晰,碎片固缩现象改善。
上述实验结果表明:抑制p-PDGFR-α或JAK2/STAT3信号通路可改善MPS大鼠的神经炎症和改善抑郁样等行为。
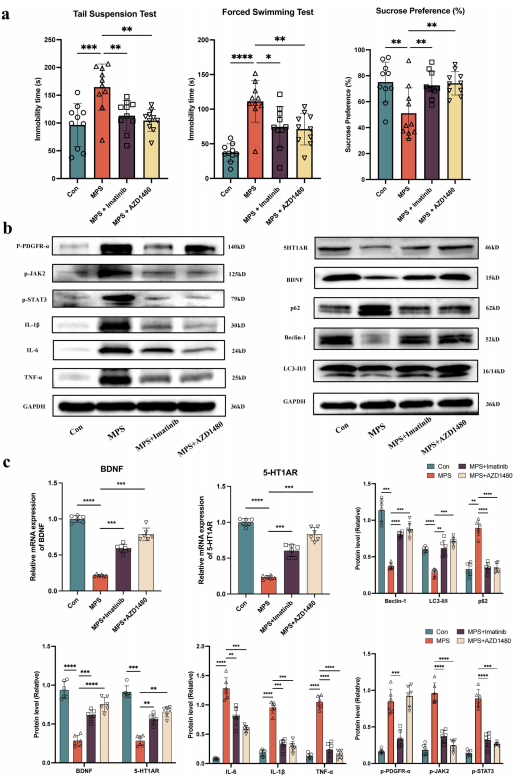
图7.抑制MPS大鼠的p-PDGFR-α或JAK2/STAT3信号通路可逆转MPS暴露产生的抑郁样行为。
结论
总之,本文的研究结果表明PDGFR-α通过激活JAK2/STAT3信号通路,可能在MPS大鼠模型诱导的神经炎症的产生和与抑郁相关的自噬水平中发挥重要作用。因此,这些结果在识别和治疗疼痛和抑郁症方面具有重要的生物学和临床意义。
在该研究中,研究人员使用了赛昂斯小动物跑步机来进行实验操作。

SA101 小动物跑步机
动物跑步机主要用于大小鼠及其他动物训练和新陈代谢研究, 可使训练量化更加准确;是动物体能、耐力、运动损伤、运动生理和病理等研究的必要实验设备。
赛昂斯SA101型小动物跑步机现已焕新升级,不仅拓展了功能模块,更带来了前所未有的便捷操作体验。

// 技术参数
1. 七寸IPS 1024*768高清显示屏,可视角度178°;
2.可设置多种运动模式:匀速、匀加速、匀减速、混合模式加减速等;
3.可保存8种试验协议,自由切换,无需来回设定;
4.区段设置:20个区段,每段RAMP时间、最终速度都可自由设置;
5.力竭方式:单次电刺激时长,总电刺激时长,电刺激次数,运动距离,运动时间;
6.自我保护机制:自动判别并记录力竭时间,停止该跑道的电刺激,保护实验动物;
7.通道数:大鼠6通道,小鼠8通道;
8.光刺激:10000Lux,1~5000Hz频率可调,20~100量级强度可调;
9.声刺激:120db,1000~10000Hz频率可调,20~100量级强度可调;
10.电刺激:0.1mA~10mA可调,扫描式无死角,扫描精度0.1ms;
11.跑道倾斜度自由调节,调节范围:-25°~25°;
12.速度控制范围0-100m/min,步进0.1m/min;
13.RAMP时间调节范围:0.1~100min;
14.仪器可保存1000组实验数据,通过U盘导出,并保存为.CSV格式文件;
15.实时显示:运动距离、运动时间、电击次数、电击时长、运动状态、力竭状态、速度、加速度、刺激模式;
16.跑台主机:长宽高:220×220×310mm,重量:7kg,功率300W;
17.跑台底座外观尺寸:850×850×450mm,总重量:约45kg;
18.单个跑道尺寸,大鼠:800×90×120mm,小鼠:800×60×105mm;
19.单个电刺激区域尺寸,大鼠:120×120mm,小鼠:120×60mm。