江苏赛昂斯生物科技有限公司
3 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
技术资料/正文
小动物跑步机 | 陆军军医大学李旻典/张志辉发现改变进食时间增强体能的分子机制
93 人阅读发布时间:2025-03-19 11:25

论文上线截图
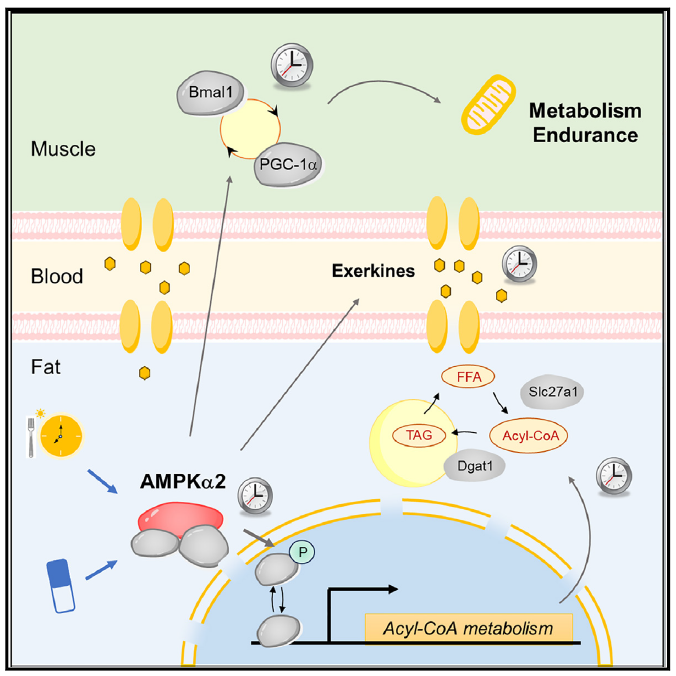
机体运动耐力需要不同器官系统的协同作用。工作状态的肌肉组织通过分泌信号代谢物、细胞外囊泡、激素及细胞因子物质,增强线粒体代谢和脂解作用,从而提升心血管代谢适应性。摄食节律对能量代谢和运动耐力的调控存在差异性。在活跃期摄食(即小鼠夜间限食NRF,类似人类16:8间歇性禁食),可增强能量代谢的昼夜节律性,并在西方饮食干预下有效预防肥胖、脂肪肝和糖尿病。与之形成对比的是,日间限食(DRF或称逆相位摄食,类似人类斋月式禁食)联合常规饮食可显著提升雄性和雌性久坐小鼠及训练小鼠的肌肉氧化能力和运动耐力。摄食时序以组织特异性方式(尤其针对肝脏和性腺周围白色脂肪组织GWAT)同步外周组织的昼夜节律。在小鼠模型中,DRF可在7天内逆转肝脏和脂肪组织的昼夜转录组和/或生物钟节律,且不改变下丘脑中枢时钟。目前GWAT的昼夜节律研究主要基于普通RNA测序(RNA-seq)。鉴于肝脏中转录组与蛋白质组/代谢组的差异性,超越测序技术的多组学研究对阐明昼夜节律机制至关重要。
本研究通过整合磷酸化蛋白质组学、脂质组学等多组学分析发现,日间限食(DRF)可调控小鼠性腺周围白色脂肪组织(GWAT)中线粒体蛋白质组、中性脂质组及营养感应通路的昼夜节律,并发现脂肪细胞AMPKα2信号通路是脂肪-肌肉间昼夜代谢协同的关键调控枢纽,从而显著增强运动表现。
1. DRF在蛋白质组和脂质组中诱导新的节律
为了确定有助于运动调节的脂肪细胞固有的节律性通路,作者采用了深度覆盖的定量蛋白质组学和磷酸化蛋白质组学方法(或diaPASEF),并对时间限制喂食(TRF)的雌性小鼠的性腺周围白色脂肪组织(GWAT)进行多组学分析(图1A)。GWATs每4小时从9周龄的C57BL/6J雌性小鼠中解剖出来,这些小鼠已经接受了日间限食(DRF)或NRF喂养7天。
在DRF期间,Nono和Wdr5的日常平均水平低于NRF期间。通路分析显示,核糖体、胰岛素信号和AMPK信号通路是上调最显著的通路之一(图1B),而糖鞘脂生物合成和溶酶体通路则是下调最显著的通路之一(图1C)。
作者根据在蛋白质组学分析中检测到的蛋白质,从mRNA中提取昼夜统计数据并进行比较分析。作者发现,在DRF期间,80.4%的节律性蛋白质表现出24小时的新节律(图1D)(图1E)。与线粒体相关的新生节律(DNR)蛋白质被富集到11个功能簇中,包括氧化磷酸化和脂肪酸代谢过程(图1F)。在NRF期间,GWAT中有58.5%的节律性蛋白质是DNR(图1G)(图1H)。此外,与NRF相比,DRF下获得新生昼夜节律的脂质类别更多(图1K)。总之,作者确定了线粒体能量代谢和中性脂质代谢是与GWAT中DRF相关的显著新生昼夜特征。
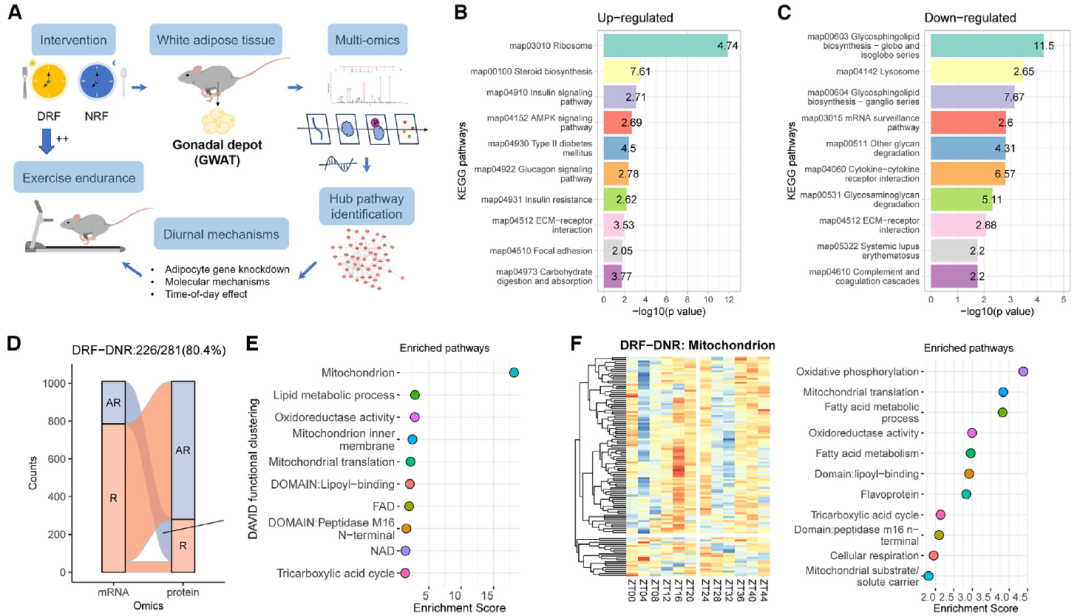
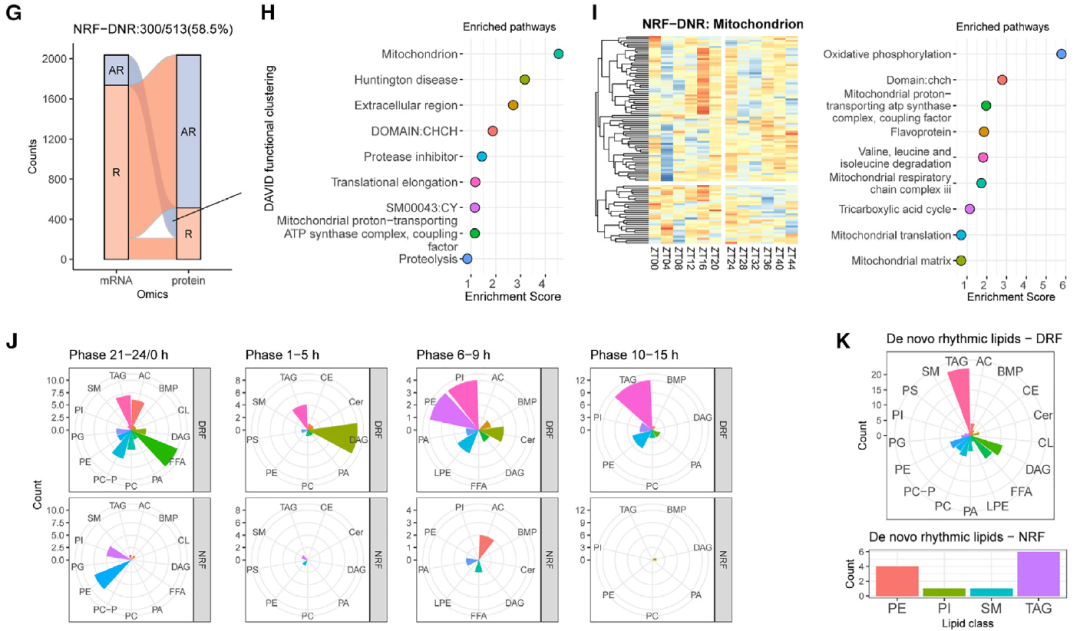
图1. DRF在蛋白质组和脂质组中诱导新的节律
2. DRF诱导脂肪AMPKa2信号通路
GWAT内mRNAs与蛋白质之间的昼夜节律不一致,提示翻译后修饰(如磷酸化)可能参与其中。核心时钟基因的表达谱分析显示,与ALF或NRF相比,肝脏时钟完全适应了DRF。昼夜节律的对齐喂养或NRF使最多的节律性位点呈现节律性,其次是DRF,最后是ALF(图2A)。与ALF或NRF相比,DRF显著降低了来自昼夜节律时钟的昼夜位点的幅度(图2C)。
相位集富集分析发现DRF通路在睡眠期聚集,而NRF和ALF的通路主要限制在活跃期(图2F)。mTOR信号通路和PPAR信号通路是DRF期间得分最高的信号通路(图2G)。
与NRF或ALF相比,AMPK信号通路是DRF期间最上调的信号通路(图2H)。在骨骼肌中,胰岛素/mTOR信号通过mTOR介导的AMPKa2(由Prkaa2编码)在Ser377处的磷酸化激活AMPK。p-Prkaa2在DRF和NRF期间均呈现节律性,并且在DRF和NRF之间相位相反(图2I)。总之,磷酸化蛋白质组学分析揭示了营养感应通路在TRFs期间昼夜节律中的核心作用,其中AMPKa2信号通路被DRF诱导并适应喂养节律。
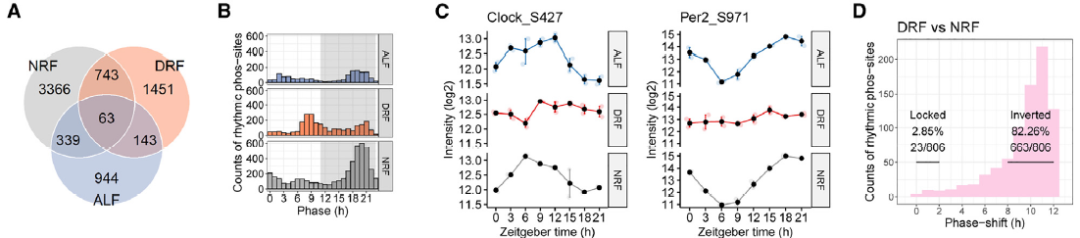
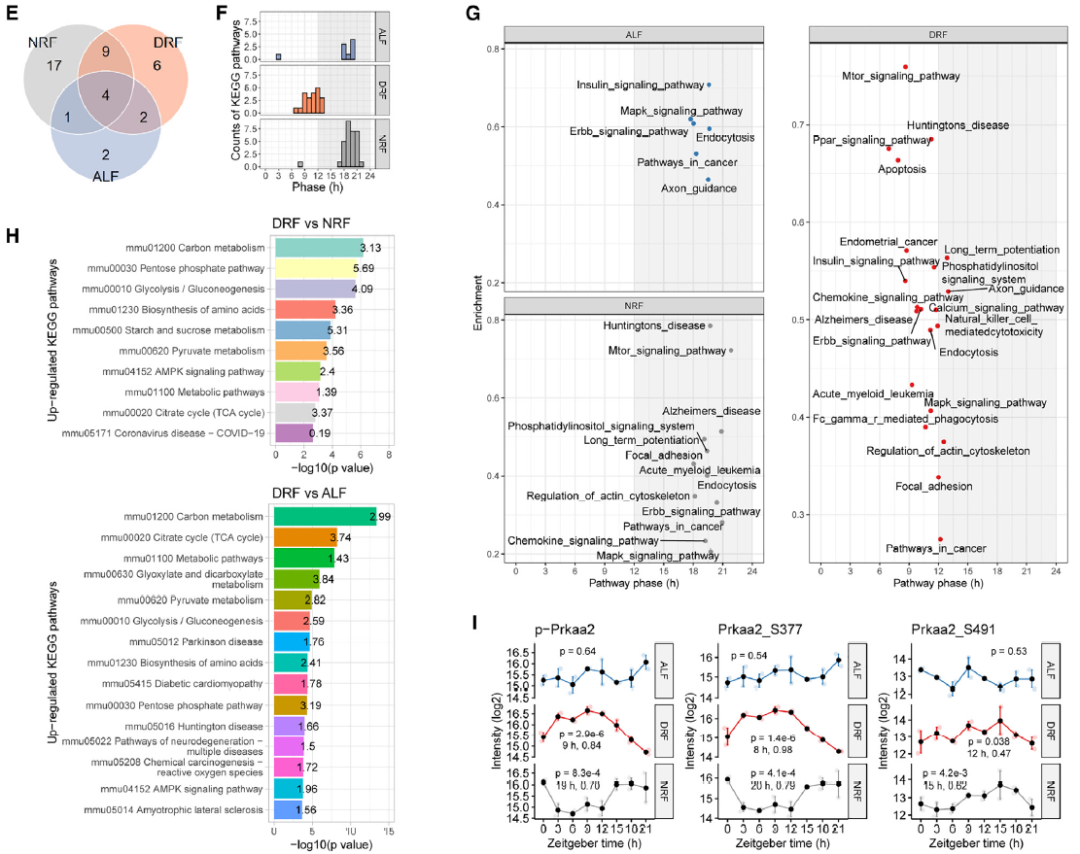
图2. DRF诱导脂肪细胞中的AMPK信号通路
3. DRF通过脂肪细胞AMPKa2信号通路增强跑步耐力
接下来,作者测试了脂肪细胞AMPKa2信号通路对运动表现有贡献的假设。作者采用AMPK复合体的脂肪细胞特异性基因敲低模型,在运动表型分析中, Prkaa2FKD小鼠总体上表现出更差的跑步耐力,尤其是在DRF下(图3B)。脂肪细胞中Prkaa2的敲低阻止了与DRF相关的跑步耐力的增加,并未改变氧化纤维和糖酵解纤维之间的肌肉纤维类型转换(图3C)。
为了测试脂肪时钟是否调节运动表现,作者在雌性小鼠中生成脂肪特异性的核心时钟基因敲低模型。ClockFKD在ZT0时降低了Bmal1和Clock的水平(图3D)。在从ALF切换到DRF时,ClockFKD小鼠在耐力跑步方面表现出较差的反应,而Bmal1FKD和对照小鼠在切换后耐力增加,这表明DRF至少部分通过脂肪细胞时钟系统增强了跑步耐力(图3E)。总之,这些结果表明,脂肪细胞AMPKa2信号通路在DRF期间调节跑步耐力。
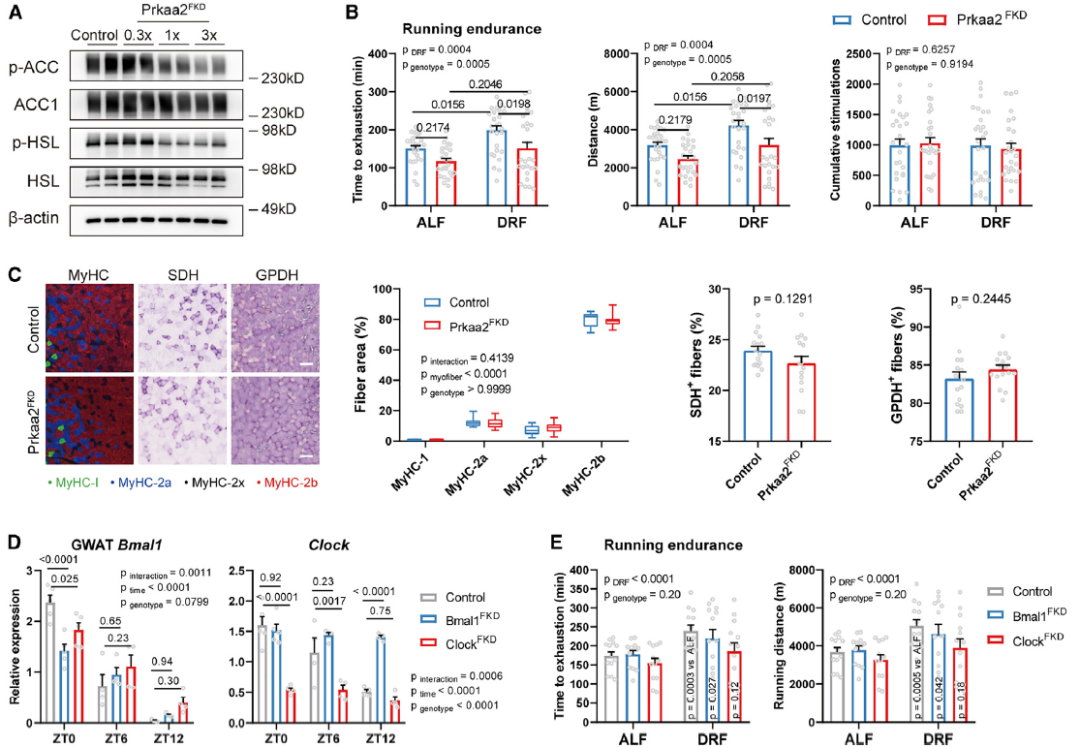
图3. 限时喂食通过脂肪细胞AMPKa2信号通路增强耐力
4. 脂肪细胞AMPKa2调节血清代谢组
为了确定由脂肪细胞AMPKa2调控的脂肪-肌肉信号传导的介质,作者分析了DRF喂养的小鼠中脂肪细胞Prkaa2表达缺失的血清代谢组。N-乳酰苯丙氨酸(Lac-Phe)和尿苷是在对照和Prkaa2FKD小鼠中分别检测到的节律性血清代谢物(图4B)。在Prkaa2FKD和对照小鼠共享的180种节律性代谢物中,只有少数代谢物受脂肪细胞AMPKa2信号传导的调控(图4D)。在Prkaa2FKD组中,Lac-Phe失去节律性,而尿苷则获得节律性。这些发现共同表明,脂肪细胞AMPKa2信号传导调节了对代谢调控至关重要的关键生物化学介质的昼夜节律。
5.脂肪细胞AMPKa2调节GWAT脂质组
接着,作者确定了脂肪细胞AMPK缺乏对昼夜脂质组的影响。在定量的823种脂质中,发现Prkaa2FKD小鼠和对照小鼠的GWAT中分别有139和101种脂质在ZT0和ZT12之间存在差异。在对照组的暗-光转换(ZT0)聚类中,游离脂肪酸(FFA)是具有最大昼夜差异的单一脂质类别(图4F)。然而,Prkaa2FKD小鼠的GWAT中差异FFAs数量显著减少(图4F)。相反,在对照组的光-暗转换(ZT12)聚类中,甘油三酯(TAG)是具有最大昼夜差异的单一脂质类别(图4G)。并且与对照小鼠相比,TAGs的昼夜差异消失(图4G)。
长链酰基辅酶A(CoA)是甘油三酯合成和脂解通量的指标。通过质谱对酰基辅酶A进行昼夜分析发现,Prkaa2FKD小鼠在ZT0时酰基辅酶A含量显著更高(图4H)。
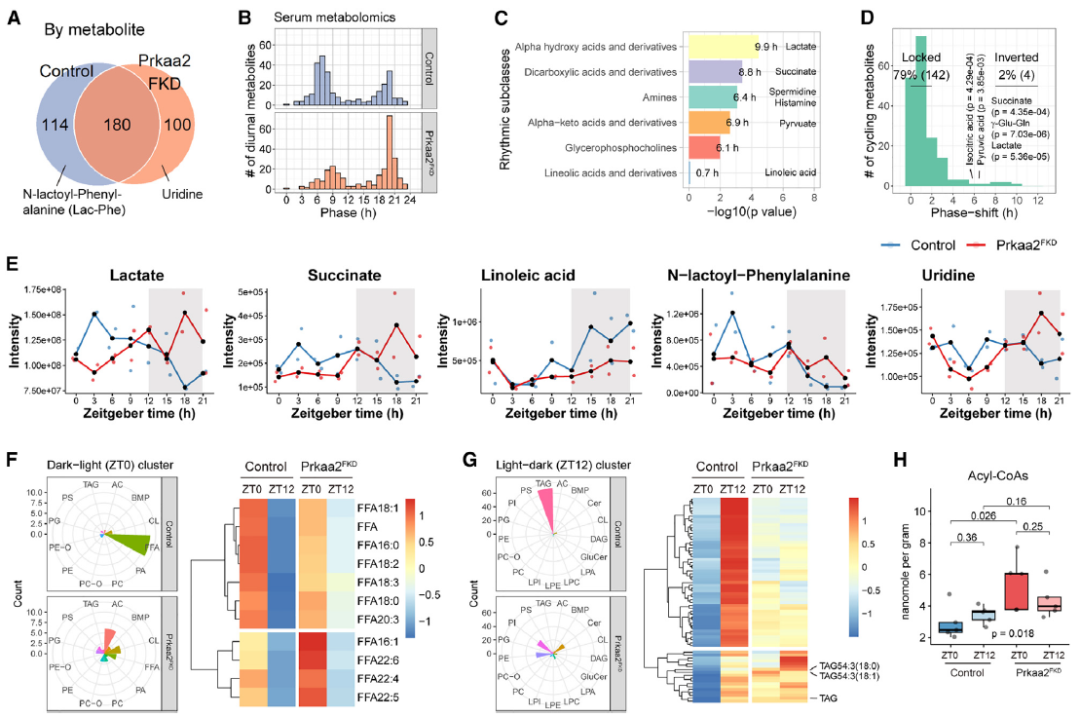
图4. 脂肪细胞AMPKa2调节系统和组织代谢组
6. AMPKa2重置酰基辅酶A代谢相关节律
通过检测核心时钟基因的昼夜表达,作者发现Prkaa2的敲低并未改变多数时钟基因的节律性,这表明,在ALF期间,脂肪细胞AMPKa2可能通过与小鼠肝脏中经典的AMPKa1/2-CRY1轴不同的机制发挥作用。为了探究长链酰基辅酶A的昼夜代谢是否是DRF期间脂肪细胞AMPKa2的作用靶点,作者对涉及长链酰基辅酶A代谢的33个基因进行了综合分析。该分析确定了六个符合这一标准的基因,即Fasn、Acacb、Slc27a1、Dgat1、Acsl1和Hsl(图5A)。
Prkaa2FKD小鼠在DRF期间GWAT中Slc27a1和Dgat1基因失去了昼夜节律性,而Acsl1转录本仍保持稳定的节律性(图5B)。因此,在DRF期间,Slc27a1和Dgat1是在脂肪细胞AMPKa2控制下的稳定昼夜节律基因。磷酸化蛋白质组分析确定了在DRF期间p-Srebf1(S96/S115)和p-Crtc2(S622/S70)的昼夜节律(图5E)。这些发现表明,AMPKa2调节了GWAT中Slc27a1和Dgat1的节律性表达,这与酰基辅酶A代谢、Srebf1和Crtc2的节律性活性相协同。
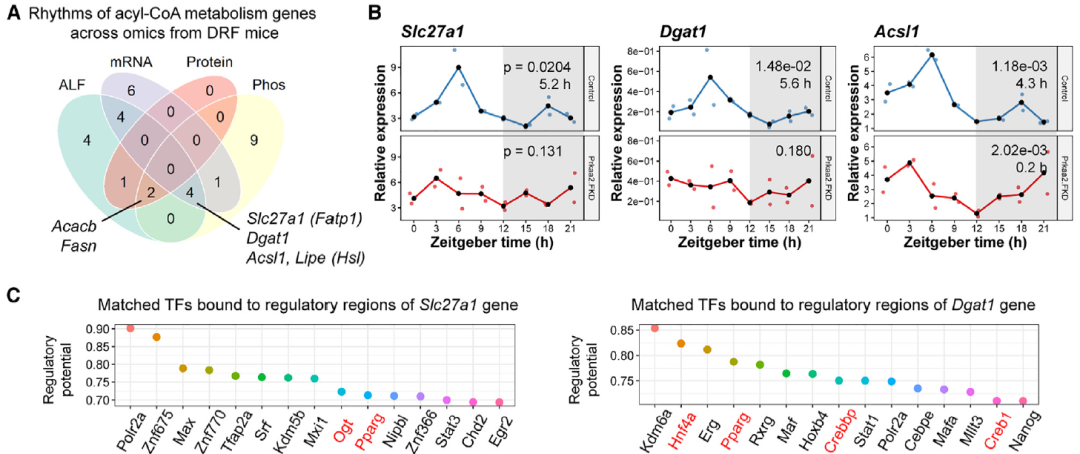
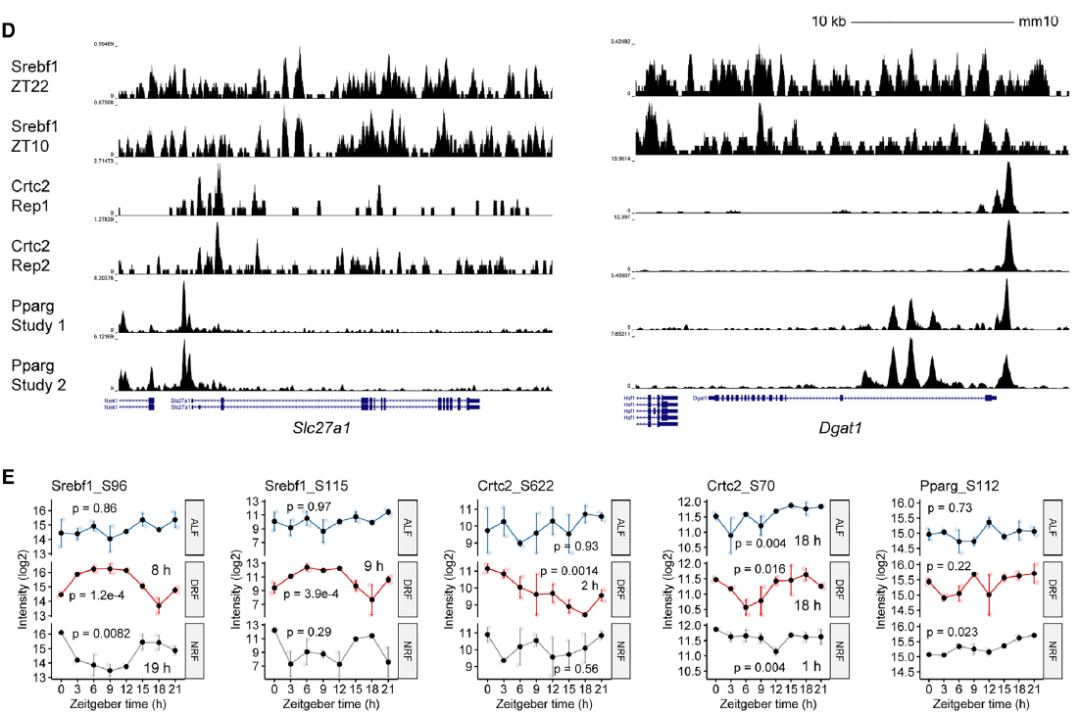
图5. AMPKa2 重置酰基辅酶A代谢相关节律
7. 脂肪细胞AMPKa2缺乏会损害DRF期间的肌肉时钟
为了确定脂肪细胞AMPKa2信号是否因DRF而调节肌肉组织中的昼夜节律,作者比较了DRF期间GWAT和肌肉中的节律性组学谱。相位集富集分析显示,白色脂肪和肌肉组织中发现的节律性基因在许多生物通路中得到富集。因此,DRF期间肌肉中脂质代谢、细胞信号和线粒体功能的昼夜节律与GWAT中的节律同步。
肌肉Bmal1对于DRF下的运动表现至关重要,PGC-1a是一个昼夜节律基因,也是线粒体生物发生和代谢的主要调节因子。接下来,作者对DRF喂养的脂肪细胞Prkaa2缺乏小鼠的肝脏和腓肠肌进行RT-qPCR分析。Prkaa2FKD并未改变肝脏中Bmal1的昼夜表达;然而,它显著降低了肌肉中Bmal1节律的幅度。与之相符的是,Prkaa2FKD在DRF期间消除了肌肉中PGC-1a的节律性表达,但在肝脏中并未消除。这些数据表明,脂肪细胞AMPKa2信号的缺乏会损害DRF期间的肌肉时钟及其控制的代谢调节因子PGC-1a。
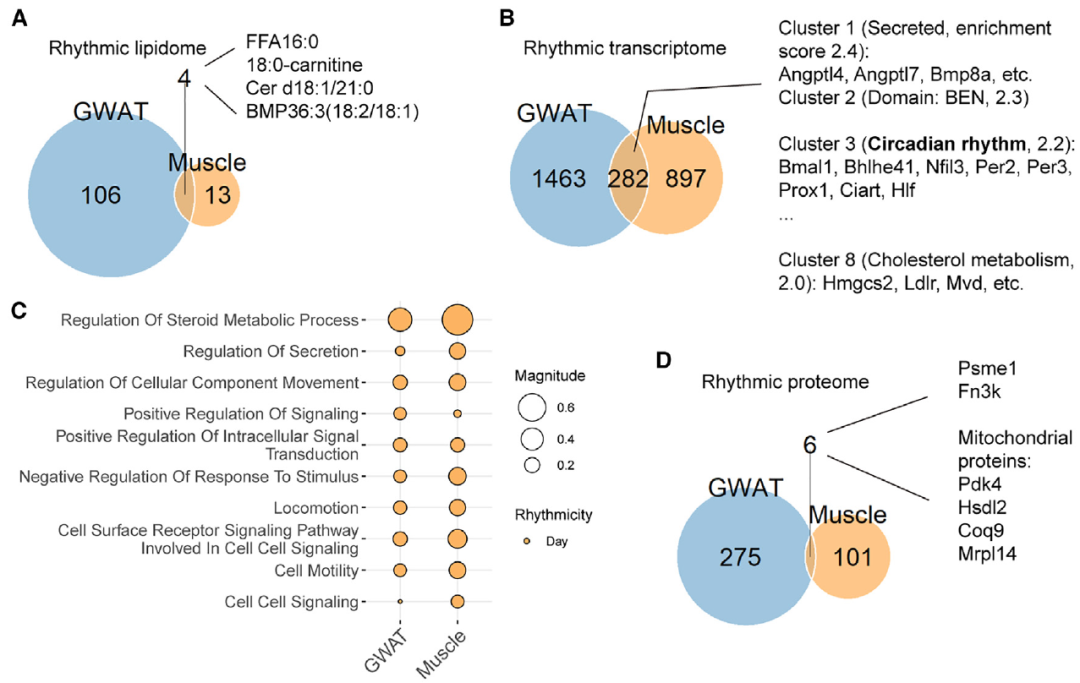
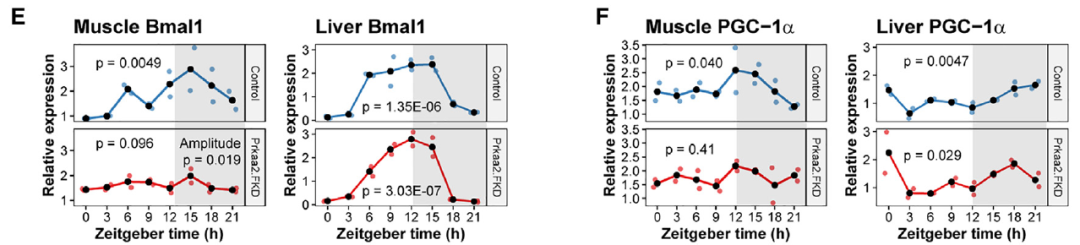
图6. DRF期间,脂肪细胞AMPKa2的缺失会损害肌肉生物钟
8. 在特定昼夜时间激活脂肪细胞AMPKa2调节耐力
鉴于上述发现,作者推测在喂食/睡眠期末端(ZT12)建立AMPK激活可能参与调节DRF期间的运动表现。因此,作者探讨了二甲双胍或特定的AMPK激活剂是否以一天中的时间为依赖方式影响DRF期间的运动表现(图7A)。结果发现,在ZT12口服二甲双胍后,显著降低了跑步耐力;然而,这种效果与较低的体重有关。接下来作者测试靶向脂肪细胞AMPKa2的昼夜效果。
吡唑啉衍生物C29激活脂肪细胞AMPK以对抗代谢疾病。每两天在ZT12口服灌胃C29显著增加了跑步耐力(图7B)。Prkaa2FKD或Crtc2FKD消除了C29处理与耐力相关的时间效应(图7C)。C29-ZT12显著增加了肌肉中氧化型肌纤维的百分比(图7E)。C29-ZT12以脂肪细胞Prkaa2依赖性方式在ZT4时调节肌肉中核心时钟基因的表达,但在ZT8时没有这种调节(图7F),这表明肌肉时钟存在跨器官调节,由昼夜定时的脂肪细胞AMPK激活介导。总之,这些发现表明,通过特定的AMPK激活剂C29在昼夜定时激活脂肪细胞AMPKa2信号可增加小鼠的运动表现和肌肉功能。
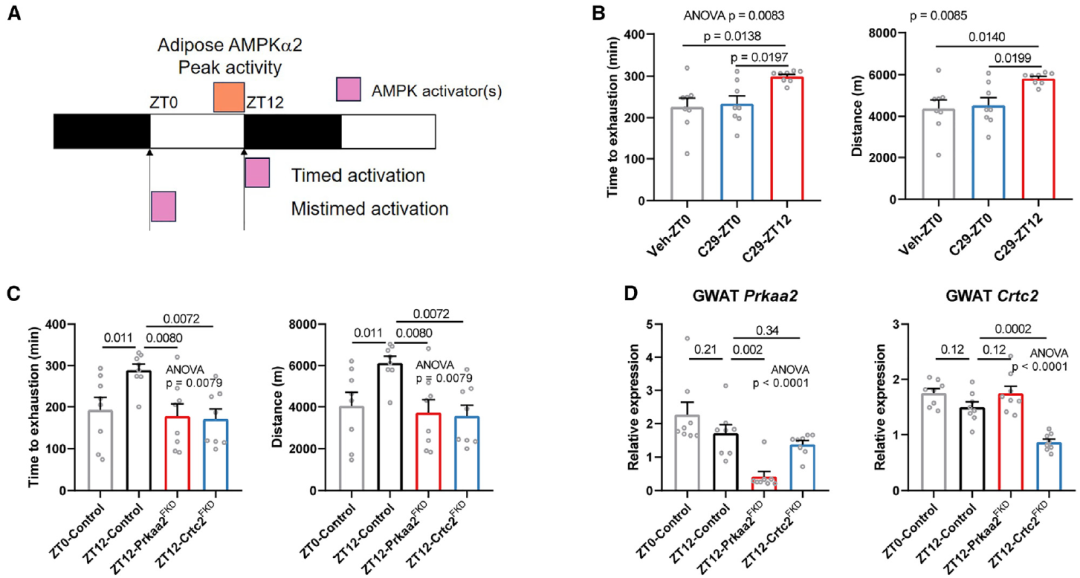
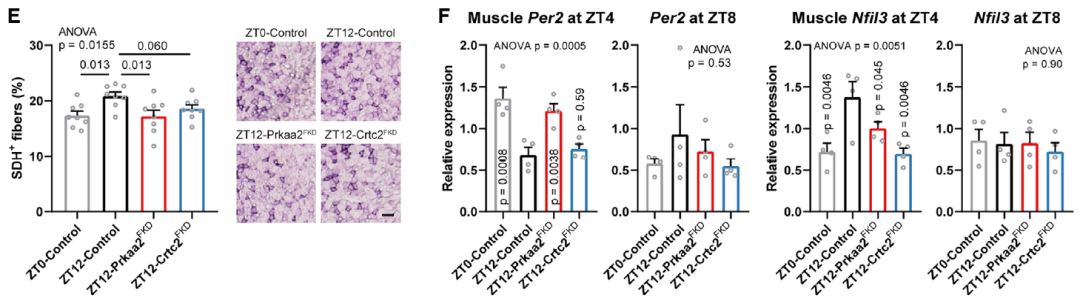
图7. 昼夜节律定时激活脂肪细胞AMPKa2增强耐力
结论
研究表明,脂肪细胞AMPKa2信号通路调控着涉及脂肪酰基辅酶A代谢、运动相关血清代谢物以及肌肉生物钟的节律性进程的器官间通讯,并参与了DRF所致运动表现的提升。通过脂肪细胞AMPK激活剂在昼夜特定时间激活AMPKa2信号通路,能够增强小鼠的跑步耐力。
在该研究中,研究人员使用了赛昂斯小动物跑步机(Sansbio,型号SA101)来进行实验操作。


小动物跑步机(SA101)
动物跑步机主要用于大小鼠及其他动物训练和新陈代谢研究, 可使训练量化更加准确;是动物体能、耐力、运动损伤、运行营养药物、运动生理和病理等研究的必要实验设备。
赛昂斯SA101型小动物跑步机现已焕新升级,不仅拓展了功能模块,更带来了前所未有的便捷操作体验。

产品特点
1、刺激电压40-200V可调,刺激电流0-15mA可调;
2、刺激频率可调:2-1000HZ可调;
3、刺激模式:多极脉冲式电刺激,无刺激盲区;
4、试验信息可编辑,包含动物属性、实验配置;
5、提示声频率500-20KHz可调,强度可调;
6、灯光刺激:爆闪模式1-2000Hz可调,亮度可调;
7、精确记录有效运动数据,自动去除被电击时运动数据;
8、速度控制范围 0-100m/min,精度0.01m/min;
9、加速度调节范围:0-100m/min²,精度1m/min²。