江苏赛昂斯生物科技有限公司
3 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
技术资料/正文
一夜白头之谜:交感神经过度激活导致黑素干细胞耗竭
232 人阅读发布时间:2025-02-15 10:38

论文上线截图
长期以来,人们一直认为压力与多种组织变化有关,包括头发变白。然而,外部压力是否确实是导致这些变化的原因,以及压力相关的变化是否发生在体细胞干细胞层面,目前尚不清楚。毛囊在生长期、退行期和休止期之间循环。隆突区和毛乳头区包含两种干细胞群体—上皮来源的毛囊干细胞(HFSCs)和神经嵴来源的黑素干细胞(MeSCs)。HFSCs和MeSCs通常处于静止状态,除非在生长期早期,HFSCs和MeSCs同时被激活会再生有色素的头发。HFSCs的激活产生新的毛囊,而MeSCs的激活产生分化的黑素细胞,这些黑素细胞向下迁移,而MeSCs则保持在隆突区附近。在毛乳头处,分化的黑素细胞合成黑色素,为新再生的头发从根部着色。在退行期,成熟的黑素细胞被破坏,只留下 MeSCs,它们将在未来的周期中启动新的黑素生成过程。MeSCs和黑素细胞的典型行为以及头发颜色的可见性,使黑素细胞谱系成为研究压力如何影响组织再生的一个易于探究的模型。
在这里,作者的研究表明急性压力通过快速耗尽MeSCs导致头发变白。通过肾上腺切除术、去神经化、化学遗传学、细胞消融和MeSC特异性肾上腺素受体敲除,作者发现压力诱导的MeSC损失与免疫攻击或肾上腺压力激素无关。相反,头发变白是由于支配MeSC生态位的交感神经的激活。在压力下,交感神经的激活导致神经递质去甲肾上腺素的突发释放,这促使静止的MeSCs迅速增殖,随后分化、迁移,并从生态位中永久耗尽。短暂抑制MeSC增殖可以防止压力诱导的头发变白。作者的研究表明,急性压力诱导的神经活动可以驱动干细胞的快速和永久性损失。
1.多种压力因素导致头发变白
为了检验心理或生理压力因素是否促进头发变白,作者在黑色毛发的C57BL/6J小鼠中使用了三种方法来模拟压力:限制性压力、慢性不可预测压力和通过注射树脂毒素(RTX,一种辣椒素类似物)引起的痛觉压力。以上三种压力均会导致白色头发数量的增加。痛觉诱导的压力产生了最显著和迅速的效果—在RTX注射后的下一个毛发生长周期中,许多新形成的头发变得未色素化(图1a-b)。
作者在不同压力作用下的小鼠血液中检测到皮质酮和去甲肾上腺素的增加(图1c),这表明作者的方法诱导了经典的压力反应。用布托啡诺(镇痛药)阻断动物的痛觉可以防止RTX注射后皮质酮和去甲肾上腺素的增加,表明阻断痛觉可以缓解RTX诱导的生理压力反应(图1c)。此外,布托啡诺还抑制了RTX注射动物中白色头发的形成(图1d)。这些数据表明,无论压力模式如何,压力下都可能造成过早的头发变白。由于痛觉诱导对头发变白的影响在所有测试的压力因素中最强且最迅速,作者专注于RTX注射作为主要的压力因素。

图1. 压力导致头发变白
2. 压力导致MeSCs的丧失
头发色素的丧失可能是由于黑色素合成缺陷、分化的黑素细胞丧失或MeSCs维持问题所致。为了了解压力如何影响黑素细胞谱系,作者在生长期将RTX注射到小鼠体内,发现TRP2+ MeSCs在整个皮肤中显著减少(图1e)。在许多毛囊中,MeSCs在5天内从隆起区完全丧失,而同一毛囊中的分化的黑素细胞则不受影响(图1e)。这些分化的黑素细胞继续产生色素,毛发保持黑色。当RTX注射动物的毛囊进入退行期和休止期时,许多毛囊已丧失所有MeSCs(图1e)。随后,当下一个生长期开始时,无法产生分化的黑素细胞使新的毛干着色,并且出现了未着色的毛发(图1e)。尽管一些再生的头发仍然有色素,但这些有色素的头发中的MeSCs数量也减少。这些结果表明,MeSCs对RTX诱导的压力极为敏感,而分化的黑素细胞或黑色素合成不受直接影响。总之,这些数据表明压力导致MeSCs的丧失。

图1. 压力消耗黑素干细胞(MeSCs)
3.去甲肾上腺素驱动MeSCs的丧失
接下来,作者探讨了压力如何传递到外周进而改变MeSCs(图2a)。首先测试免疫系统的作用,作者将RTX注射到免疫缺陷小鼠,发现仍然导致白色头发的形成,这表明RTX诱导的头发变白与T细胞、B细胞或髓系细胞无。
由于所有压力因素都导致血液中皮质酮和去甲肾上腺素的升高,作者探讨了这些压力诱导的循环因子是否在压力诱导的MeSCs丧失中发挥作用。作者对FACS纯化的MeSCs进行的RNA测序,发现MeSCs表达糖皮质激素受体(GR,皮质酮的受体)和β2肾上腺素受体(Adrb2,去甲肾上腺素的受体)(图3c)。作者使用Tyr-CreER耗竭MeSCs中的GRh或通过喂食升高皮质酮时,均未观察到MeSCs或头发色素的变化。这些数据表明皮质酮不是压力诱导的MeSCs丧失的主要因素。当作者使用Tyr-CreER耗竭MeSCs中的ADRB2时,RTX注射后未能形成白色头发(图2b)。这些数据表明,MeSCs表达的ADRB2对压力诱导的头发变白至关重要。总之,这些数据表明去甲肾上腺素通过MeSCs上的ADRB2介导压力诱导的头发变白。
在没有压力下,通过皮内注射将去甲肾上腺素局部引入皮肤促进了注射部位的头发变白,但在MeSC特异性Adrb2敲除小鼠中未能引起头发变白(图2c)。总的来说,虽然免疫细胞和皮质酮是可有可无的,但去甲肾上腺素对于压力诱导的头发变白是必要的,并且可以在没有压力的情况下触发头发变白。

图2. 去甲肾上腺素使头发变白
4. 寻找去甲肾上腺素的来源
由于肾上腺是压力下去甲肾上腺素的主要来源,作者手术切除了两个肾上腺。然而,将RTX注射到肾上腺切除的小鼠中仍然导致头发变白,这表明RTX诱导的头发变白与肾上腺的激素或儿茶酚胺无关(图2d)。
去甲肾上腺素的另一个可能来源是交感神经系统。RTX注射后1小时内,交感神经元细胞体中检测到强烈的c-FOS表达(报告神经活动的即刻早期转录因子),并在24小时后减弱,这表明RTX注射导致交感神经元的突发激活(图3b)。此外,当与RTX一起注射布托啡诺以阻断疼痛时,交感神经元未能诱导c-FOS(图3b)。这些数据表明,在痛觉诱导的压力后,交感神经系统高度激活。
为了测试交感神经的激活是否导致压力下的MeSCs丧失和头发变白,作者用6-羟多巴胺(6-OHDA)消融交感神经。交感神经切除阻断了RTX诱导的头发变白和MeSCs丧失(图3c),这表明交感神经确实介导压力诱导的头发变白。此外,胍乙啶,一种阻断交感神经末梢去甲肾上腺素释放的化学物质,抑制了RTX注射后的头发变白和MeSCs丧失。总之,这些数据表明,交感神经末梢分泌的去甲肾上腺素介导了压力对MeSCs的影响。作者采用化学遗传学方法激活交感神经,也导致MeSCs丧失和头发变白(图3d)。这些数据表明,在没有压力因素的情况下,交感神经的激活可以驱动MeSCs丧失。
总之,作者的发现表明,压力下交感神经末梢分泌的升高的去甲肾上腺素驱动MeSCs的耗竭。

图3. 交感神经系统的过度激活会消耗MeSCs
5. 压力导致MeSCs过度增殖
接下来,作者探究了压力下MeSCs的早期变化,这些变化可能导致它们的丧失(图4a)。RTX或去甲肾上腺素注射后,未能在MeSCs从生态位耗尽之前检测到活性caspase-3或TUNEL信号以及gamma-H2AX焦点(DNA损伤的标志)。因此,压力诱导的MeSCs丧失不是通过凋亡或坏死或DNA损伤介导的。
静止是许多体细胞干细胞的一个关键特征。为了检验压力是否改变MeSCs的静止状态,作者在小鼠进入完全生长期时注射RTX或去甲肾上腺素,此时MeSCs通常处于静止状态。作者在RTX或去甲肾上腺素注射后24小时内观察到增殖的MeSCs数量显著增加(图4b)。作者发现,升高的去甲肾上腺素迫使MeSCs进入快速且异常的增殖状态,而成熟的黑素细胞则不受影响。此外,作者监测了压力后MeSCs的变化,通过Tyr-CreER;Rosa mT/mG小鼠 膜GFP追踪MeSCs(图4c),发现Day1 GFP阳性细胞瞬时增加,Day2 GFP阳性细胞树枝状分枝,Day3 GFP阳性细胞向外迁移到真皮和表皮,Day4 失去了凸起中的所有GFP阳性细胞。以上数据表明,在压力后,MeSCs经历快速增殖,随后分化和迁移,导致它们从生态位中消失(图4e)。

图4. 去甲肾上腺素促使MeSCs脱离静止状态
6. MeSCs的转录组分析
为了探究压力驱动MeSCs丢失的分子机制,作者在RTX注射后12小时,即MeSCs表现出表型差异之前,进行RNA-seq分和基因本体(GO)富集分析(图5a-b)。在压力下的MeSCs中识别出几个细胞周期调节因子的变化,促进MeSCs增殖、分化和迁移的配体的受体显著上调,涉及黑色素生成的基因也上调(图5c)。这些数据表明,MeSCs在压力后上调了增殖和分化。
7. 阻断增殖可以保护MeSCs
由于MeSCs在压力下失去静止状态,作者研究在压力反应早期短暂抑制增殖是否可以防止其耗尽。作者在完全生长期注射RTX,并局部应用CDK抑制剂(AT7519或黄哌利多)来暂时抑制增殖。经过CDK抑制剂处理的RTX注射动物中的MeSCs保持静止,并保存在生态位中。此外,作者建立了一个基因模型,在该模型中,CDK抑制剂P27可以在MeSCs中特异性地短暂诱导。单独诱导MeSCs中的P27表达可以抑制异常的MeSCs增殖,并在压力下将MeSCs保存在生态位中。总之,这些数据表明,静止状态的消失驱动了压力下MeSCs的耗竭,而抑制MeSCs增殖可以防止其消失。
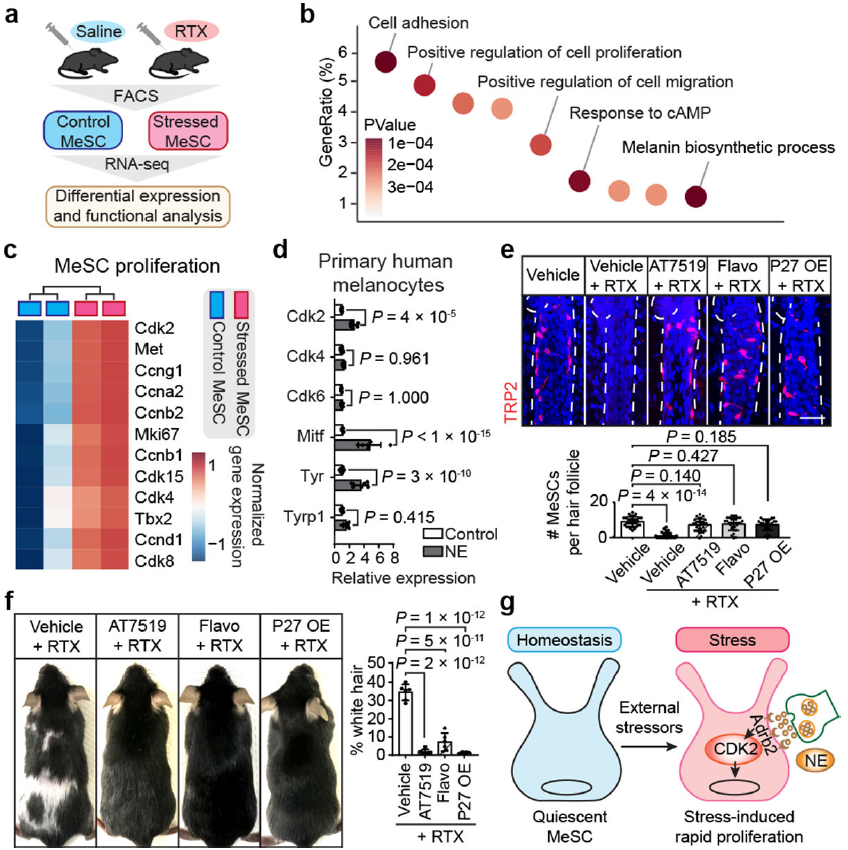
图5. 抑制MeSC异常增殖可防止压力诱导的头发变白
结论
作者证明急性压力可以通过激活交感神经系统导致干细胞的耗竭,从而对组织再生造成损害。作者的发现证明了交感神经系统不仅调节身体生理,还影响发育,而肾上腺来源的压力激素和儿茶酚胺在压力下并不驱动MeSCs的变化。由于交感神经几乎支配所有器官,急性压力可能通过神经信号而非循环激素对许多组织产生广泛且快速的影响。在未来,作者在这里发现的机制是否也可能导致衰老过程中MeSC的丧失,以及压力是否可以模拟加速衰老过程,将是一个有趣的研究。