江苏赛昂斯生物科技有限公司
3 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
技术资料/正文
雾化给药仪 | STING抑制剂通过阻止血管内皮细胞介导的免疫细胞趋化和粘附来改善lps诱导的ALI
514 人阅读发布时间:2025-01-15 12:55
论文上线截图
急性肺损伤(ALI)是一种常见且破坏性的临床疾病,其特征是过度的炎症反应。干扰素基因刺激因子(STING)是调节多种疾病中炎症和免疫反应的不可或缺的分子,但其在ALI发病机制中的作用尚未完全阐明。在本研究中,作者探讨了STING在脂多糖(LPS)诱导的肺损伤中的分子机制。小鼠在吸入LPS前用STING抑制剂C-176预处理诱导ALI。作者发现LPS吸入显著增加了肺组织中STING的表达,而C-176预处理剂量依赖性地抑制了STING的表达,减少了包括TNF-α、IL-6、IL-12和IL-1β在内的炎症细胞因子的产生,并抑制了肺组织中趋化因子和粘附分子血管细胞粘附蛋白-1(VCAM-1)的表达。并且,在TNF-α刺激的HMEC-1细胞的体外实验中得到一致的结果。作者进一步揭示敲低STING抑制剂H-151或STING显著减少了转录因子STAT1的磷酸化,进而影响其与趋化因子CCL2和粘附分子VCAM-1基因启动子的结合。总体而言,STING抑制剂可以通过防止血管内皮细胞介导的免疫细胞趋化和粘附来减轻小鼠LPS诱导的ALI,这表明STING可能是治疗ALI的一个有前景的治疗靶点。
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)是临床麻醉和重症监护病房中常见的危重疾病。这些状况的特征是巨噬细胞、中性粒细胞的积聚、肺泡-毛细血管膜屏障功能障碍/破坏,以及炎症因子的产生,这些经常导致急性低氧性呼吸功能不全或衰竭。败血症和出血性休克仍然是ALI/ARDS发展的主要风险因素。ARDS仍然具有很高的死亡率,并且导致这种情况的分子机制尚不清楚。因此,深入了解ALI的潜在病理机制并为ALI患者开发新的治疗方法是至关重要的。
内皮层在维持身体生理稳态中起着重要作用,它保护运输物流、控制血管通透性,并调节血管张力。同时,内皮细胞还通过表达粘附分子和趋化因子来组织免疫细胞的募集,并调节炎症部位白细胞的渗出。内皮层的持续激活导致大量单核细胞和PMNs的浸润、组织损伤和最终的器官功能障碍。因此,调节内皮细胞的激活可能是治疗炎症性疾病的新方向。然而,ALI中内皮细胞激活的调节机制尚未完全阐明。越来越多的证据表明,STING途径的损害与多种疾病的发病机制有关,包括感染、炎症和自身免疫疾病。
最近的研究揭示了cGAS-STING在败血症或ALI中的新兴作用。Joshi等人展示了SPHK2+单核细胞衍生的CD11b+巨噬细胞在肺损伤期间促进肺泡巨噬细胞抗炎功能的重要作用。然而,血管内皮细胞-免疫细胞相互作用是否负责ALI期间STING介导的肺炎症,因此,仍有待探索。
1.cGAS-STING通路在LPS诱导的ALI小鼠模型中被上调,STING抑制剂下调其激活
内毒素诱导的ALI是一个由促炎激活免疫细胞和增加血管通透性介导的非致命ALI的明确模型。在作者的研究中,作者使用LPS诱导的ALI模型(图1a)研究了STING在肺炎进展中的潜在作用。STING抑制剂在模型每次雾化前30分钟腹腔注射。结果显示,LPS处理组肺组织匀浆中cGAS和STING显著增加(图1c)。相应地,STING的直接下游信号蛋白TBK1和p65的磷酸化水平在LPS处理组小鼠中显著增加(图1d)。而选择性拮抗剂C-176治疗降低了STING的水平(图1b和c)并抑制了TBK1和p65的磷酸化(图1d)。此外,STAT1磷酸化在LPS处理组小鼠中显著增加,C-176治疗抑制了STAT1的磷酸化(图1d)。这些结果表明cGAS-STING通路参与了LPS介导的ALI的发展。
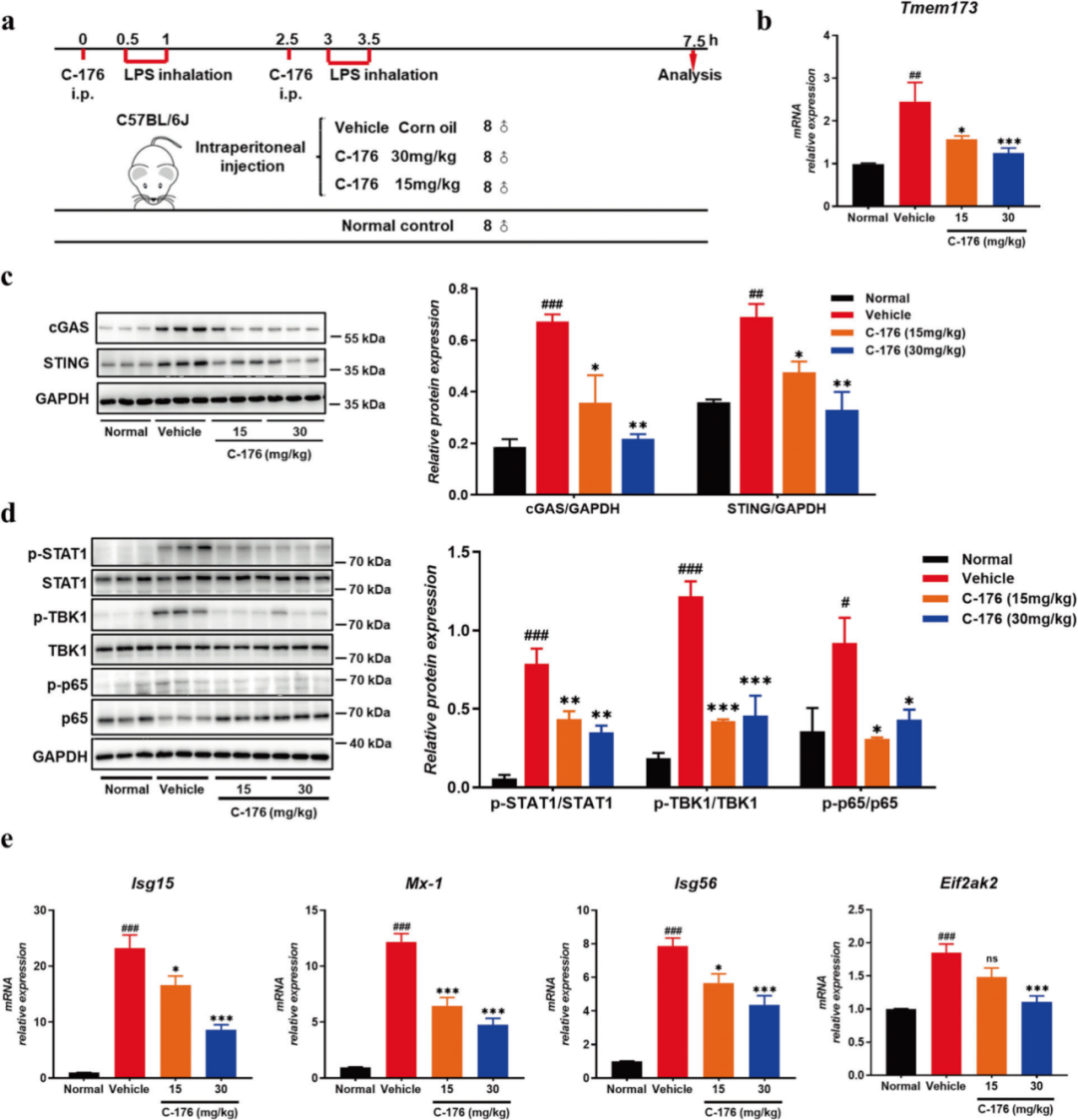
图1. cGAS-STING信号通路参与了lps诱导的ALI
2. 抑制STING减轻ALI小鼠的肺炎症
上述发现鼓励作者进一步探究STING在肺损伤中的重要作用。H&E染色的肺切片显示STING抑制剂治疗组的小鼠肺泡结构损伤和充血得到缓解,BALF蛋白水平下降,降低了BALF中的dsDNA水平,并减弱了血清中乳酸脱氢酶活性(图2a-d)。应用C-176治疗时浸润细胞的数量减少,BALF细胞的积累减少,并减少了的促炎细胞因子的产生。一致地,C-176处理动物的肺匀浆中促炎细胞因子的蛋白和基因水平降低(图2e- h)。综合来看,STING的抑制降低了ALI的严重程度,并降低了LPS介导的炎症。
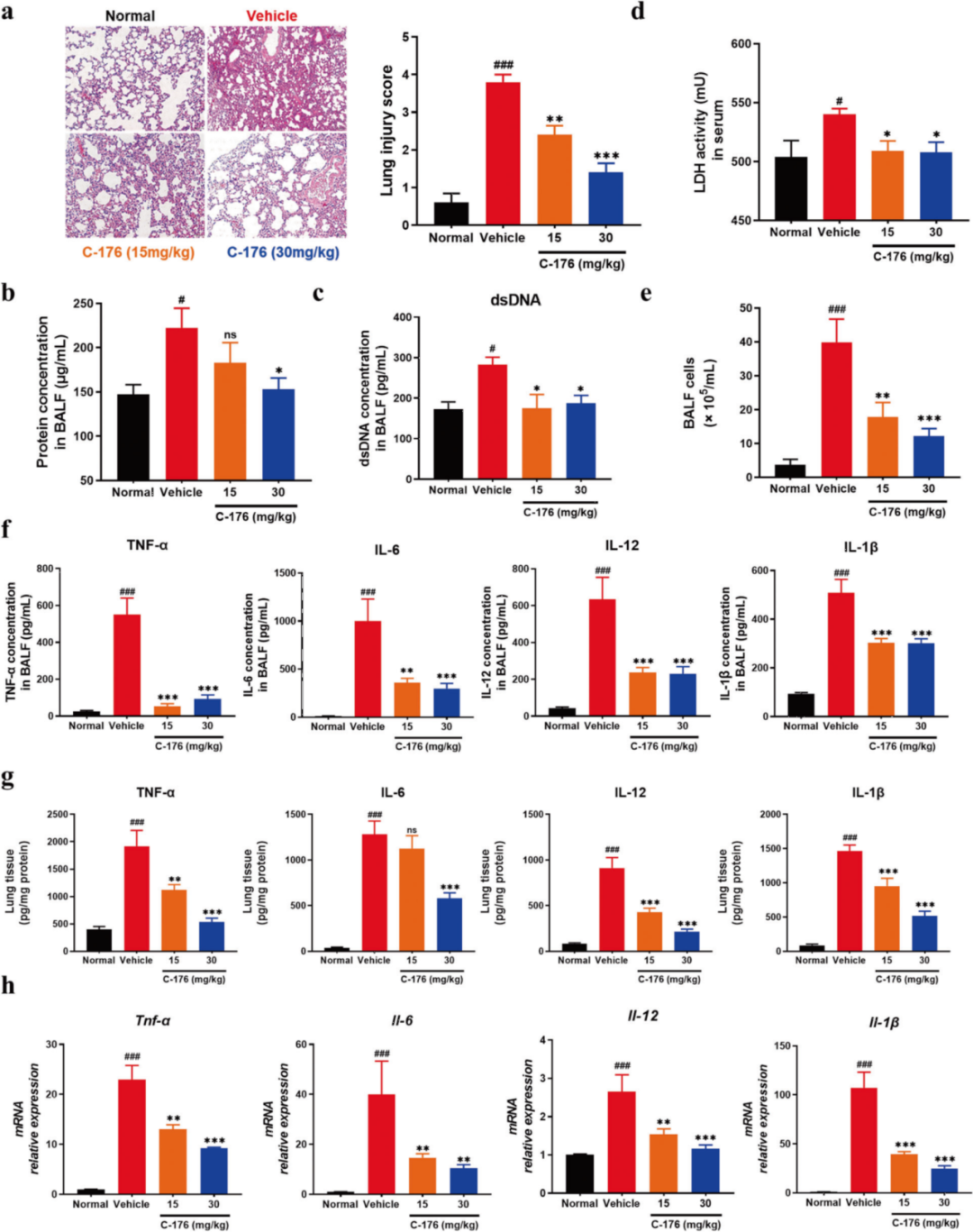
图2.抑制STING可减轻lps诱导的ALI小鼠的肺部炎症
3.STING抑制剂抑制了LPS诱导的ALI小鼠模型中中性粒细胞的浸润
上述数据表明STING抑制剂影响了免疫细胞向小鼠肺组织的浸润。作者进行了免疫组化测定以进一步调查浸润免疫细胞的类型。
作者的数据表明,F4/80+巨噬细胞(补充图S1a)和Ly6G+中性粒细胞在LPS处理组中显著增加,而STING抑制剂可以缓解这一症状(图3a)。同时,在LPS诱导的小鼠BALF中观察到巨噬细胞(补充图S1b)和中性粒细胞(图3b)的数量增加,并可以通过C-176恢复。与LPS处理组相比,STING抑制剂治疗显著降低了肺组织中CD11b+Ly6G+中性粒细胞的百分比(图3c)。髓过氧化物酶(MPO)是最丰富地表达在中性粒细胞中,其在ALI小鼠的肺组织中活性增强,而C-176抑制了MPO活性,表明中性粒细胞浸润的减少(图3d)。相应地,肺组织中Ly6G和中性粒细胞外陷阱(NET)标记物(Pad4和Rac2)的基因表达被C-176下调(图3e)。这些结果表明STING抑制剂抑制了巨噬细胞和中性粒细胞的浸润,并减少了肺炎症。
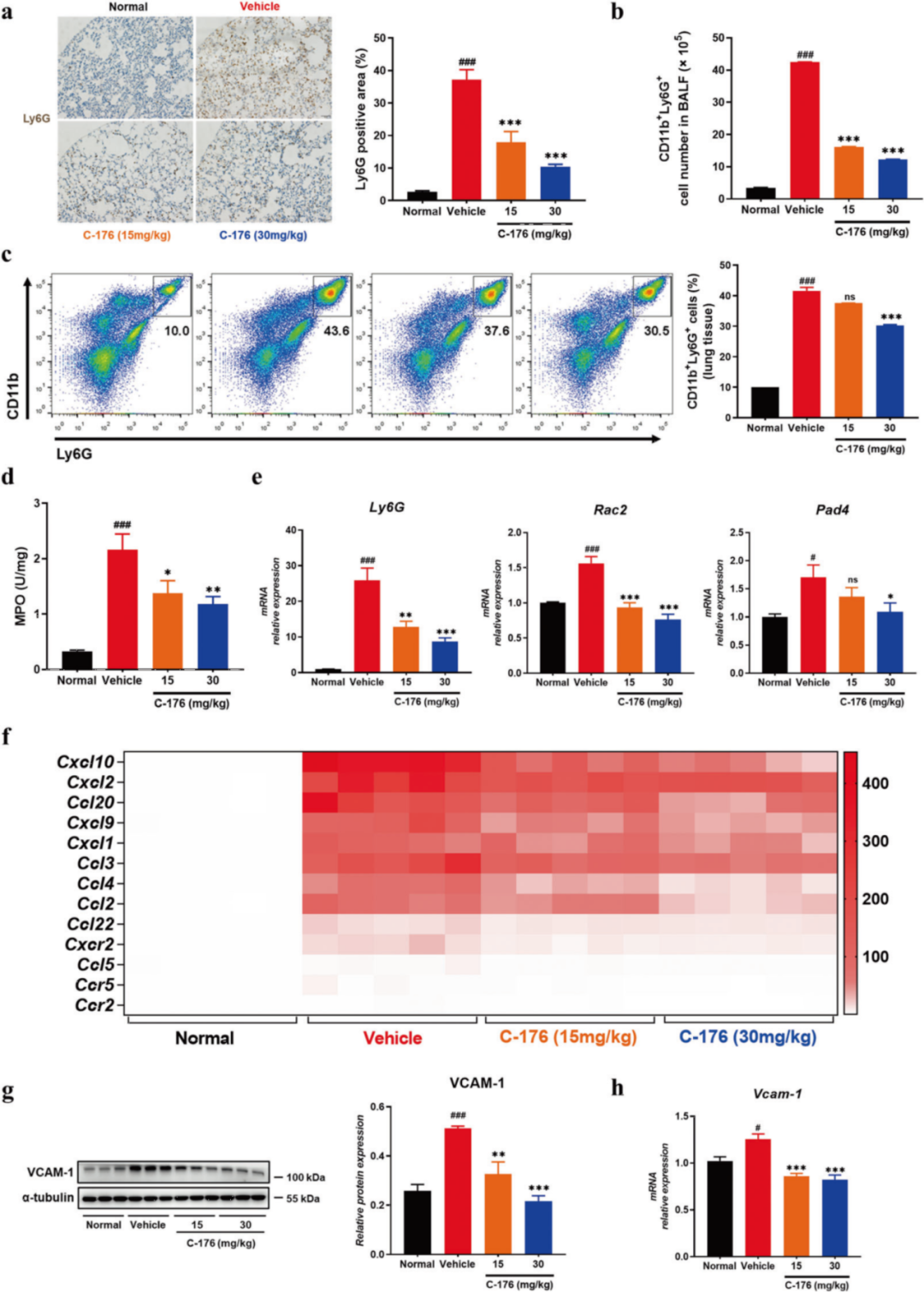
图3.STING抑制剂抑制中性粒细胞的浸润,影响趋化因子和粘附分子的表达
4. 抑制STING抑制了血管内皮细胞中趋化因子和粘附分子的表达
在STING抑制后体内粘附分子水平降低的情况下,作者使用TNF-α刺激的HMEC-1(常见和经典的血管内皮细胞)来研究人类STING抑制剂H-151对体外粘附和迁移过程的影响。实验显示,TNF-α的加入增加了趋化因子的表达,而H-151具有下调趋化因子表达的能力(图4a)。此外,STING抑制剂能够减少HMEC-1细胞中粘附分子VCAM-1的表达(图4b-c)。为了进一步验证STING抑制对HMEC-1细胞功能特性的影响,作者敲低了HMEC-1细胞中STING的表达,并分析了STING对趋化因子和粘附分子的影响。与STING抑制剂一致,STING的敲低也抑制了TNF-α刺激的HMEC-1中趋化因子和粘附分子的表达(图4d-f)。最后,作者使用HMEC-1细胞探索了它们对单核细胞和中性粒细胞的粘附能力和趋化效应。在TNF-α刺激下,HMEC-1对分化的HL-60细胞和THP-1的粘附能力和趋化行为增强,STING抑制可以干预这一事件(图4g)。这些结果表明STING可能参与了血管内皮细胞和免疫细胞之间的相互作用,然后抑制了巨噬细胞和中性粒细胞的浸润,这可能成为STING介导肺炎症的潜在机制之一。
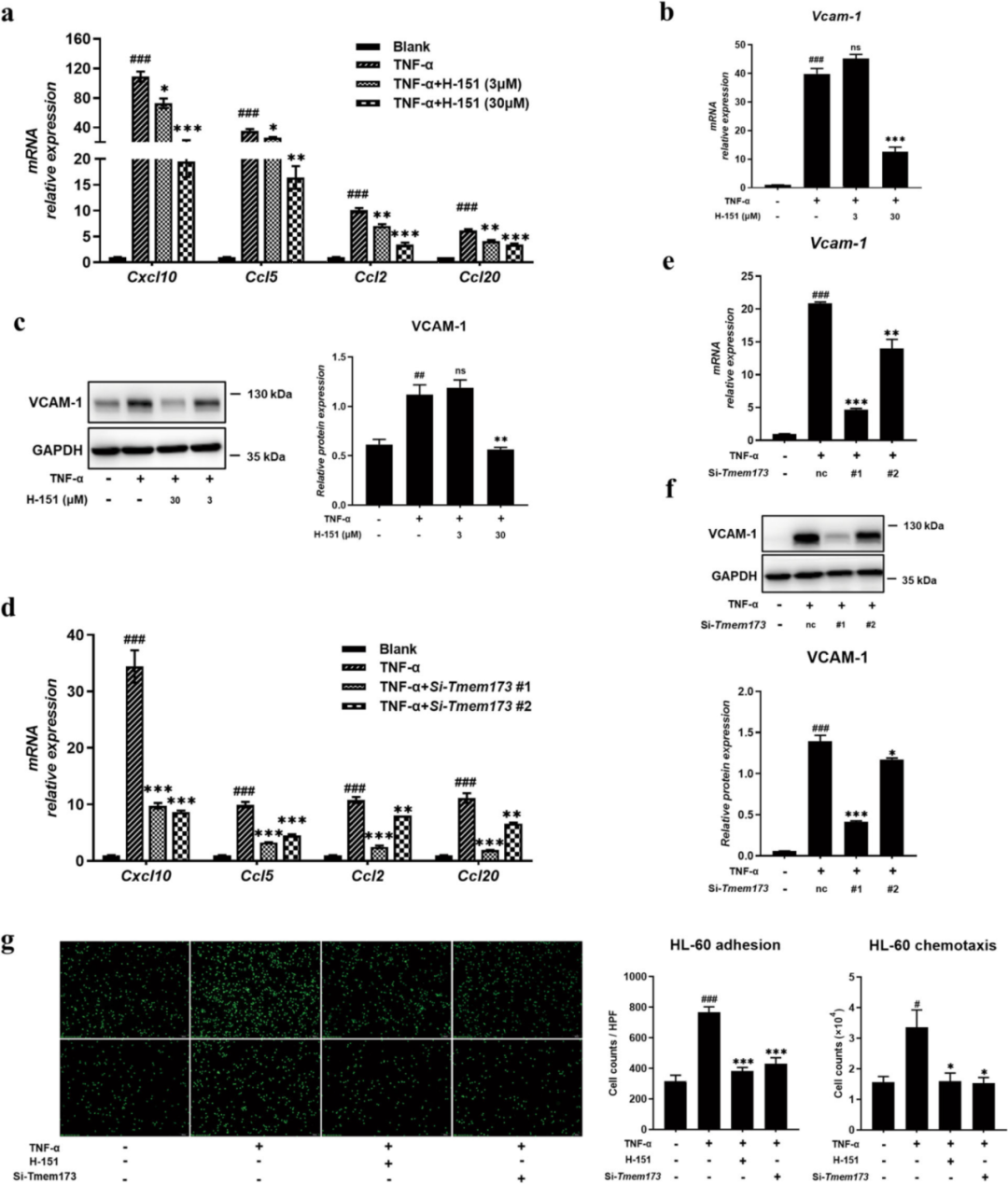
图4. 抑制STING可抑制血管内皮细胞中趋化因子和粘附分子的表达
5. STING抑制剂通过抑制STAT1的磷酸化抑制Ccl2和VCAM-1的表达
为了揭示STING抑制剂如何影响血管内皮细胞中趋化因子和VCAM-1的表达,作者首先分析了TNF-α刺激的经典下游途径,如p65和丝裂原激活蛋白激酶(MAPK)信号。TNF-α处理后p65和MAPK的磷酸化增加,而H-151处理不能减少蛋白磷酸化的上调(图5a)。令人惊讶的是,敲低H-151和STING高度抑制了STAT1的磷酸化(图5b-c)。然后作者发现Ccl2和Vcam-1基因的5′非翻译区包含STAT1结合位点(图5d)。ChIP实验的结果表明STAT1与Ccl2和Vcam-1启动子结合,而H-151处理显著减少(图5e)。同样,沉默STING阻止了STAT1与Ccl2和Vcam-1启动子之间的结合(图5f),证实了STING在促进这种结合和Ccl2和Vcam-1表达中的作用。这些结果表明STING抑制通过抑制STAT1一致性位点到基因启动子上游来抑制Ccl2和VCAM-1的表达。
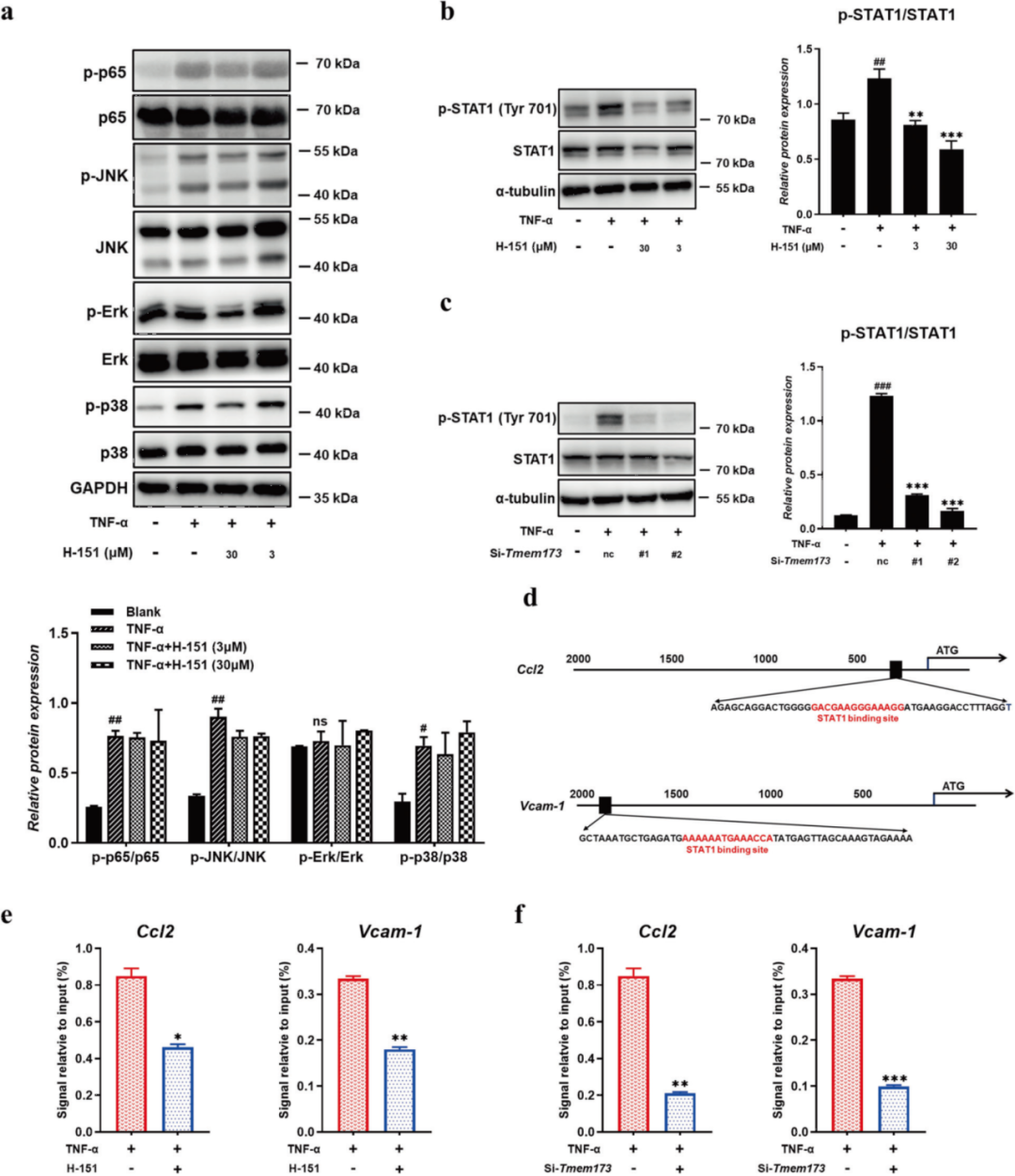
图5. STING抑制剂通过抑制STAT1磷酸化抑制趋化因子Ccl2和粘附分子Vcam-1的表达
结论
综上所述, 在本研究中,作者证明了通过C-176干预抑制STING在LPS诱导的急性肺损伤小鼠模型中大大抑制了肺炎症反应。此外,作者揭示了STING抑制剂或敲低STING通过抑制信号转导和激活转录因子1(STAT1)的磷酸化,调节血管内皮细胞介导的免疫细胞粘附和迁移过程。进一步阐明了STING在ALI病理生理过程中的作用和机制,即靶向STING可能是一种新的、有前途的治疗ALI的策略。
在该研究中,研究人员使用了赛昂斯小动物雾化给药仪(Sansbio,型号SA703)来进行实验操作。

小动物雾化给药仪(SA703)
目前雾化吸入治疗已成为呼吸系统疾病治疗的一种重要手段,随之而来的对吸入型药物研发也被推上了一个新的高度。通过高效高频微网雾化发生器,结合脉宽调制的控制速度技术,将液体雾化成为细小的颗粒,促使小动物吸入。该仪器能很好的完成小动物的造模(诱咳,引喘,染毒),麻醉和动物精准给药。

产品特点
1、雾化粒子细(3—5μm占90%),该粒子能顺利的进入肺泡;
2、能使用不同液体或更换雾化头后实时进行校准;
3、模式选择:雾化模式,引喘模式二种;
4、加药、清洗、更换动物盛装箱、雾化头便捷;
5、雾化头尺寸:Φ36×25mm;
6、给药容积:16ml;
7、测试时间:1-99999s,步长为1s;
8、雾化速度:1~10档 速度范围:0.07-1.4ml/min;
9、回收功能:实验结束后仪器自动开启排气功能,将残留雾化药物净化后排除,排气时间范围:10~240s;
10、校准功能:实验前根据不同的液体,提前校准雾化的速度;
11、雾化箱尺寸,大号:10L(305×260×170mm),
中号:8L(290×240×160mm)标配,
小号:5L( 255×210×135mm);
12、实验指标:实时显示喷药时间,反应时间,给药量,首次咳嗽时间,咳嗽次数等。