江苏赛昂斯生物科技有限公司
3 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
技术资料/正文
IF=64.5丨Cell:山东第一医科大学等多个团队从TAAR1入手寻找精神分裂症的新疗法
845 人阅读发布时间:2025-01-08 10:59
2023年11月13日,山东大学孙金鹏教授团队、杨帆教授团队,联合四川大学邵振华团队、上海交通大学医学院李乾团队和山东第一医科大学王越团队在 Cell 在线发表了研究论文“Structural and signaling mechanisms of TAAR1 enabled preferential agonist design”。研究团队系统地分析了不同内源性胺类和SEP-363856激活TAAR1多种G蛋白信号的特征,解析了不同胺类激活TAAR1-Gs/Gq通路的分子机制和药理学特征,进而成功开发出同时具有Gs和Gq双激活活性的TAAR1小分子激动剂ZH8651,并在小鼠模型中验证了其改善精神分裂的作用。该研究为靶向TAAR1治疗精神分裂症的候选化合物设计及药物开发改造提供了重要参考。

图片来源:《Cell》(https://doi.org/10.1016/j.cell.2023.10.014)
TAAR1是一种表达在大脑多个单胺能神经核团中的G蛋白偶联受体(GPCR),可感知一系列生物胺类物质,参与调节奖赏、认知、情绪等重要生理功能。近年来,TAAR已成为精神分裂症、药物成瘾、抑郁症等多种精神疾病的新型靶标,具有巨大的药物开发潜力。因此,研究TAAR1的分子识别和药理学机制对于抗精神疾病药物的开发具有重要意义。邵振华研究团队联合国内高校科研团队在Nature杂志发表了研究论文“Ligand recognition and G protein coupling of trace amine receptor TAAR1”,揭示了TAAR1受体中药物识别口袋的可塑性,为设计新型靶向药物提供了新的思路。然而,TAAR1介导的下游信号通路复杂,目前仍不清楚哪条信号通路与疾病治疗相关。
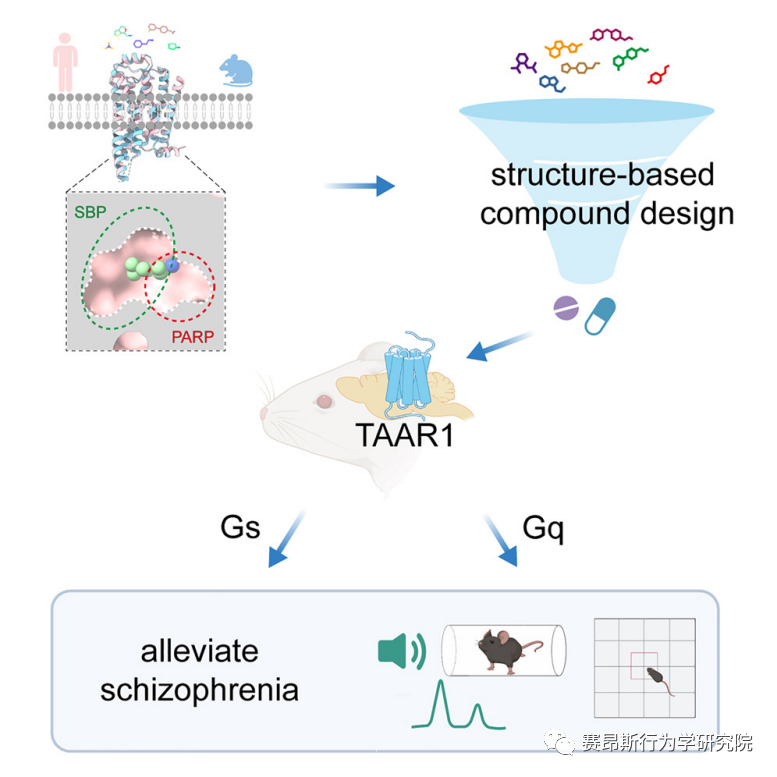
图1.文章简要示意图
该研究主要发现包括:
01
明确了多种内源性胺类代谢物(EAM)激活TAAR1下游信号的通路多样性及其在精神分裂症中的作用。
研究团队首先系统地检测了多种内源性胺类物质及SEP-363856对人源TAAR1(hTAAR1)和小鼠TAAR1(mTAAR1)不同G蛋白亚型的激活情况,结果表明SEP-363856(简称SEP)和PEA能够激活m/hTAAR1的Gs信号通路,三甲胺(TMA)能够激活Gs、Gq、Gi三条信号通路,环己胺(CHA)激活Gq信号通路。有意思的是,研究发现在动物实验中,不仅SEP能够缓解MK-801诱导的精神分裂样症状,激活Gq信号通路的CHA也能够缓解该症状。在分别应用Taar1-/-小鼠和Gq抑制剂后,CHA对精神分裂的缓解作用明显减弱。这提示TAAR1介导的Gq信号通路在MK801诱导的精神分裂症中发挥有益作用,因此,开发靶向TAAR1的Gs/Gq双激动剂可能具有更好的应用效果。
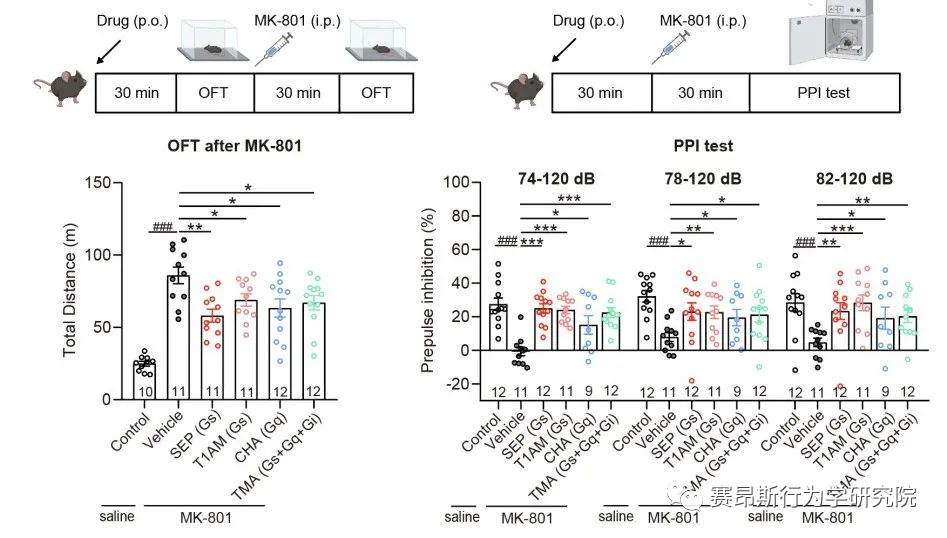
图2. TAAR1不同G蛋白信号通路激动剂对精神分裂样症状的作用
02
解析了EAM和临床三期药物SEP激活m/hTAAR1-Gs/Gq的分子机制。
基于以上在动物实验中的发现,研究团队解析了SEP-TAAR1-Gs、CHA-TAAR1-Gq、TMA-TAAR1-Gs、PEA-TAAR1-Gs等多个复合物的配体识别机制,发现了胺类识别的结合口袋(PARP)。在PARP内部,保守的D1023.32 TMA、CHA、PEA、SEP的氨基基团形成氢键形成氢键。Y2917.43与D1023.32共同稳定潜在的氢键网络。在口袋底部,W2616.48和F2646.51形成“双”拨动开关,从而诱导TAAR1激活。此外,与仅占据PARP的TMA相比,CHA、PEA和SEP激动剂中存在额外的环状结构,显示出第二结合口袋(SBP),结构分析和突变数据提示PARP和SBP均介导TAAR1的激活,揭示了TAAR1不同于嗅觉TAAR的配体结合域,同时也提示PARP和SBP是设计TAAR1高效力激动剂的潜在靶标。
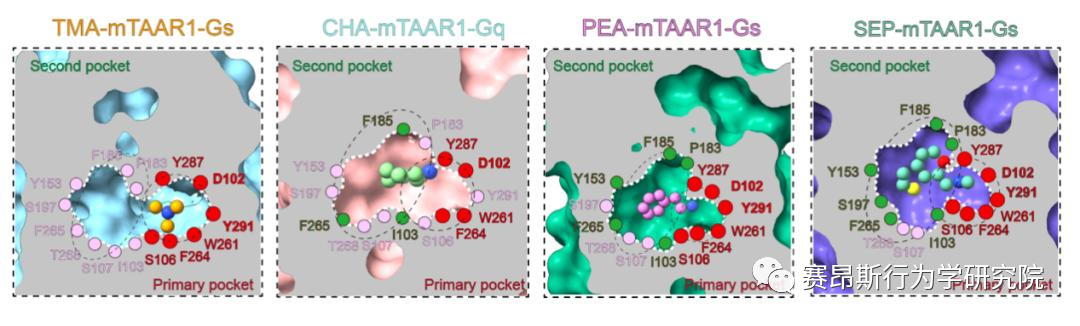
图3. TAAR1的配体识别口袋
03
阐明了TAAR1偶联Gs和Gq两种不同信号通路的关键氨基酸和信号传递途径。
基于对TAAR1不同G蛋白信号转导机制的分析,研究团队进一步找到了激活Gs和Gq通路的关键氨基酸位点。与Gq选择性激动剂CHA相比,两种Gs选择性激动剂SEP和PEA与TAAR1的特定氨基酸之间形成了额外的相互作用,包括S1063.36、Y1534.56、P183ECL2和Y2917.43。因此,研究团队在后续小分子的筛选工作中,将S1063.36和Y2917.43作为Gs选择性激动剂的筛选位点,而I1033.33、F185ECL2和F2656.52作为Gs/Gq双效激动剂的关键筛选位点。与此同时,研究团队详细解释了Gs和Gq信号传递途径的差异,为后续双效激动剂的开发提供了有利信息。
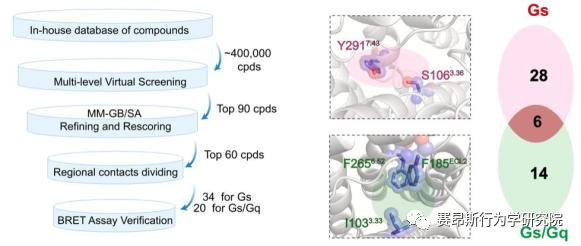
图4. 基于结构开发TAAR1激动剂的流程图
04
开发了靶向TAAR1的Gs偶联、Gq偶联以及Gs/Gq双偶联的高亲和力激动剂,并验证了其缓解精神分裂症的作用。
基于上述鉴定出的TAAR1配体结合域以及偶联Gs和Gq通路的关键氨基酸,研究团队进行了小分子设计及化合物库的建立,设计了“区域接触划分”策略,通过虚拟筛选和细胞生化实验验证,研究团队得到了TAAR1的Gs偶联激动剂ZH8667、Gq偶联激动剂ZH8659、Gs/Gq双偶联激动剂ZH8651。ZH8651能够激活mTAAR1和hTAAR1的Gs、Gq信号通路,亲和力均在nM级别。以SEP作为对照,单次应用ZH8659和ZH8651剂量依赖性地改善MK -801诱导的小鼠精神分裂样症状,其效果与临床三期药物SEP相似。在Taar1-/-小鼠中,ZH8659和ZH8651对精神分裂症的改善作用大大减弱。
值得注意的是,单独给药SEP (3 mg/kg)对基础运动有明显的抑制作用,提示SEP可能具有导致自发活动减少的潜在副作用。相比之下,ZH8659或ZH8651没有引起基础活动减少,显示其亲和力高副作用低的优势。
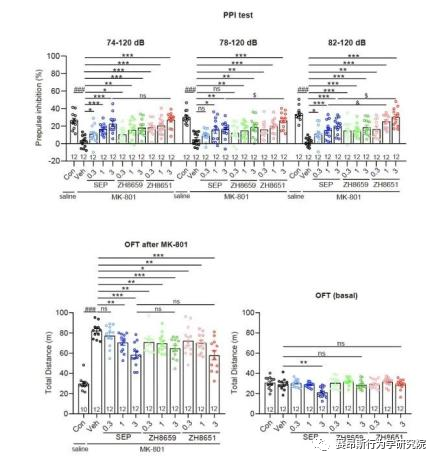
图5. ZH8659和ZH8651对精神分裂样症状的改善作用
总的来说,该研究应用基于结构的虚拟筛选和候选化合物设计,开发出一种有效的TAAR1双激动剂,在MK -801诱导的精神分裂症样小鼠模型中表现出治疗潜力,为靶向TAAR1开发抗精神疾病药物先导化合物提供了线索。