TissueGnostics Asia Pacific Limited(TG亚太)
18 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
TissueGnostics Asia Pacific Limited(TG亚太)
入驻年限:18 年
- 联系人:
市场部
- 所在地区:
北京 丰台区
- 业务范围:
实验室仪器 / 设备、技术服务
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
STTT| Tissue Cytometry技术 “解码” 胃癌前关键互作,让 PMC_P 微环境从 【数据猜想】变 【可视化证据】
199 人阅读发布时间:2025-10-23 13:41
胃癌(GC)是全球第五大常见恶性肿瘤,也是癌症相关死亡的第三大原因,具有多阶段发展、病因复杂的特征。明确驱动癌变发生的细胞起源及早期演化动态,对于改进早期检测与预防策略至关重要。为在早期胃癌(early gastric cancer, EGC)癌前病变关键转折点处,揭示关键的分子、细胞及微环境事件特征,我们致力于开发更精准的筛查工具,并设计针对性干预方案,以在此阶段阻断恶性转化。

复旦大学附属中山医院周平红教授、李全林教授,中山大学左春满教授在Signal Transduction and Targeted Therapy上发表题为Spatiotemporal multi-omics analysis uncovers NADdependent immunosuppressive niche triggering early gastric cancer文章。
本文运用自主研发的人工智能(AI)模型,整合了 9 例早期胃癌内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)样本的空间多模态数据(涵盖从正常组织到癌变的连续阶段),构建出疾病进展的时空图谱,并识别出早期癌变过程中一个以免疫抑制微环境为特征的关键转折点 ——PMC_P(癌前凹陷黏液细胞关键转折点)。在此阶段,具有干性特征的炎症性凹陷黏液细胞(PMC_2)通过 NAMPT-ITGA5/ITGB1 信号通路与成纤维细胞相互作用,同时通过 AREG-EGFR/ERBB2 信号通路与巨噬细胞相互作用,共同促进癌变的发生。
我们建立了胃黏膜癌前病变细胞系及类器官模型,在体外实验中证实:NAMPT(烟酰胺磷酸核糖基转移酶)与 AREG(双调蛋白)可显著促进细胞增殖。此外,在 CEA-SV40 转基因小鼠模型中,靶向 AREG 和 / 或 NAMPT 可破坏关键的细胞间相互作用,抑制 JAK-STAT、MAPK 及 NF-κB 信号通路,并降低 PD-L1(程序性死亡配体 1)的表达水平 —— 这一结果在体外实验中通过蛋白质印迹法(western blot)也得到了验证。上述干预措施不仅延缓了疾病进展、逆转了免疫抑制微环境,还成功阻断了恶性转化过程。
我们进一步利用内镜切除的早期胃癌标本开展临床验证,最终为早期胃癌的发展过程提供了精准的时空解析,并发现了可用于早期干预的新型诊断标志物与治疗靶点。
实验部分
- 验证关键细胞群体的空间分布
文章通过TissueFAXS 系统对组织样本进行全景多光谱扫描,结合 StrataQuest 分析软件,精准定位了 PMC_2 细胞(具有干性的炎症性凹陷黏液细胞)在 PMC_P 区域(胃癌前病变关键转折点)的富集情况。
- 解析细胞间信号通路的功能关联
对于AREG-EGFR/ERBB2 和 NAMPT-ITGA5/ITGB1 信号轴,Tissue Cytometry技术用于验证配体与受体的细胞来源及共定位关系。
- 量化免疫抑制微环境特征
定量分析 PMC_P 区域的 PD-L1 表达水平,以及免疫抑制细胞(如 M2 型巨噬细胞)的浸润比例。
- 评估药物干预效果的影像依据
在 CEA-SV40 转基因小鼠模型中,使用Tissue Cytometry技术扫描抗 AREG、FK866(NAMPT 抑制剂)治疗后的胃组织切片。
通过定量 ITGA2(PMC_2 标志物)、VIM(成纤维细胞标志物)及 pp38、p-STAT1(信号通路激活标志物)的荧光强度,证实药物处理后这些癌前相关指标的表达显著降低,直观反映了药物对癌前病变的抑制作用。
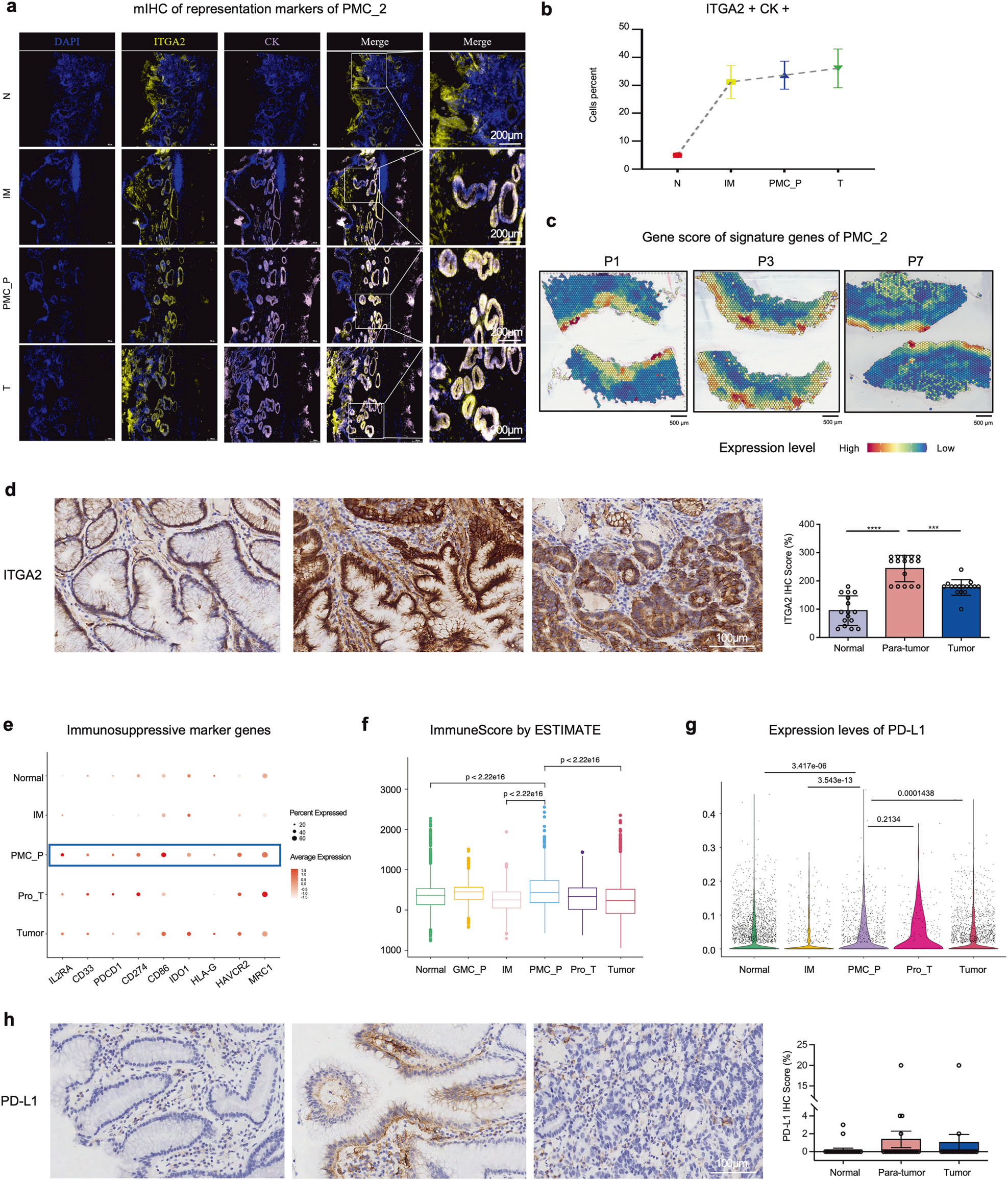
Figure 4 验证 PMC_P 区域的 PMC_2 细胞富集与免疫抑制特征
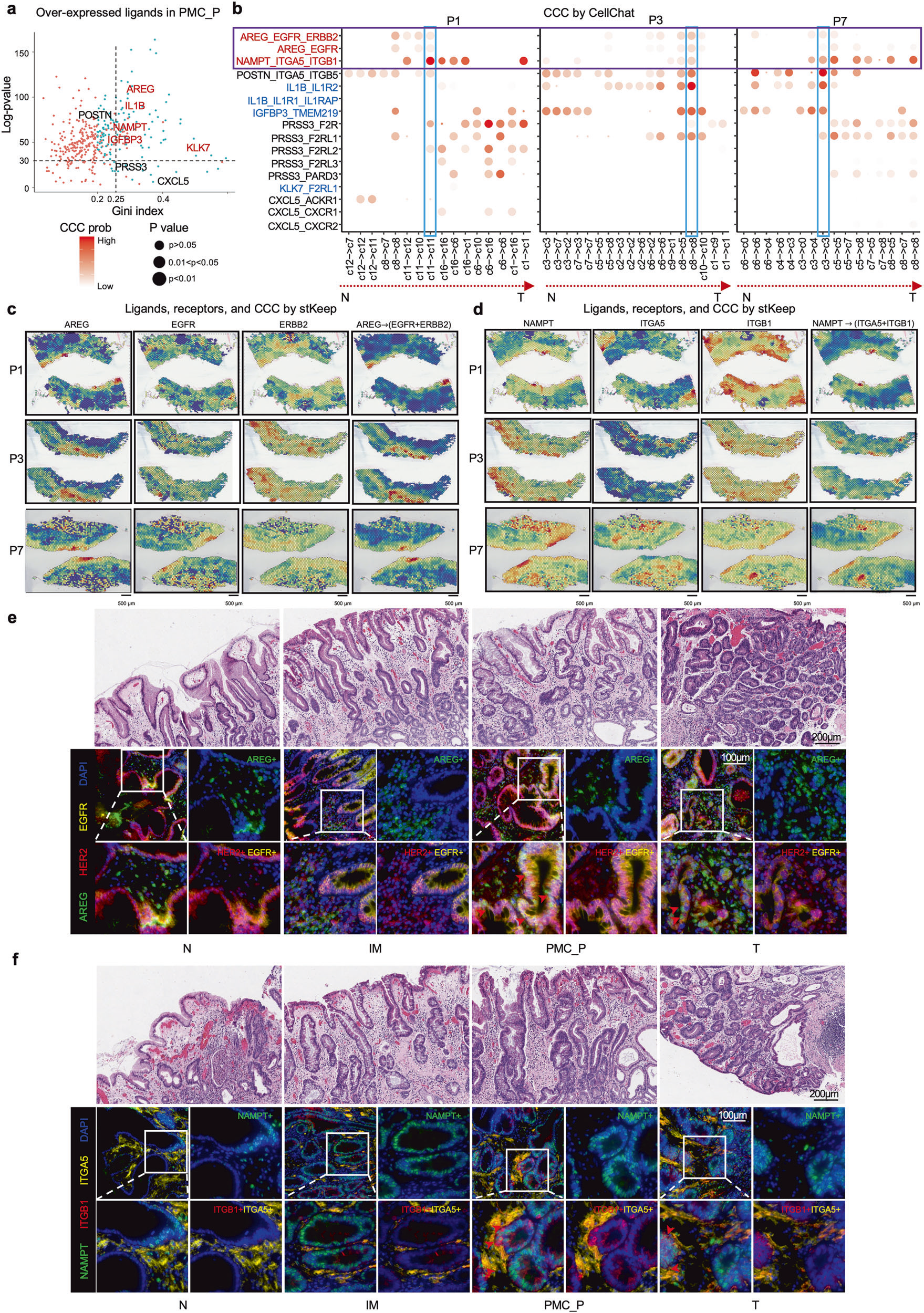
Figure 5:解析 PMC_P 区域的关键配体 - 受体互作(AREG-EGFR/ERBB2、NAMPT-ITGA5/ITGB1)
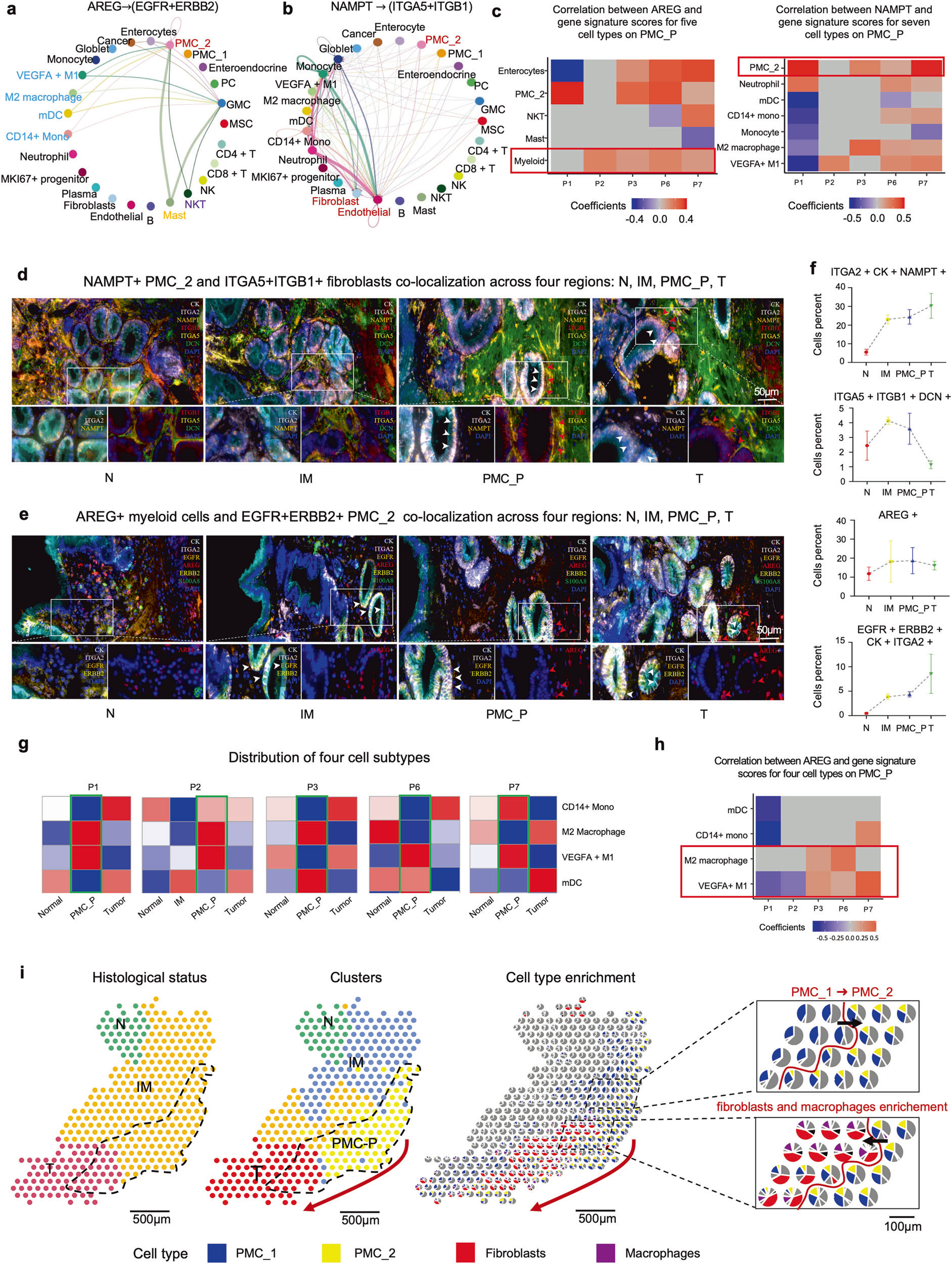
Figure 6:细化 PMC_2 与巨噬细胞、成纤维细胞的互作细节
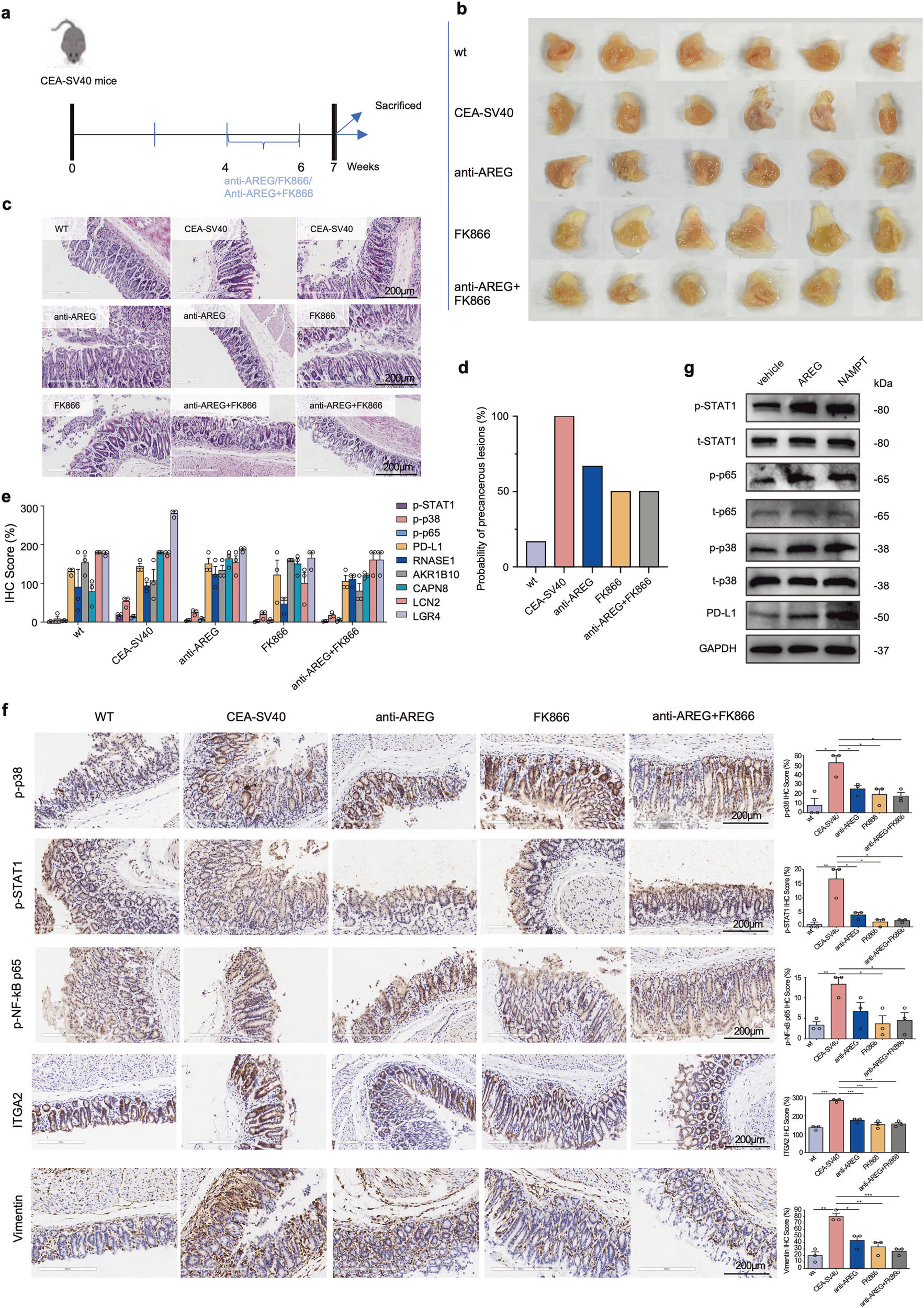
Figure 8:评估药物干预对癌前病变的抑制效果






