上海诺佰佰生物科技有限公司
4 年
手机商铺
- NaN
- 0.5
- 0.5
- 2.5
- 2.5
推荐产品
技术资料/正文
文献解读 | 一款靶向B7H3(CD276)位点糖基化的功能性抗体,有望启发肿瘤免疫治疗
127 人阅读发布时间:2025-06-12 11:01
1.文献解读
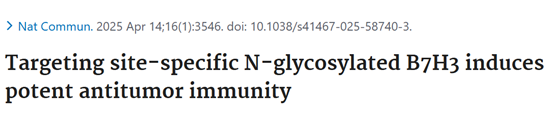
2025年4月发布在Nat. Commun上的一篇文章指出:N糖基化修饰是一种重要的蛋白质翻译后修饰,发生在Asn-X-Ser/Thr(X≠Pro)的NXT基序上,对蛋白质折叠、降解、定位、运输及相互作用等有重要影响。文中研究的 B7H3 是高度N糖基化的膜蛋白,在多种实体瘤高表达,其糖基化与肿瘤免疫逃逸相关,但关键糖基化位点不明。
2. 关于N糖基化位点的确定
人类B7H3含四对N糖基化位点(N91/N309、N104/N322、N189/N407、N215/N433),小鼠B7H3含四个N糖基化位点(N91、N104、N189、N215)。突变N91/309和N104/322位点,B7H3细胞表面定位显著降低,类似全糖基化缺陷突变体(B7H3-8NQ),恢复单个位点可部分恢复膜表达。如在图1a、1b、1c、1d中,通过流式细胞术检测不同突变体B7H3在细胞表面的表达情况,直观呈现出N91/309和N104/322位点突变对B7H3细胞表面定位的影响。
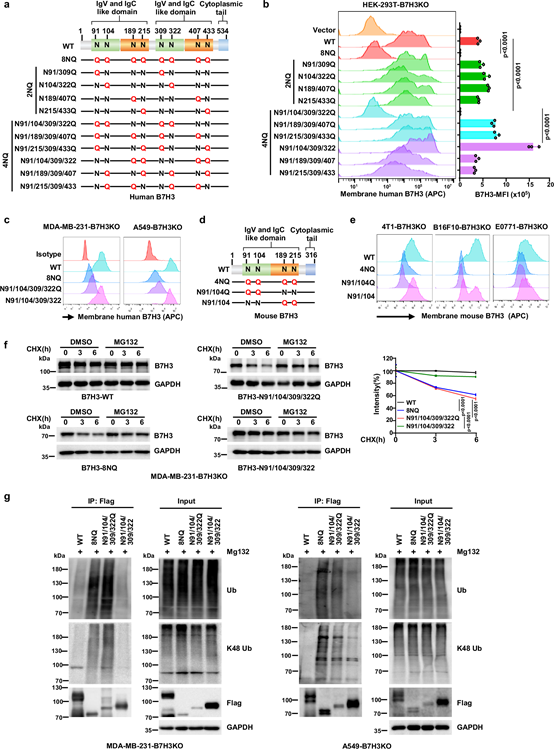
图1. B7H3在N91/N309和N104/N322位点的N-糖基化是B7H3蛋白细胞表面定位和稳定的主要因素
3.糖基化影响B7H3的稳定性
N91/309和N104/322位点糖基化缺失,B7H3通过内质网相关蛋白降解(ERAD)途径被泛素-蛋白酶体系统降解,降解速率加快、K48泛素化水平升高。图2a、b、c、d中,用蛋白酶体抑制剂MG132处理细胞,检测糖基化缺陷突变体B7H3蛋白水平变化;通过免疫沉淀结合蛋白质印迹检测泛素化水平,证实了这一降解途径。
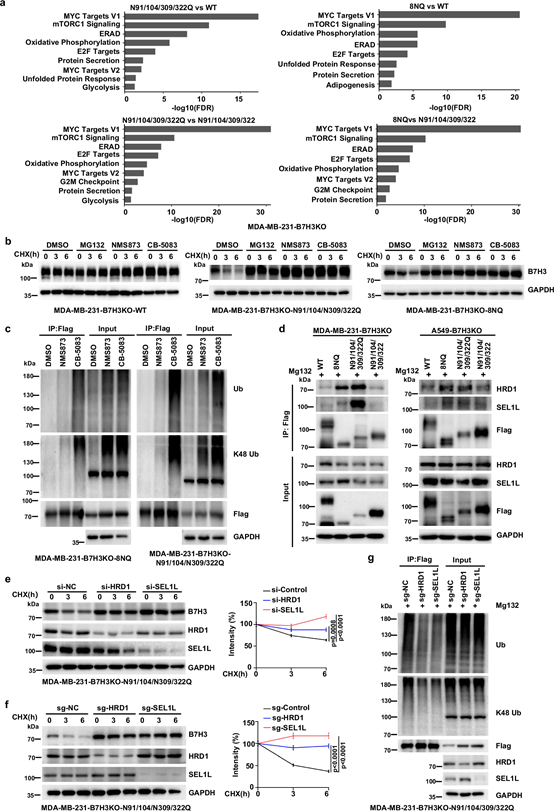
图2. B7H3在N91/N309和N104/N322处的异常N-糖基化诱导其ER相关降解
4.糖基化调控B7H3的胞内运输
N91/309和N104/322位点糖基化缺失,阻断B7H3从内质网(ER)到高尔基体的转运,使其在ER积累。免疫荧光显示,糖基化缺陷突变体(N91/104/309/322Q和8NQ)与ER标记物(KDEL)共定位,与ERGIC和高尔基体标记物(TGN38)共定位减少,在图2e、2f中清晰展示了这种共定位情况。
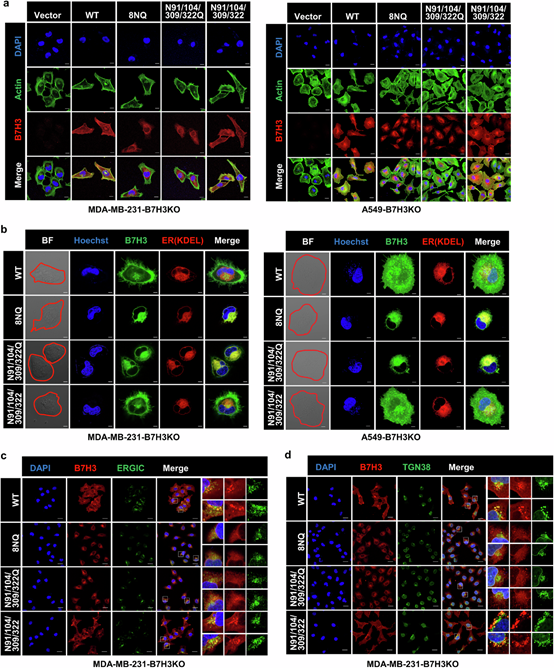
图3. B7H3在N91/N309和N104/N322位点的异常糖基化阻断了其内质网向高尔基体的易位
5.糖基化影响B7H3的免疫抑制功能
N91/309和N104/322位点的N糖基化对B7H3抑制T细胞增殖和活化至关重要,缺失会削弱其免疫逃逸能力。图4a、4b、4c、4d、4e、4f中,通过将表达野生型和糖基化缺陷型B7H3的细胞与CD4⁺/CD8⁺ T细胞共培养,检测T细胞增殖和细胞因子分泌,证明了这一点。
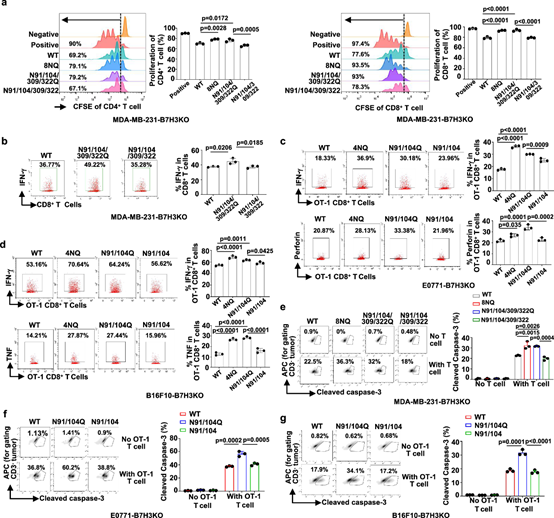
图4. B7H3在N91/302和N104/322位点的N-糖基化在体外调节其对T细胞的抑制功能
6.靶向糖基化B7H3的抗体开发
鉴于N91/302和N104/322糖基化位点的糖基化对B7H3的定位和功能的重要性,科学家们通过使用具有胞外结构域的重组人4Ig-B7H3-His融合蛋白(Met1-Thr461)对兔进行免疫接种,制备了优先识别糖基化B7H3的单克隆抗体。单克隆抗体Ab-82优先靶向N91/309和N104/322糖基化的B7H3,可诱导B7H3内吞和降解,激活细胞毒性T淋巴细胞(CTL)增强抗肿瘤免疫。
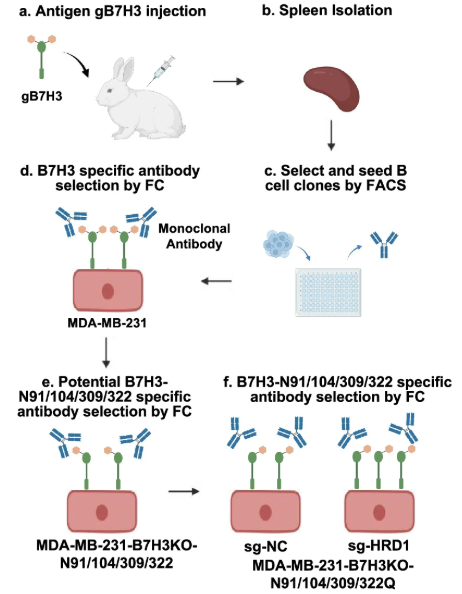
图5. 生成糖基化B7H3抗体的工作流程图
7.结论
该研究首次明确了N91/309和N104/322位点的N糖基化修饰是B7H3发挥细胞表面定位和免疫抑制功能的关键。这一发现为肿瘤免疫治疗提供了新的思路,即靶向糖基化的B7H3可能是一种有效的治疗策略,为后续相关药物的开发奠定了基础。




