- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
LINC00922-结直肠癌转移的靶点
发布时间:2024-04-07 10:55 | 点击次数:
赖氨酸巴豆酰化(Kcr)在结直肠癌(CRC)组织中上调,但其具体作用尚不确定。本研究旨在阐明组蛋白H3 Lys27的巴豆酰化(H3K27cr)在促进结直肠癌转移中的作用及机制。在临床上,H3K27cr在转移性结直肠癌组织中表达上调,且与晚期临床分期呈正相关。在功能上,敲低LINC00922抑制CRC细胞在体内和体外的迁移。此外,补充NaCr通过恢复H3K27cr水平,恢复了LINC00922稳定敲低细胞的迁移和侵袭水平。在机制上,LINC00922通过H3K27cr介导的细胞粘附分子(CAMs)促进侵袭和迁移。值得注意的是,LINC00922与SIRT3相互作用,阻断其与ETS1启动子区域的结合,导致该启动子区域的H3K27cr水平升高,随后激活ETS1转录。我们的发现揭示了由LINC00922调控的H3K27cr在促进结直肠癌转移中的一种新的调节功能。这一发现有助于更深入地理解组蛋白巴豆酰化在结直肠癌转移过程中的作用。本文于2023年10月发表于Molecular Cancer (IF=37.3)上。
技术路线

结果
1)H3K27cr水平与结直肠癌组织转移有关
我们利用免疫组织化学染色法对45例患者的结直肠肿瘤样本和14例患者的邻近组织中的H3K27cr水平进行了研究。有趣的是,研究结果显示远处转移部位的H3K27cr水平显著升高(图1A-B)。与癌旁组织相比,肿瘤组织的H3K27cr水平明显更高(图1C)。此外,H3K27cr水平在III期和IV期组织中高于I期和II期组织(图1D)。鉴于H3K27cr水平与远处转移存在关联,我们提出H3K27cr可能促进肿瘤转移的假设。NaCr通过直接产生crotonyl-CoA提高组蛋白巴豆酰化水平。为了验证我们的假设,我们将HCT116细胞培养在添加10 mM NaCr的培养基中,以提高细胞内H3K27cr的水平(图1E)。结果表明,NaCr促进了CRC细胞的侵袭和迁移(图1F-1G)。这些发现提示H3K27cr促进结直肠癌转移。

2)LINC00922与H3K27cr水平、结直肠癌转移和不良预后相关
由于先前的研究表明lncRNA在调节组蛋白巴豆酰化中发挥重要作用,因此接下来研究H3K27cr和lncRNA之间的关系。首先,对TCGA队列中在正常和CRC组织中表现出差异表达的lncRNA进行了分析,揭示了CRC组织中多种lncRNA的失调。随后,利用H3K27cr抗体对HCT116细胞进行ChIP-seq检测,提取启动子被H3K27cr占据的基因。随后,GSEA将这些基因与上述失调的lncRNA进行比较。结果发现,这些基因在高表达LINC00922或其他8种lncRNA的结直肠癌组织中富集(图2A)。相反,LINC00922与启动子标记为H3K9cr或H3K18cr的基因之间没有显著关系。值得注意的是,过表达LINC00922显著提高了H3K27cr的水平(图2B)。这些结果表明LINC00922与H3K27cr之间存在相关性。随后,对TCGA队列CRC患者中LINC00922的临床意义进行了调查。结果显示,LINC00922的高表达与CRC患者较短的生存期相关(图2C)。接下来,我们检查了TCGA队列中LINC00922与CRC组织临床病理特征之间的相关性。Mann-Whitney U分析显示,与正常组织相比,CRC组织中LINC00922的表达显著升高(图2D)。此外,LINC00922在有远处或淋巴结转移的结直肠癌患者中的表达高于无远处或淋巴结转移的结直肠癌患者(图2E-2F)。GEO队列的荟萃分析显示,高表达的LINC00922增加了远处转移的风险(图2G)。综上所述,高表达的LINC00922增加了CRC转移的风险,并与CRC患者预后不良相关。

3)LINC00922加速结直肠癌细胞的侵袭和迁移
为了进一步探讨LINC00922与结直肠癌转移的关系,我们研究了LINC00922在结直肠癌细胞侵袭和迁移中的作用。结果显示,LINC00922的缺失降低了CRC细胞的侵袭和迁移水平,而LINC00922的过表达则显示出相反的效果(图3A-3B)。我们还研究了LINC00922是否在体内调节肿瘤转移。将稳定的LINC00922敲低细胞经尾静脉注入小鼠体内。结果显示,敲除LINC00922可显著减少肺转移结节(图3C,3D)。免疫印迹分析表明,当LINC00922在CRC细胞中被敲除时,EMT相关基因(如Vimentin和Snail1)的表达水平显著下调。相反,过表达LINC00922具有相反的效果(图3E-3G),增加了这些基因的表达水平。这些结果表明,LINC00922促进CRC细胞的侵袭和迁移。
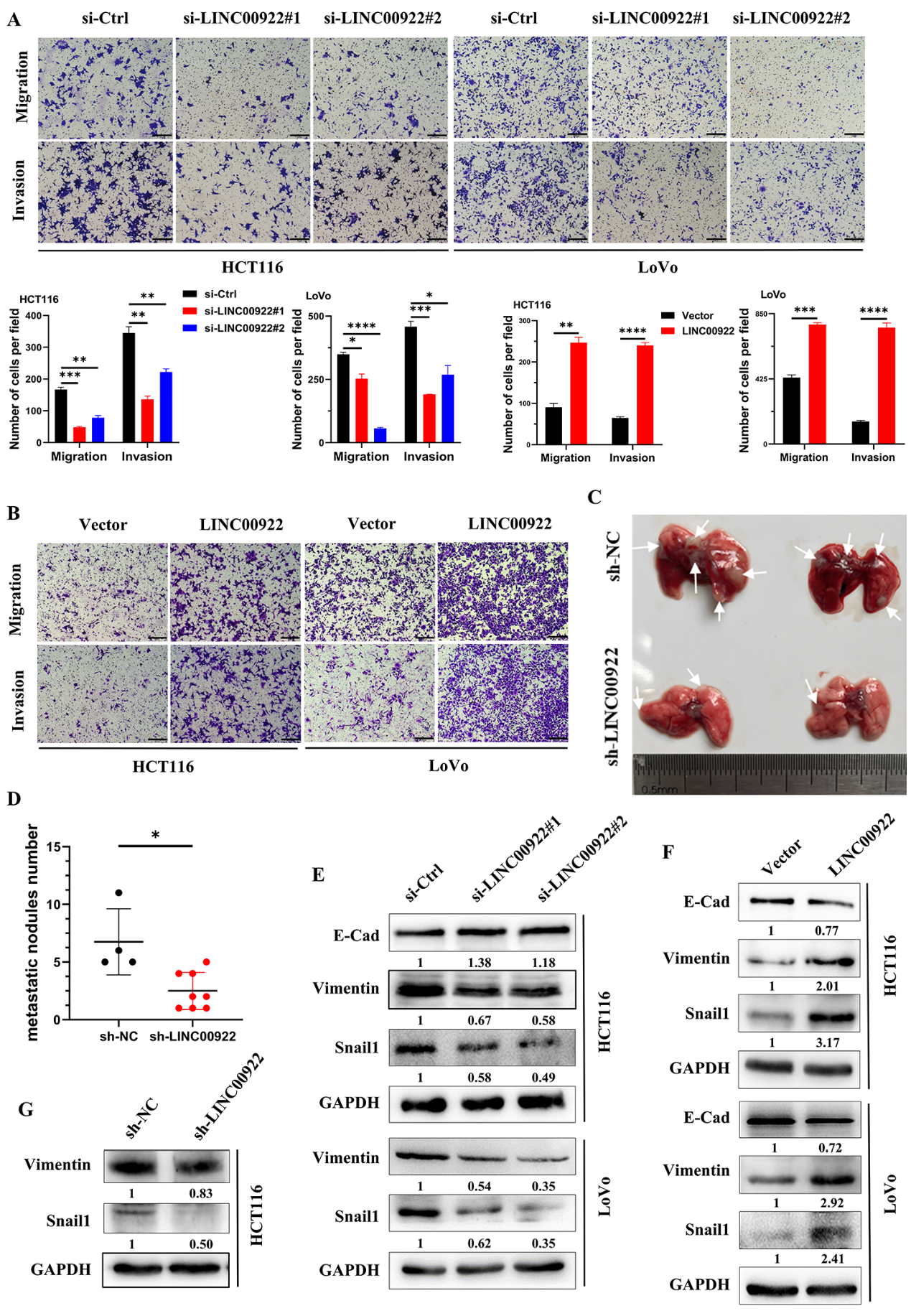
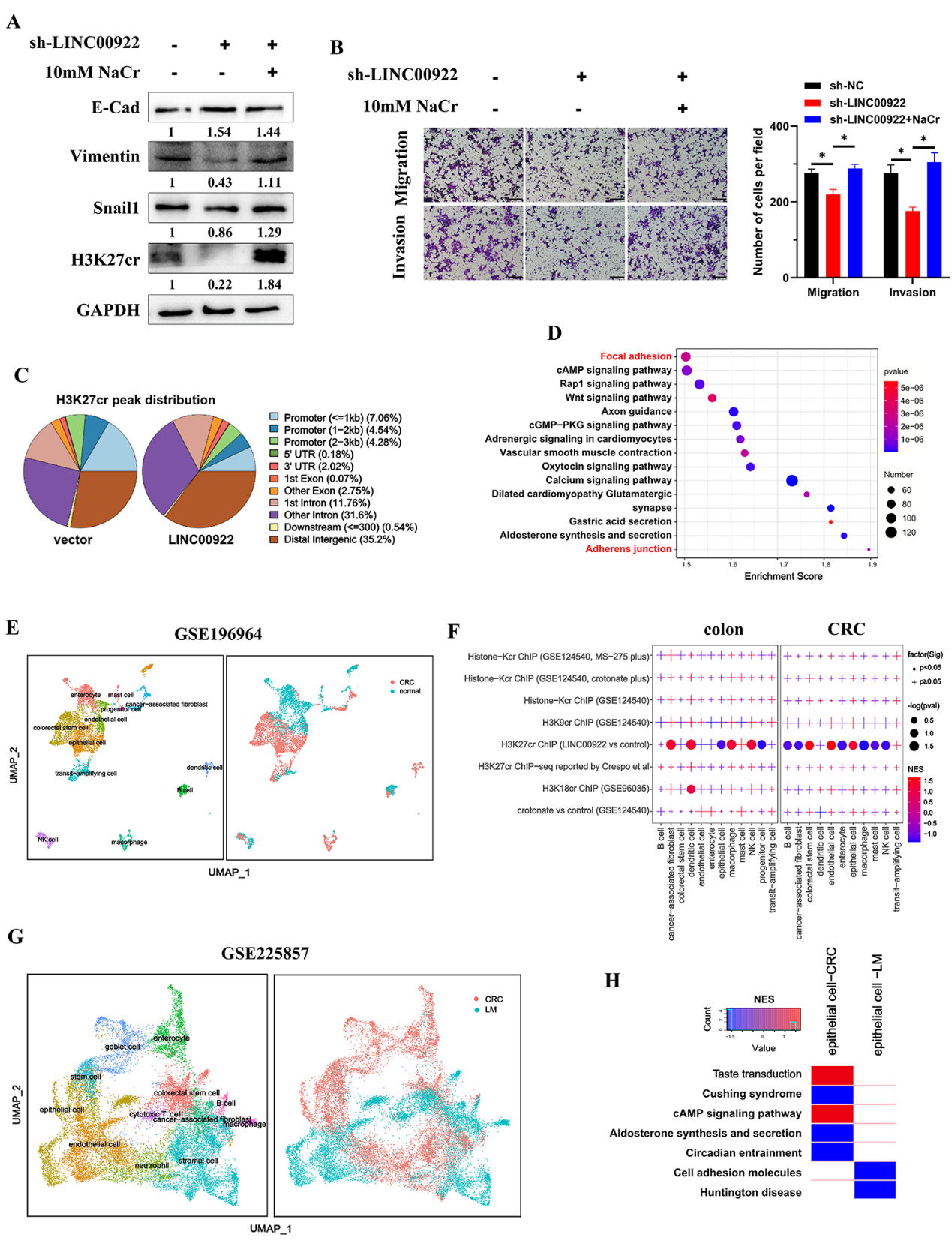
4)LINC00922通过H3K27cr介导的CAMs促进侵袭和迁移
为了研究LINC00922是否通过H3K27cr调控结直肠癌细胞的侵袭和迁移,将LINC00922稳定敲低的细胞用10 mM NaCr处理48 h,恢复H3K27cr水平。结果显示,补充NaCr恢复了E-cad、Vimentin和Snail1的水平,以及稳定的LINC00922敲低细胞的侵袭和迁移(图4A-4B),表明LINC00922通过H3K27cr调节CRC细胞的侵袭和迁移。随后,使用H3K27cr抗体对过表达LINC00922的HCT116细胞进行ChIP-seq检测。在LINC00922过表达细胞和对照细胞之间,共有21253个峰表现出差异占用(图4C),表明LINC00922影响了H3K27cr在染色体上的占用。KEGG分析上述21253个峰注释的基因的生物学途径,发现转移途径丰富,包括局灶黏附和粘附体连接(图4D)。由于先前的研究表明组蛋白巴豆酰化强有力地表明激活启动子,我们随后在启动子区域提取了653个具有两个峰的基因进行进一步研究。为了鉴定LINC00922通过H3K27cr调控的特定细胞类型,我们使用GSEA分析了这653个基因在结直肠癌组织单细胞转录组中的富集情况。该分析涉及来自GSE196964数据集的5678个细胞,鉴定出12个主要的细胞亚型(图4E)。在结肠组织中,653基因在树突状细胞、癌症相关成纤维细胞、NK细胞、巨噬细胞、祖细胞和上皮细胞中富集。在结直肠癌组织中,除了树突状细胞和转运扩增细胞外,653基因在所有细胞类型中都富集(图4F)。对其他数据集进行了相同的分析。对来自GSE221575数据集的5179个细胞进行了分析,鉴定出11种主要的细胞亚型(补充结果未展示)。在结肠组织中,653基因在内皮细胞和上皮细胞中富集。在结直肠癌和肝转移(LM)结直肠癌组织中,观察到主要富集在B细胞和上皮细胞中。因此,上皮细胞是下一个重点。
为了研究LINC00922通过H3K27cr影响的调控途径,我们注释了与这653个基因相关的生物学途径。我们的研究结果显示79个通路,如局灶粘附、粘附连接、紧密连接和细胞粘附分子(CAMs),包含超过5个基因。在包含CRC和LM组织的GSE225857数据集中,对20,753个细胞进行了全面分析,鉴定出12种主要细胞亚型(图4G)。将79种途径分别与从CRC和LM组织中提取的上皮细胞进行了比较。结果发现,CAMs通路在LM组织来源的上皮细胞中呈负富集(图4H)。因此,这些发现表明,LINC00922通过H3K27cr介导的CAMs促进侵袭和迁移。
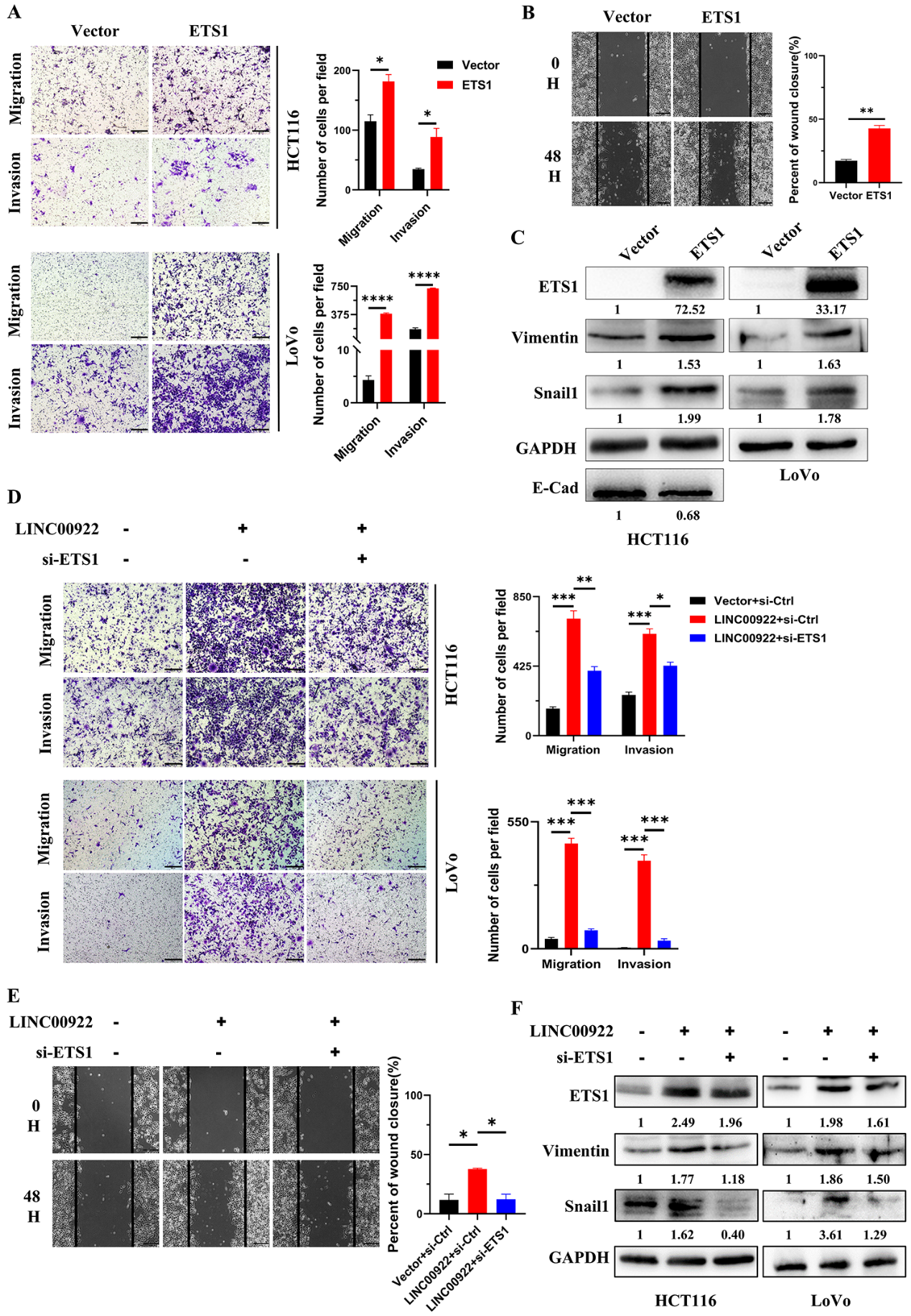
5)LINC00922通过ETS1促进侵袭和迁移
前期研究表明,ETS1调控CAMs的表达。因此,我们下一步研究LINC00922是否通过ETS1调控入侵和迁移。首先,本研究证明外源性ETS1促进了CRC细胞的侵袭、迁移和细胞运动(图5A-5B)。此外,过表达ETS1增加了Vimentin和Snail1的表达,降低了E-cad的表达(图5C)。拯救实验表明,抑制ETS1通过恢复Vimentin和Snail1水平,恢复CRC细胞的侵袭、迁移和细胞运动水平(图5D-5F)。这些结果表明,LINC00922通过ETS1调控了侵袭和迁移。
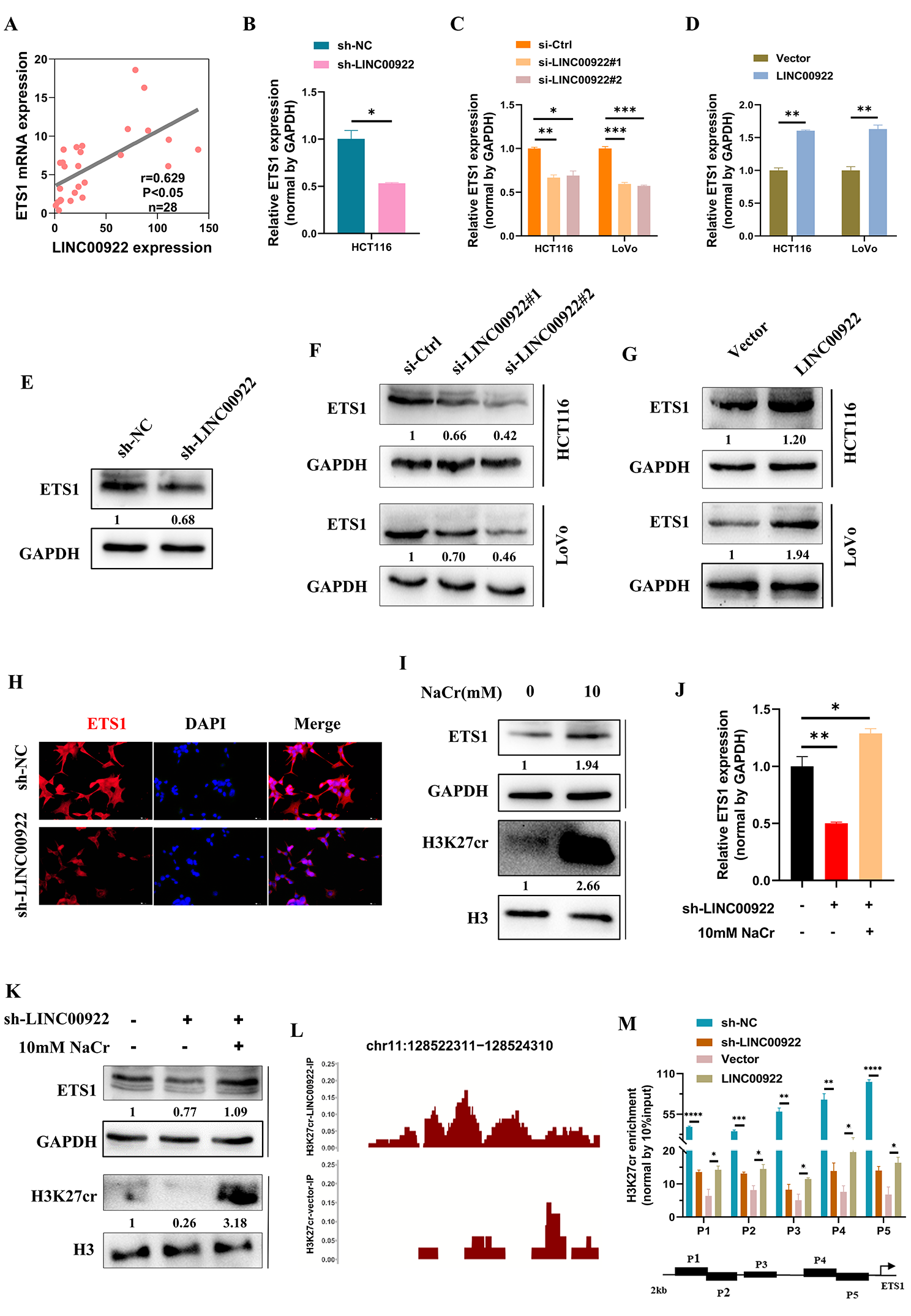
6)LINC00922通过调节H3K27cr水平调控ETS1的表达
接下来,我们研究了LINC00922是否改变了ETS1的表达。我们对28例CRC患者的组织进行了qRT-PCR分析。结果显示,LINC00922的表达与ETS1之间存在直接相关性(图6A)。敲低LINC00922的表达表明,瞬时和稳定敲低LINC00922均可降低ETS1 mRNA水平(图6B-6C)。相反,CRC细胞中LINC00922的过表达增加了ETS1的mRNA水平(图6D)。ETS1的蛋白水平也表现出类似的趋势(图6E-6G)。荧光图像还显示,稳定的LINC00922敲低显著降低了ETS1的蛋白水平(图6H)。接下来,我们研究LINC00922是否通过H3K27cr调控ETS1的表达。首先,10 mM NaCr处理的HCT116细胞增加了H3K27cr和ETS1的水平,表明H3K27cr可能激活了ETS1的转录(图6I)。随后,在稳定的LINC00922敲低细胞的培养基中加入10 mM NaCr,培养48 h后恢复H3K27cr水平。我们发现,NaCr恢复了LINC00922稳定敲低细胞的ETS1表达,表明LINC00922通过调节H3K27cr调节ETS1表达(图6J-6K)。ChIP-seq数据显示,过表达的LINC00922增加了H3K27cr在ETS1启动子区域的占据(图6L)。ChIP-qPCR也证实了这一结果,即沉默LINC00922显著降低了H3K27cr在ETS1启动子区域的占据,而外源LINC00922则起到相反的作用(图6M)。综上所述,LINC00922改变了H3K27cr在ETS1启动子区域的富集水平。导致ETS1表达的改变。
7) LINC00922通过与SIRT3相互作用改变H3K27cr的占用
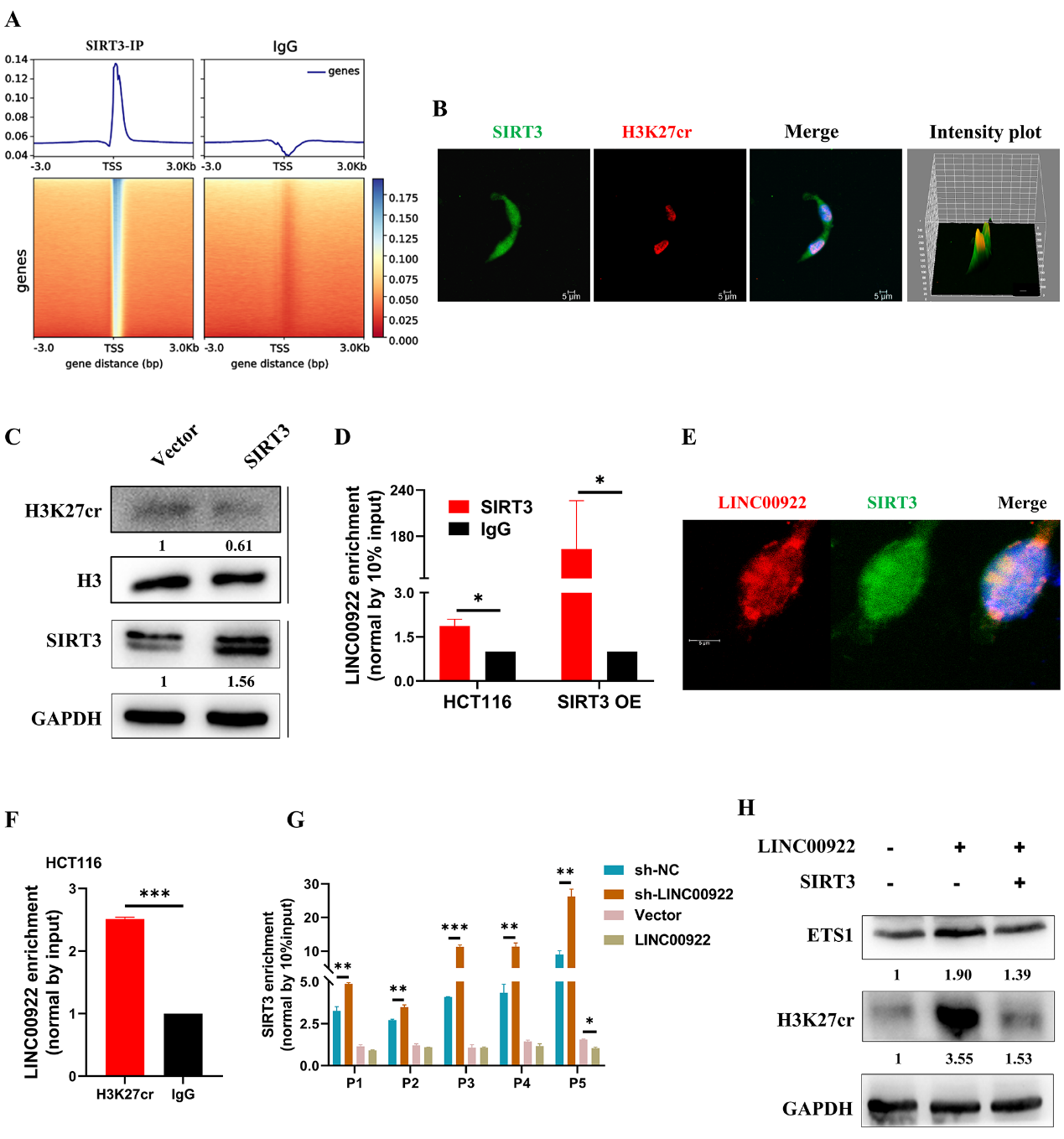
我们研究了LINC00922如何改变ETS1启动子上H3K27cr的富集水平。HCT116细胞的ChIP-seq显示SIRT3分布在TSS区附近(图7A)。然而,SIRT3如何向TSS区富集的过程尚不清楚。我们假设LINC00922参与了SIRT3向TSS区域的富集。为了验证这一点,我们首先研究了HCT116细胞中SIRT3和H3K27cr之间的相关性。免疫荧光图像显示,SIRT3和H3K27cr在HCT116细胞的细胞核中共定位(图7B)。不出所料,外源性SIRT3降低了H3K27cr水平(图7C)。接下来,我们研究了LINC00922是否通过调节SIRT3改变了H3K27cr的表达。RNA免疫沉淀(RIP)实验显示,在HCT116细胞中,LINC00922与SIRT3相互作用,且在过表达SIRT3的HCT116细胞中富集程度更高(图7D)。荧光原位杂交(RNA-FISH)实验显示,LINC00922与SIRT3在HCT116细胞中共定位(图7E)。RIP实验还显示,LINC00922与H3K27cr相互作用(图7F)。随后,我们利用ChIP-qPCR研究了LINC00922是否影响了ETS1启动子区域SIRT3的富集。结果显示,在LINC00922敲低的细胞中,ETS1启动子区域SIRT3的富集程度更高,而外源LINC00922则表现出相反的效果(图7G)。随后,我们进行了拯救实验。值得注意的是,SIRT3过表达恢复了ETS1的表达(图7H)。我们的研究结果表明,LINC00922与SIRT3相互作用并将其逐出ETS1启动子区域,从而增加了ETS1启动子区域的H3K27cr水平,激活了ETS1表达。
结论
我们的研究提出了LINC00922介导的SIRT3募集和H3K27cr修饰在人类癌症转移中的工作模型。更好地了解组蛋白巴豆酰化在生物过程中的关键作用可能会导致新的癌症治疗策略。
实验方法
单细胞RNA测序,transwell,伤口愈合实验,WB,qRTPCR,免疫荧光,ChIP-qPCR,RNA免疫沉淀实验,FISH,IHC。
参考文献
Liao M, Sun X, Zheng W, Wu M, Wang Y, Yao J, Ma Y, Gao S, Pei D. LINC00922 decoys SIRT3 to facilitate the metastasis of colorectal cancer through up-regulation the H3K27 crotonylation of ETS1 promoter. Mol Cancer. 2023 Oct 4;22(1):163. doi: 10.1186/s12943-023-01859-y.















