产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
YY1液滴复合物浇灌M2巨噬极化导致前列腺癌进展
发布时间:2024-03-27 08:39 | 点击次数:
肿瘤相关巨噬细胞主要是M2极化表型,通过分泌多种细胞因子重塑肿瘤微环境,促进肿瘤进展。本研究通过过表达YY1的转基因小鼠证明了YY1在M2巨噬细胞中的作用,并研究了靶向M2巨噬细胞YY1治疗前列腺癌(PCa)的潜力。此外,YY1通过调节相分离和增强子-启动子相互作用,从而促进巨噬细胞中IL- 6的转录、从而重塑肿瘤微环境。本文于2023年4月发表在《Journal of Immunotherapy of Cancer》IF: 11.4期刊上。
技术路线

主要实验结果
1、在体内YY1过表达增加M2巨噬细胞浸润和PCa进展
从oe-YY1转基因小鼠和野生型小鼠中提取腹腔源性巨噬细胞(PCDM)和骨髓源性巨噬细胞(BMDM)。流式细胞术发现,oe- YY1小鼠巨噬细胞中CD163+ M2的比例明显增加,而CD86 + M1的比例没有明显增加(图1A-C)。此外,oe- YY1小鼠的PCa肿瘤负荷比野生型生长更快(图1D)。免疫荧光显示离体肿瘤中CD163+ M2的显著更高其oe- YY1小鼠显著多于野生小鼠(图1E)。在oe- YY1小鼠中还观察到低丰度的CD4和CD8细胞的浸润(图1F)。流式细胞术证实oe- YY1小鼠肿瘤中M2细胞比较更高,CD8毒性T细胞比例更低(图1G),且伴随更低的IFNγ的表达(图1H),说明过表达YY1降低T细胞的抗肿瘤活性。随后构建肺转移模型,结果显示过表达YY1带来的肿瘤生成效果被巨噬细胞清除剂clodronate liposomes所抑制(图1I)。将oe- YY1小鼠来源的骨髓细胞注射至野生小鼠构建嵌合小鼠,然后皮下成瘤,结果显示,与对照组比较,YY1过表达组小鼠的肿瘤更大(图1J)。
随后将M2巨噬细胞靶向肽(M2pep)合成至脂质体载体上,其转染了YY1 siRNA(M2pep-siYY1)用于靶向M2巨噬细胞的YY1。M2pep-siYY1和对照siNC尾静脉注射至oe- YY1小鼠PCa肺转移小鼠中。结果显示M2pep-siYY1组的存活显著延长(图1K),PD-1抑制剂联合处理进一步显著延长小鼠存活并减少转移结节(图1L)。HE和IHC染色显示M2pep-siYY1和PD-1处理显著降低肺结节并增加CD8和CD4T细胞的浸润(图1M)。总之,以上结果表明在体内YY1过表达增加M2巨噬细胞浸润和PCa进展。

图1在体内YY1过表达增加M2巨噬细胞浸润和PCa进展
2、YY1在人前列腺癌中与CD163 + M2巨噬细胞呈正相关
为验证YY1和巨噬细胞的关系,作者利用IHC检测了临床队列PCa和癌旁样本中YY1和CD163的表达。有趣的是,作者发现YY1不仅在恶性细胞上表达,而且在CD163 +巨噬细胞浸润的肿瘤基质中,特别是在巨噬细胞样细胞中,也表现出相当的表达水平(图2A)。多色IHC显示,YY1在CD163巨噬细胞浸润的肿瘤机制中表达(图2B-C)。IHC组织芯片结果显示YY1得分在肿瘤基质和转移淋巴结中都显著高于正常对照(图2D-E)。此外,YY1得分越高的肿瘤基质中CD163的表达越高(图2F)。YY1得分高于不良预后相关(图2G),而YY1和CD163得分都高的患者预后也更差(图2H)。综上所述,通过对临床组织的分析,我们发现YY1在前列腺肿瘤浸润的M2巨噬细胞上表达,并且肿瘤基质中YY1的表达也与CD163 +巨噬细胞的含量呈正相关。
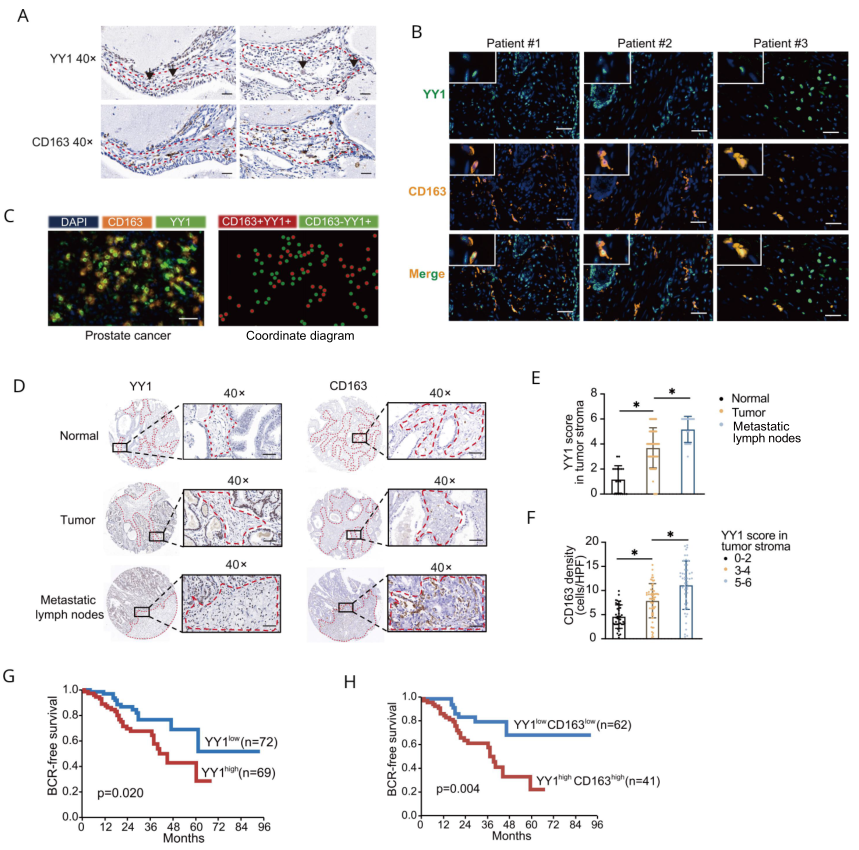
图2 YY1在人前列腺癌中与CD163 + M2巨噬细胞呈正相关
3、YY1通过IL- 4/STAT6通路上调,参与M2巨噬细胞极化
鉴于上述结果,作者开始检测YY1是否调控巨噬细胞M2极化。利用THP-1诱导M0和M2巨噬细胞(图3A)。流式细胞术证实了CD206标记的M2巨噬细胞的比例(图3B)。巨噬细胞M2极化也被qRT- PCR和WB证实,且YY1的表达在M2巨噬细胞中显著高于M0巨噬细胞(图3C-D)。因此,成功诱导M2巨噬细胞且YY1在其内表达。
有趣的是,作者观察到YY1过表达诱导的细胞形态变化和M0诱导M2极化的变化类似(图3E-F)。此外,YY1过表达显著促进M2相关标志物的表达抑制M1标志物表达(图3G),并显著促进M2巨噬细胞的比例(图3H)。这些结果表明YY1促进M2巨噬细胞极化。数据库预测分析发现STAT6是YY1启动子结合的参与M2极化调控IL-4信号通路的关键转录因子。双荧光素酶和ChIP实验证实了该结果(图3I-J)。IL-4诱导的M2巨噬细胞中STAT6高度磷酸化。综上,YY1通过IL- 4/STAT6通路上调,参与M2巨噬细胞极化。

图3 YY1通过IL- 4/STAT6通路上调,参与M2巨噬细胞极化
4、YY1增加M2巨噬细胞诱导的前列腺癌恶性表型
通过使用M0和M2巨噬细胞的条件培养基(CM)共培养PCa细胞系证实了M2巨噬细胞的促肿瘤作用(图4A)。随后,利用YY1过表达或抑制的M2巨噬细胞CM孵育PCa细胞,结果显示与对照组比较,YY1过表达M2的CM显著促进细胞的迁移,增殖和集落形成,敲低则相反(图4B-F)。与oe- YY1 PBMC来源的巨噬细胞CM培养14天后,PCa患者的人原发性癌细胞类器官的平均半径和面积也有所增加(图4G)。与oe- YY1 M2 RAW264.7细胞混合的皮下成瘤模型肿瘤的体积和重量都显著增加(图4H),肺转移结节也显著增多(图4I)。随后,对oe- YY1 M2巨噬细胞CM或对照CM处理的LNCaP细胞进行RNA测序,发现实验组上调的基因主要富集至NF-κB和JAK- STAT信号通路(图4J-K),且WB证实了STAT3和p65的高表达。
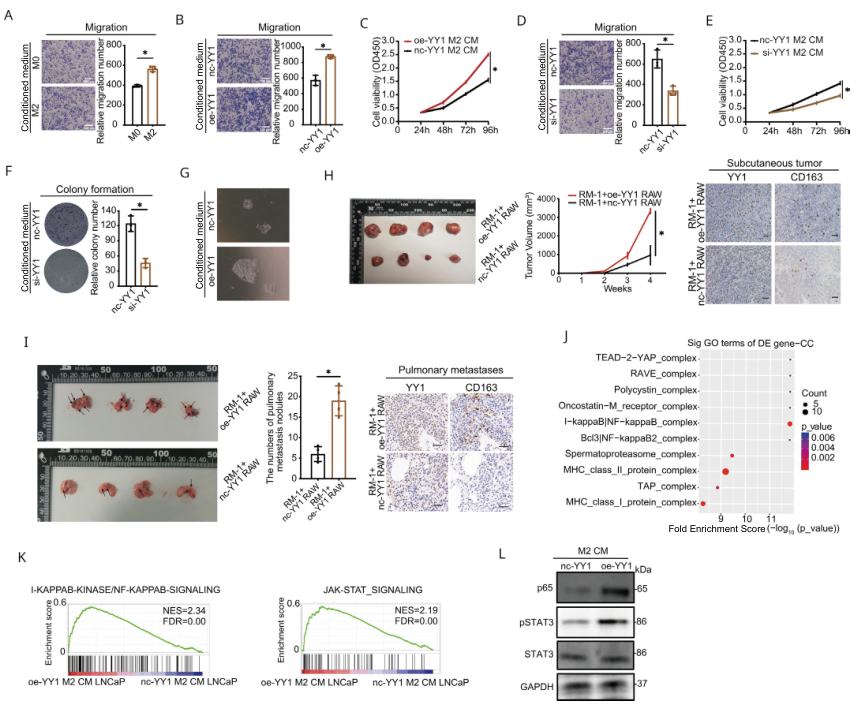
图4 YY1增加M2巨噬细胞诱导的前列腺癌恶性表型
5、M2巨噬细胞中YY1上调IL- 6可增加前列腺癌恶性表型
作者在oe- YY1和si- YY1 M2巨噬细胞CM以及nc- YY1 M2 CM中进行了27种与肿瘤免疫相关的细胞因子液悬芯片检测。与对照组相比,oe- YY1组M2巨噬细胞CM中IL- 6水平显著上调,YY1抑制组IL- 6水平显著下调(图5A-B)。WB证实YY1过表达促进IL-6的表达,敲除YY1则相反(图5C-E)。因此,接下来探究IL-6是否是YY1诱导促肿瘤的关键,进行了回复实验。结果显示过表达IL-6(rIL-6)显著促进因YY1敲除引起的肿瘤抑制(图5F-I),相反加IL-6抗体沉淀IL-6则显著逆转YY1过表达对肿瘤恶性表型的影响(图5J-M)。这些结果表明YY1通过IL-6促进PCa的恶性表型。
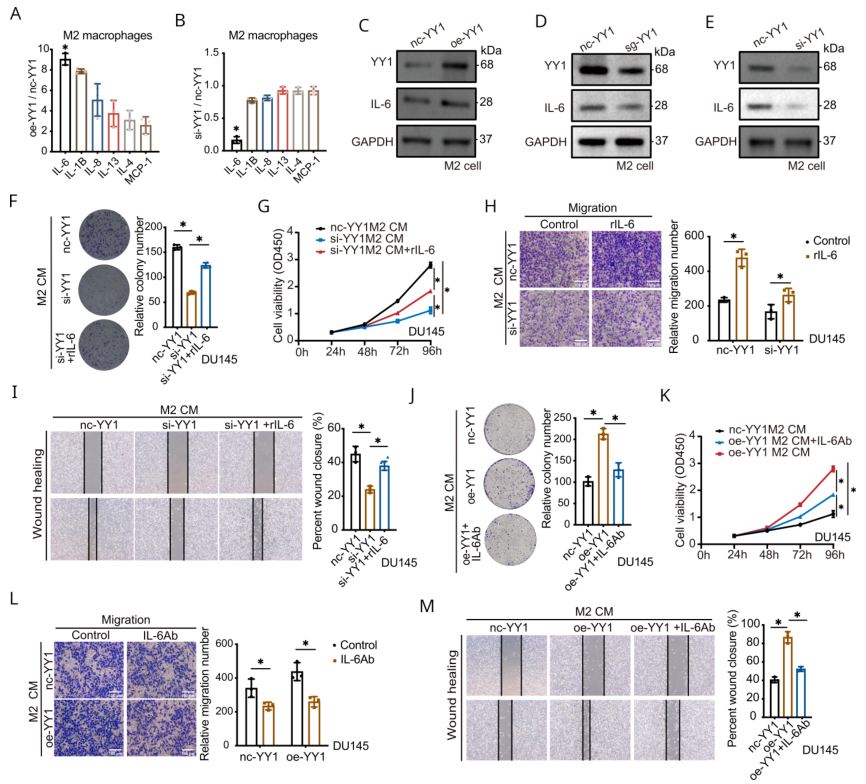
图5 M2巨噬细胞中YY1上调IL- 6可增加前列腺癌恶性表型
6、YY1通过调节p300、p65和CEBPB来调节IL- 6的表达
为进一步研究YY1在巨噬细胞中调控IL- 6的详细机制,根据JASPAR数据库预测了IL- 6启动子区域的主要转录因子。有趣的是,在IL- 6启动子区域发现了四个YY1结合位点(P1-P4),还发现YY1、CEBPB和p65的基序位于IL- 6启动子附近(图6A)。使用生物信息学分析了这4个蛋白的互作,发现YY1与其它三个蛋白结合并处于中心地位(图6B)。ChIP-qPCR结果证实YY1、CEBPB和p65都结合至IL-6的启动子区域(图6C-E)。ChIP- on- ChIP实验证实4个蛋白都结合在IL-6启动子的P4区域(图6F)。双荧光素酶实验也证实了YY1、CEBPB和p65都结合IL-6的启动子区域并增强该区域的活性(图6G-J)。这些结果表明YY1、p300、p65和CEBPB作为上游转录因子,通过结合IL- 6启动子区域促进IL- 6转录。
从M2巨噬细胞中提取总蛋白,对YY1、p65、CEBPB和p300进行共免疫沉淀和免疫印迹,以验证它们之间的相互作用(图6K-M)。p300基因敲除或复合物抑制剂金丝桃素可抑制它们之间的相互作用(图6N、O)。此外,金丝桃素不仅减少了M2巨噬细胞中IL- 6 mRNA的表达(图6P),还降低了与M2巨噬细胞CM孵育的PCa细胞的增殖和迁移(图6Q、R)。
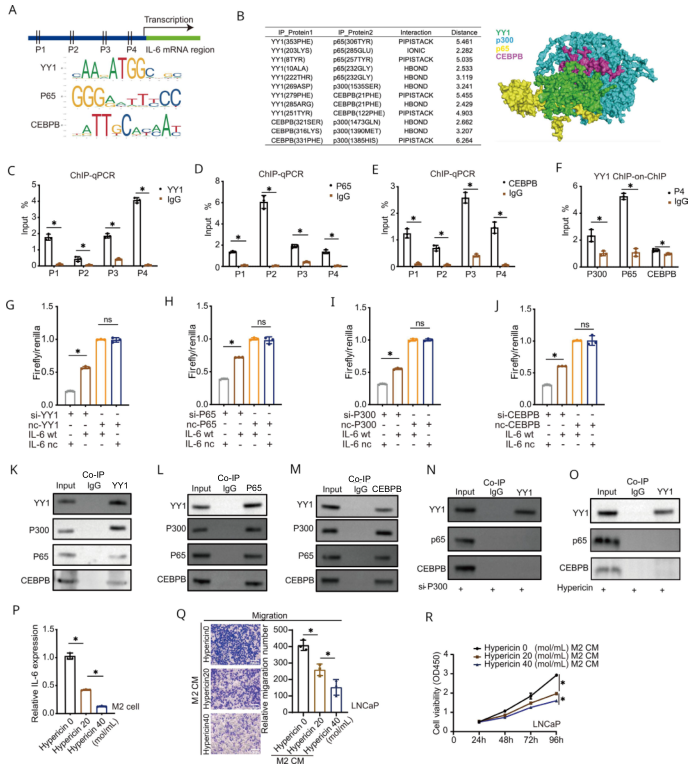
图6 YY1通过调节p300、p65和CEBPB来调节IL- 6的表达
7、YY1通过M2特异性增强子促进IL- 6转录
作者对PCa的肿瘤组织和癌旁组织的单细胞测序结果进行分析,发现与前列腺正常组织巨噬细胞相比,YY1和辅因子CEBPB在PCa巨噬细胞中转录活性均显著升高,均排在前20位转录因子列表(图7A)。对M2巨噬细胞和THP- 1细胞进行了H3K27ac和YY1的ChIP- seq,发现了数千个在M2极化过程中发生变化的获得或丢失的增强子(图7B)。在M2极化过程中,共有15241个增强子被鉴定为M2特异性增强子。THP- 1细胞中M2特异性增强子的H3K27ac信号较低,M2巨噬细胞中M2特异性增强子的YY1 ChIP- seq信号也富集(图7C)。无论如何,M2特异性增强子的YY1 ChIP- seq信号显著下降,表明YY1在M2巨噬细胞中发挥重要作用。
为鉴定IL- 6的不同增强子,使用Hi-C数据鉴定增强子-启动子相互作用。发现M2特异性IL-6增强子与IL- 6启动子直接相互作用(图7B,D),并且在其周围有明显更强的H3K27ac和YY1ChIP- seq 信号在极化的M2巨噬细胞中,与THP- 1细胞比较(图7C)。为证实位于Hi- C数据中的IL- 6增强子的作用,构建一个荧光素酶基因质粒,其中含有四个片段(E1-4区)的增强子片段(图 7E)。然后和过表达YY1载体共转染到M2巨噬细胞中,通过荧光素酶检测和染色体构象捕获(3C)实验,确定了E1区(增强子片段的远端)是YY1的结合位点(图7F-G)。用CRISPR- Cas9敲除M2巨噬细胞中的E1区(sg-E1),ELISA和qRT- PCR显示IL- 6表达量减少(图7H-I)。溴域抑制剂JQ1抑制了增强子信号也下调了IL- 6的表达(图7J)。这些结果表明这些结果表明,M2-特异性IL-6增强子对IL- 6转录的重要作用。
接下来,进行体外和体内实验,以验证M2特异性增强子对M2巨噬细胞极化和功能的影响。首先,经JQ1处理的巨噬细胞中ARG-1和IL-10的mRNA表达量较低,表明JQ1抑制了M2的极化(图7K)。此外,当在DU145细胞和M2巨噬细胞的共培养体系中加入JQ1时,与阴性对照相比,恶性细胞的迁移和侵袭能力明显受到抑制(图7L)。为精确检验M2特异性增强子对M2巨噬细胞功能的影响,用sg- E1 M2 CM培养DU145细胞。在sg- E1组中,PCa细胞的恶性行为降低(图7M)。在体内实验中,小鼠皮下注射肿瘤2周后,连续腹腔注射JQ1和CPI- 637(分别是针对BRD4和p300/CBP溴链的增强子抑制剂)3周后再收获肿瘤,发现肿瘤体积与阴性对照组相比明显缩小(图7N)。总之,YY1复合物通过M2-特异性增强子上调IL-6,从而促进PCa的进展。
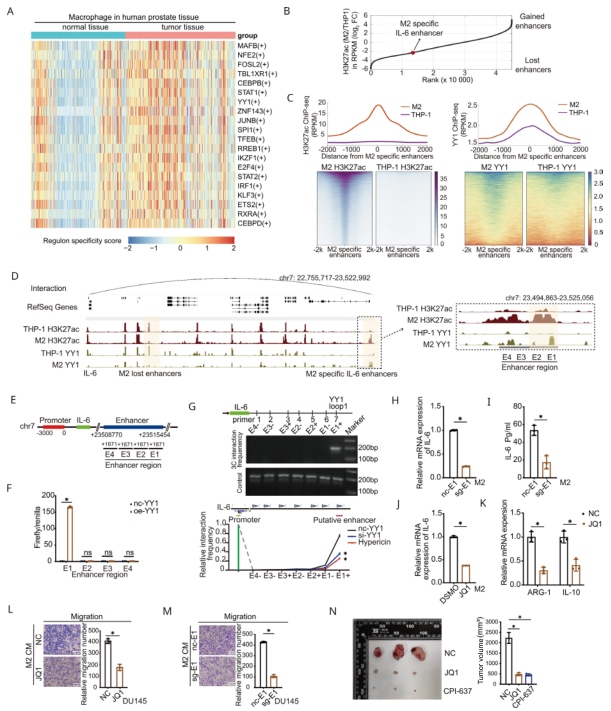
图7 YY1通过M2特异性增强子促进IL- 6转录
8、YY1在M2巨噬细胞极化过程中形成LLPS
对YY1进行免疫荧光时,IL- 4刺激的M2巨噬细胞核内液滴数量较PMA- THP- 1 M0细胞明显增加(图8A),表明YY1可能通过LLPS形成凝析油。接下来,根据PONDR评分预测YY1的大IDRs(图8B)。通过荧光显微镜,观察到LLPS液滴的密度随YY1- IDR- EGFP蛋白浓度的增加而增加(图8C),但在使用1,6- 己二醇(1,6- Hex)处理后,液滴密度下降,因为1,6- Hex 会破坏介质中的弱疏水键。在YY1-非-IDR-EGFP细胞中检测不到液滴(图8C)。
接着,将YY1- IDR- EGFP、YY1-非 IDR-EGFP 和EGFP标记的YY1全长质粒转染到M2巨噬细胞中,并在共聚焦荧光显微镜下观察活细胞。与YY1-非IDR- EGFP组相比,YY1- EGFP组和YY1-IDR-EGFP组的液滴数量明显增加(图8D)。此外,还在一些液滴中观察到融合和裂解(图8E),并且在光漂白目标病灶后,核穿刺点的荧光强度可以恢复(图8F),这表明巨噬细胞中的核凝聚物是由LLPS形成的。为进一步明确YY1液滴在巨噬细胞中的位置以及IDR区在液滴形成中的作用,在细胞固定后染色DAPI,并通过全长YY1 CRISPR/Cas9敲除YY1-IDR区,以及在M2巨噬细胞中过表达非IDR区(sg- YY1- IDR)。发现YY1液滴主要位于M2巨噬细胞核内,YY1- IDR敲除后液滴数量显著减少(图8G,H)。
此外,YY1/p300/p65/CEBPB 复合物中预测的YY1结合位点位于YY1- IDR 段(图6B)。用EGFP抗体进行免疫沉淀,然后进行免疫印迹,结果表明在M2巨噬细胞中p65、p300和CEBPB与YY1- IDR- EGFP相互作用(图8I)。还观察到YY1的LLPS凝聚物与p300、p65和CEBPB的共定位(图8J)。同时,在抑制p300、p65和CEBPB表达的siRNA以及p300/p65复合物抑制剂金丝桃素的干预下,M2巨噬细胞中的YY1凝聚物被化解(图8K)。简而言之,这些结果表明YY1- IDR区段在YY1 LLPS中的关键作用以及YY1/p300/p65/CEBPB复合物促进了在M2巨噬细胞中形成YY1介导的LLPS。此外,与阴性对照相比,用1,6-Hex预处理或转染sg-YY1-IDR后,IL- 4-刺激的巨噬细胞中M2标记(ARG-1和IL-10)和IL- 6的相对表达明显降低(图8L、M)。此外,敲除YY1复合体中的辅因子也降低了ARG- 1和IL- 10的表达(图8N)。总之,YY1复合物在M2极化过程中形成了LLPS并且YY1介导的LLPS上调了M2巨噬细胞中IL-6的表达。

图8在M2巨噬细胞极化过程中,YY1形成液-液相分离
实验方法
临床组织样本采集,细胞培养和转染,CRISPR-Cas9敲除技术,RT-qPCR,流式细胞术,WB,荧光素酶实验,ChIP,ELISA,RNA测序,细胞增殖实验,Transwell实验,小鼠成瘤实验,转基因小鼠构建,单细胞测序,相分离液滴实验,光漂白后荧光恢复(FRAP)试验
参考文献
Chen S, Lu K, Hou Y, You Z, Shu C, Wei X, Wu T, Shi N, Zhang G, Wu J, Chen S, Zhang L, Li W, Zhang D, Ju S, Chen M, Xu B. YY1 complex in M2 macrophage promotes prostate cancer progression by upregulating IL-6. J Immunother Cancer. 2023 Apr;11(4):e006020. doi: 10.1136/jitc-2022-006020.















