产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
帕金森病还可以这样治疗?
发布时间:2024-03-25 09:41 | 点击次数:

Prosaposin(PSAP)调节糖脂代谢,其变异与帕金森病(PD)有关。本研究中,作者发现PD患者的血浆、脑脊液(CSF)和死后大脑中PSAP水平发生变化。血浆和CSF中PSAP水平的改变与PD相关的运动损伤有关。多巴胺PSAP缺陷(cPSAPDAT)小鼠表现出运动能力低下和抑郁/焦虑样症状,多巴胺能神经传递轻度受损,而血清素PSAP缺乏(cPSAPSERT)小鼠表现正常。空间脂质组学显示,在cPSAPDAT小鼠整个大脑中,高度不饱和与变短的脂质发生积累,且鞘脂减少。与WT小鼠相比,AAV引起的α-突触核蛋白过表达导致cPSAPDAT小鼠更严重的多巴胺能衰退和更高的p-Ser129 α-突触蛋白水平。在野生型啮齿类动物中,AAV引起的PSAP过表达和包封细胞生物递送(ECB)可有效保护其免受6-OHDA和α-突触核蛋白毒性。该研究于2023年9月发表在《nature communications》,IF:16.6。
技术路线

主要研究结果
1. PD患者死后SNc 的DA神经元中PSAP减少而非PGRN
作者在人类SNc中的酪氨酸羟化酶(TH)和神经松弛素阳性神经元中检测到高水平PSAP(图1A)。检测PD患者和对照组SNc DA神经元中PSAP和PGRN的水平,其免疫荧光染色显示PSAP和PGRN共定位(图1A)。与对照组相比,PD中单个TH阳性神经元PSAP减少,而PGRN没有变化(图1A-C)。
2. 循环PSAP与PD运动症状相关,而PGRN与非运动症状相关
在PD患者和对照组CSF和血浆中测定循环PSAP和PGRN。CSF PSAP与血浆PSAP相关,PGRN没有发现这种相关性(图2D,E)。关于临床症状和体征,CSF和血浆PSAP均与UPDRS-III运动症状评分呈正相关(图1F,G)。然而,PSAP水平与BDI-II、MADR-S、HADS-D、HADS-A和MFS非运动症状评分无关(图1H,I)。相反,CSF和血浆PGRN与UPDRS-III评分不相关(图1J,K),但与上述非运动症状评分呈负相关(图1L,M),这些发现表明PSAP和PGRN在PD中受到了不同调节,且PSAP与PD基本运动特征有关。
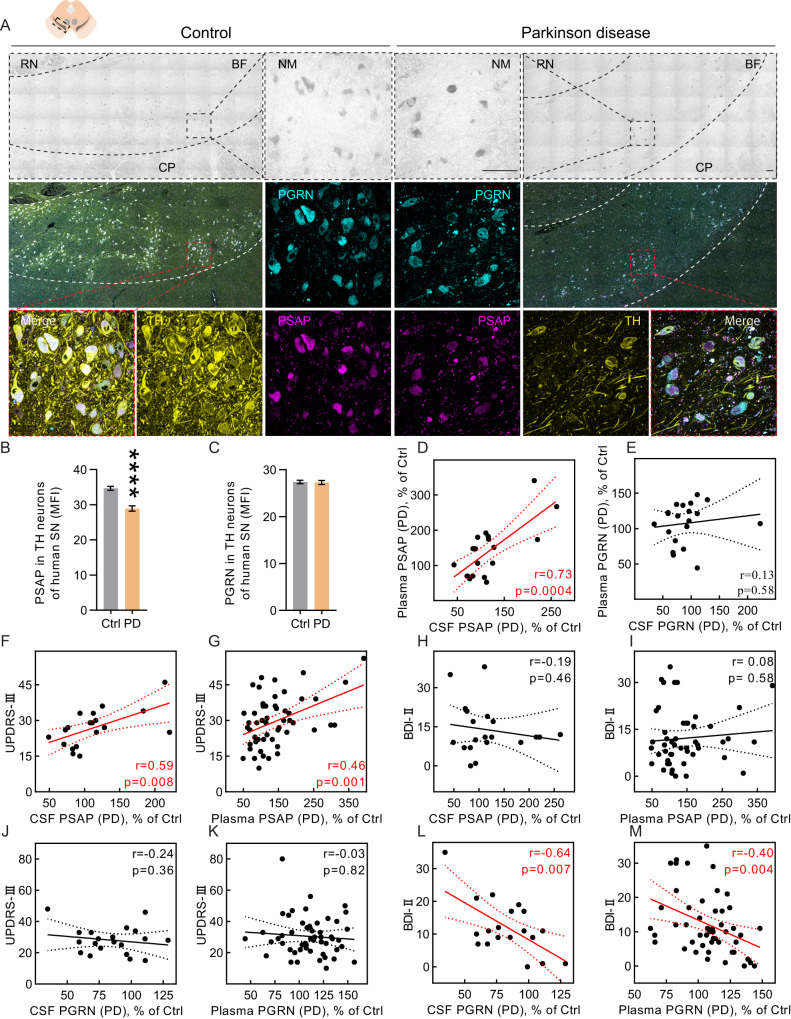
图1:PD患者PSAP和PGRN受到不同调节,并与不同PD症状相关
3. 多巴胺能PSAP缺陷小鼠表现多巴胺能标记物水平降低、纹状体突触可塑性功能障碍和行为障碍,而5-羟色胺能PSAP缺乏小鼠表现正常
为研究多巴胺能系统中的PSAP,作者产生了一种在DA神经元中具有特异性可诱导PSAP基因缺失小鼠(cPSAPDAT)。将三苯氧胺给药5周龄小鼠,通过PSAP mRNA荧光原位杂交(FISH)分析证实整个SNc中DA神经元中PSAP缺失(图2A)。高效液相色谱法(HPLC)检测神经递质变化。16月龄cPSAPDAT小鼠的纹状体、伏隔核和海马体中,DA、高香草酸(HVA)和3-甲氧基酪胺(3-MT)显著减少(图2B)。通过密度测定分析,作者注意到cPSAPDAT小鼠纹状体中存在轻度和进行性TH损失(图2C,D)。为探讨PSAP在血清素神经元中的作用。作者将具有固定PSAP等位基因的纯合子小鼠与表达Cre重组酶的杂合子小鼠杂交,产生血清素神经元中PSAP基因缺失小鼠(cPSAPSERT)。FISH证实cPSAPSERT小鼠5-羟色胺神经元中PSAP mRNA特异性缺失(图2E)。与cPSAPDAT小鼠相比,通过HPLC在cPSAPSERT小鼠海马体中未检测到5-羟色胺(5-HT)和5-羟基吲哚乙酸(5-HIAA)的变化(图2F,G)。PSAP可被细胞吸收,作者在两种小鼠系中用免疫荧光染色检测PSAP蛋白。它莫西芬处理后,2月龄cPSAPDAT小鼠DA神经元中PSAP显著减少,但随着时间的推移会发生积累(图2H,I)。PGRN遵循类似的轨迹(图2H,J)。对4月龄、8月龄和16月龄cPSAPDAT小鼠进行行为评估(图2K)。在8月龄和16月龄cPSAPDAT小鼠中观察到在open field test(OFT)中的Hypolocomotion(图2L)。4月龄cPSAPDAT小鼠在pole test中(图2M)和16月龄cPSAPDAT小鼠在beam traversal test中(图2N)发现姿势控制和精细运动损伤。cPSAPDAT小鼠焦虑增加(图2O),由OFT中心区域时间(图2O)以及light-dark test灯箱中距离和时间测量得出(图2P,Q)。8月龄cPSAPDAT小鼠在强迫游泳测试中也表现出抑郁状态(图2R)。相反,通过一系列行为测试评估8月龄cPSAPSERT小鼠,没有显示异常(图2S-W)。
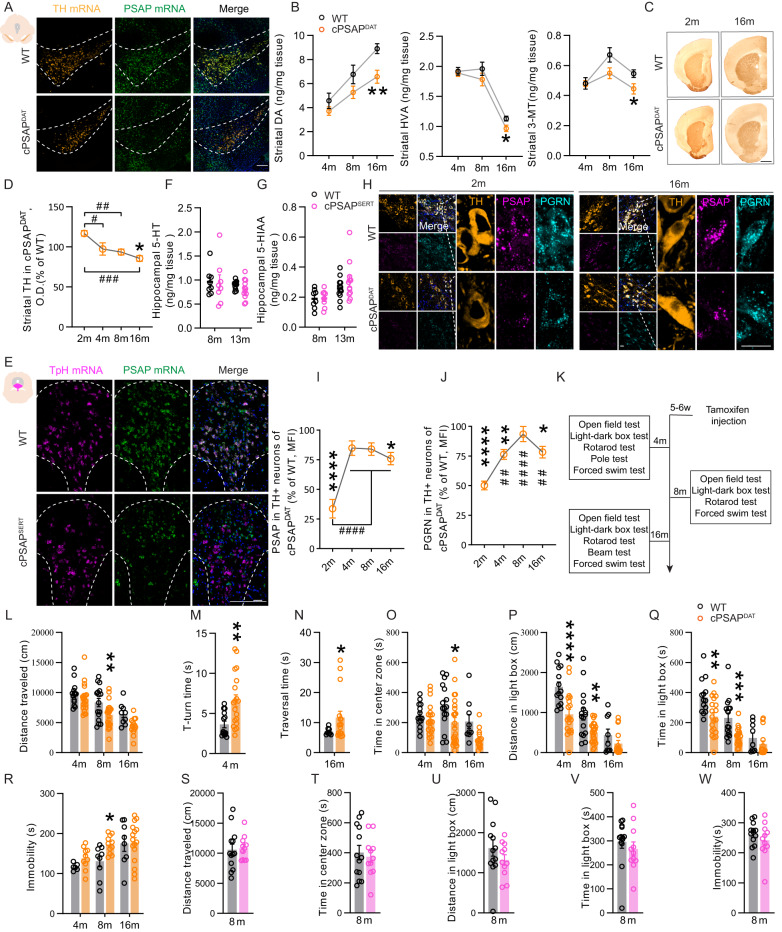
图2:cPSAPDAT小鼠表现多巴胺能标志物水平降低和行为缺陷,而cPSAPSERT小鼠表现正常
4. 空间脂质组学揭示cPSAPDAT小鼠整个大脑中高度不饱和和缩短的脂质积累以及鞘脂减少
考虑到皂苷在鞘糖脂(GSL)代谢中的重要作用,作者使用了高通量双极性MALDI-MSI方法。在cPSAPDAT和对照小鼠大脑中进行非靶向空间脂蛋白分析。他们发现,4月龄、8月龄和16月龄cPSAPDAT小鼠与其对照组之间存在显著差异,如PCA所示,如尾壳核、大脑皮层和其他几个大脑区域纹状体和SNc水平(图3A)。所有已鉴定脂质的火山图,包括甘油脂质和鞘脂,在4月龄、8月龄和16月龄cPSAPDAT小鼠大脑区域中显示出相似的改变模式(图3B)。 进一步分析16 月龄小鼠尾壳核中的甘油酯变化(图3C)。选择心磷脂(CL)和磷脂酰胆碱(PC)进行分析。通过根据CLs的双键和链长对其进行分类,在cPSAPDAT小鼠大脑中捕捉到两种模式:(i)高度不饱和CLs增加与低不饱和CL减少相一致,以及(ii)长链CLs减少与短链CLs增加相一致(图4D-G)。第一种模式表明脂肪酸过度去饱和,而第二种模式表明过氧化物酶体β-氧化过度活跃。cPSAPDAT小鼠大脑中鞘脂减少(图3H)。源自神经酰胺棕榈酸前体的棕榈酰肉碱被还原(图3I)。磷酸鞘脂,神经酰胺的磷酸化衍生物,包括神经酰胺-1-磷酸(CerP)、鞘磷脂(SM)和SM的Na+/K+加合物,也被还原(图3I)。同样,GM1、GM2和GM3(图3I)通常减少。
5. 空间脂质组学揭示了cPSAPSERT小鼠脑中缝背核神经节苷脂的有限积累和色氨酸代谢的增加
与cPSAPDAT小鼠相比,cPSAPSERT小鼠表现出明显的行为异常和神经递质改变缺乏,作者检测了脂质变化是否会显示出相应的细胞类型特异性差异。作者进行非校正多重t检验,以检查DRN中的脂质变化(图3J)。与cPSAPDAT小鼠相比,cPSAPSERT小鼠DRN中GSL普遍增加,包括GM1,GM2和GM3(图 3K, L)。色氨酸、5-HT和5-HIAL在cPSAPSERT小鼠中缝背核(DRN)中显著上调,表明色氨酸代谢增加(图3M,N)。

图3:cPSAPDAT小鼠显示高度不饱和和缩短的脂质增加以及整个大脑鞘脂减少,而cPSAPSERT小鼠表现出神经节苷脂有限积累和背侧裂核中色氨酸代谢增加
6. cPSAPDAT小鼠对α-syn诱导的多巴胺能变性表现出更高的易感性,而病毒过表达的PSAP保护小鼠免受α-syn毒性
4月龄cPSAPDAT和WT对照小鼠接受带有或不带有AAV-PSAP的AAV-α-syn或AAV-GFP的单侧立体定向鼻内注射。为评估α-syn介导的DA损失引起的纹状体DA受体敏感化,在手术后6周、10周和14周进行Apomorphine旋转试验(图4A)。对侧净旋转的重复测量(RM)双向ANOVA显示,当注射AAV-α-syn但不注射AAV-GFP时,cPSAPDAT小鼠比WT小鼠情况更加恶化(图4B)。注射AAV-PSAP补充的PSAP阻止了AAV-α-syn对cPSAPDAT小鼠旋转行为的恶化作用(图4B)。死后小鼠大脑的免疫荧光和免疫组织化学染色证实纹状体和黑质中α-syn和GFP强烈过表达(图4C,E)。免疫荧光染色显示,AAV-α-syn降低TH阳性神经元中的PSAP(图4C,D),而AAV-GFP没有。免疫组织化学染色密度分析显示,在两种基因型中,AAV-α-syn降低同侧纹状体TH,但AAV-GFP没有降低(图4E,F)。然而,与WT小鼠相比,AAV-α-syn在cPSAPDAT小鼠中引起更显著的纹状体和黑质TH损失(图4E,F)。此外,与行为数据一致的是,通过比较AAV-α-syn注射与AAV-β-syn+AAV-PSAP注射cPSAPDAT小鼠,揭示了AAV-PSAP过表达使纹状体和黑质TH显著恢复(图4E,F)。DAT不仅表现出与TH相似的恢复性变化,而且在AAV-α-syn注射的WT小鼠中通过AAV-PSAP过表达而正常化(图4E,F)。磷酸化的α-syn Ser129(p-Ser129α-syn)被认为是α-syn的病理形式。为研究PSAP是否影响α-syn过表达小鼠大脑中p-Ser129α-syn水平,作者对小鼠大脑切片中的p-Ser129 a-syn进行染色。AAV-α-syn过表达导致WT小鼠中p-Ser129α-syn轻度积累,但不能被AAV-PSAP过表达逆转(图4G)。而在cPSAPDAT小鼠大脑中,p-Ser129α-syn积累显著增加,并通过AAV-PSAP过表达逆转至与WT小鼠相似水平(图4G)。仅考虑面积大于0.64μm2的p-Ser129α-syn积累,就获得了类似结果(图4H)。
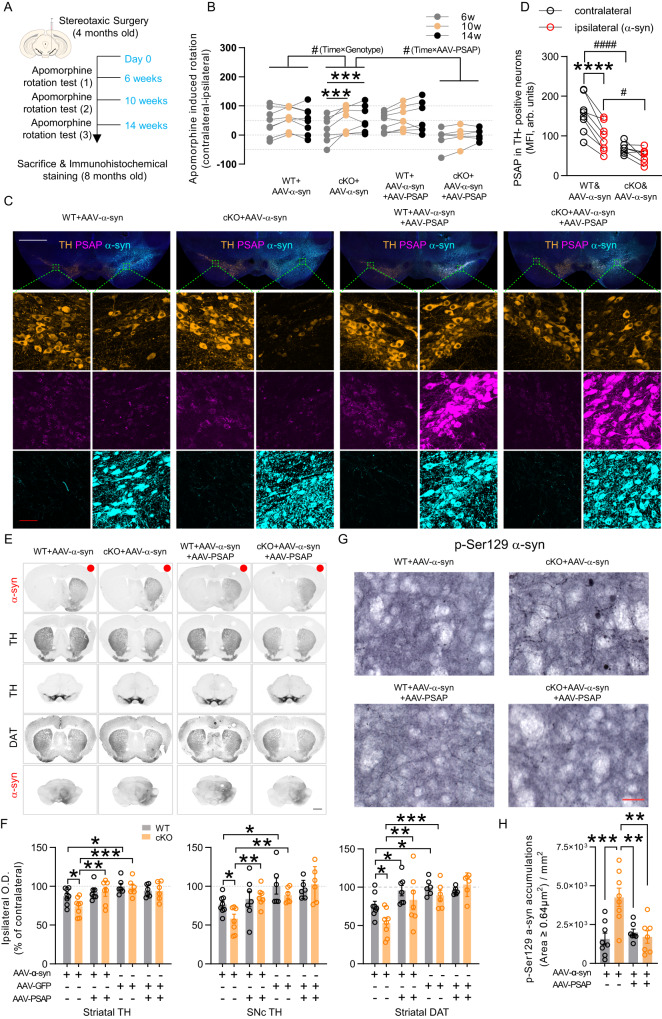
图4:cPSAPDAT小鼠更易受到AAV-α-突触核蛋白诱导的毒性,而AAV-PSAP经鼻注射可通过降低p-Ser129α-syn水平来抵消毒性
7. PSAP病毒过表达保护小鼠免受6-OHDA诱导的多巴胺能变性
PSAP已被确定为iPSC衍生的人类神经元中氧化应激的易感基因。作者研究PSAP病毒过表达是否可以保护DA神经元免受6-OHDA诱导的氧化应激。在6-OHDA纹状体部分病变前6周,WT小鼠在同侧SNc中注射AAV-PSAP或AAV-GFP,然后在病变后两周进行Apomorphine旋转试验,以监测PSAP的保护作用(图5A)。AAV-PSAP注射小鼠向对侧旋转明显小于AAV-GFP注射小鼠,表明PSAP过表达对6-OHDA病变的纹状体多巴胺支配受到保护(图5B)。免疫荧光染色证实GFP或PSAP在小鼠中的过表达,并揭示SNc中部分保存的DA神经元(图5C)。免疫组织化学染色密度测定分析显示,在AAV-GFP注射小鼠中,6-OHDA显着降低纹状体和黑质TH和纹状体DAT免疫反应性,在AAV-PSAP注射小鼠中受到部分保护(图5D,E)。
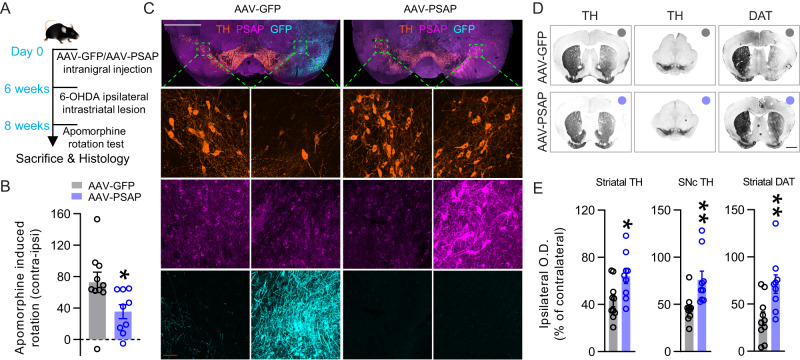
图5:PSAP病毒过表达保护小鼠免受6-OHDA诱导的多巴胺能变性
8. ECB中的PSAP在纹状体中保护大鼠免受α-syn诱导的多巴胺能损失
由于PSAP和PGRN是分泌蛋白,并且两者都被cPSAPDAT小鼠DA神经元吸收,作者推断PSAP细胞外递送可能抵消α-syn诱导的毒性。ECB提供了一种有效且可逆的方法,通过移植ECB装置将治疗剂递送到脑实质目标区域。使用这种技术,作者单方面将PSAP递送到在同一半球SNc中注射AAV-α-syn的大鼠纹状体(图6A)。在同时进行脑内 AAV-α-syn 注射和纹状体 ECB 装置植入的立体定位手术后,在第 2 周、第 8 周和第 12 周的OFT中评估运动行为,然后在第 12 周进行Apomorphine旋转测试(图 6B)。在OFT中RM双向ANOVA距离分析显示,没有装置的大鼠被AAV-α-syn诱导进行性低运动,而对照ECB或ECB-PGRN大鼠在8周时表现出低运动。相反,ECB-PSAP或ECB-PSAP-PGRN大鼠表现出完整运动(图6C,D)。时间×ECB-PSAP和时间×ECB-PSAP-PGRN的显著互作表明,PSAP和PSAP-PGRN复合物补充保护大鼠免受α-syn诱导的低运动(图6C,D)。在Apomorphine旋转试验中,与未使用装置的大鼠和ECB-PGRN大鼠相比,使用ECB-PSAP的大鼠向对侧旋转明显较少,这为PSAP对α-syn诱导运动障碍的保护作用提供进一步的证据(图6E)。死后免疫组织化学染色验证纹状体和黑质中α-syn过表达(图6F)。为检测α-syn诱导对多巴胺能标志物的影响,TH,DAT和囊泡单胺转运蛋白-2(VMAT2)进行免疫组织化学染色。根据RPE细胞分泌神经营养因子和左旋多巴,对照ECB装置和其他装置显著抵消纹状体TH的损失。然而,与没有ECB的大鼠和具有对照ECB的大鼠相比,ECB-PSAP和ECB-PSAP-PGRN装置对DAT水平也显示出保护作用(图6F,G)。此外,与没有ECB的大鼠相比,具有ECB-PSAP的大鼠显示出保守的VMAT2(图6F,H)。

图6:PSAP的ECB可防止AAV-α-突触核蛋白诱导的大鼠帕金森综合征
结论
这些实验表明,帕金森病患者PSAP水平发生改变,反映了运动症状。对DA神经元PSAP缺失的研究揭示PSAP在DA神经元生理稳态中的作用,尤其是在脂质代谢中。DA神经元中PSAP缺失增加小鼠对α-syn过表达的易感性。值得注意的是,经鼻注射AAV-PSAP可以挽救α-syn诱导的帕金森病。同样,AAV-PSAP对6-OHDA诱导的氧化应激和DA神经毒性具有保护作用。此外,纹状体ECB-PSAP植入在治疗α-syn诱导的帕金森病方面显示出治疗效果。因此,PSAP是PD发病机制的潜在调节剂,其补充可能有利于阻止PD进展。
实验方法
免疫荧光,ELISA,流式细胞术,Open field test,Light-dark transition tes,Pole test,Forced swim test,Accelerating rotarod test,Beam traversal test,Apomorphine-induced rotation,细胞培养,siRNA转染,WB,FISH,HPLC,MALDI-MSI
参考文献
He Y, Kaya I, Shariatgorji R, Lundkvist J, Wahlberg LU, Nilsson A, Mamula D, Kehr J, Zareba-Paslawska J, Biverstål H, Chergui K, Zhang X, Andren PE, Svenningsson P. Prosaposin maintains lipid homeostasis in dopamine neurons and counteracts experimental parkinsonism in rodents. Nat Commun. 2023 Sep 19;14(1):5804. doi: 10.1038/s41467-023-41539-5. PMID: 37726325; PMCID: PMC10509278.















