产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
LncRNA EILA通过稳定细胞周期蛋白E1促进乳腺癌对CDK4/6抑制剂耐药
发布时间:2024-03-21 09:04 | 点击次数:

由异常细胞周期进程驱动的不受控细胞增殖是癌症最重要的标志之一。因此,寻求药物来阻滞细胞周期和停止细胞增殖是癌症治疗的一种合理方式。细胞周期受细胞周期蛋白依赖性激酶(CDKs)及其伴侣细胞周期蛋白的精确调控。从而使S期进入和DNA复制成为可能。使用CDK4/6抑制剂(CDK4/6i)靶向CDK4和CDK6将细胞周期阻滞在G1期,并阻碍细胞增殖。三种CDK4/6抑制剂延长了晚期激素受体阳性和人表皮生长因子受体2阴性乳腺癌患者的无进展生存期和总生存期。因此,CDK4/6抑制剂联合内分泌治疗已成为这类乳腺癌的标准治疗方案。然而,对CDK4/6抑制剂的耐药不可避免,超过70%的患者在12~36个月内发生疾病进展,这带来了巨大的临床挑战。CDK4/6i耐药的主要机制包括上游致癌信号的异常激活和关键细胞周期调节因子的改变。由CCNE1基因编码的细胞周期蛋白E1激活CDK2并促进细胞周期进展。cyclin E1的高表达不仅预示着乳腺癌患者的不良预后,而且在临床前模型中还促进了对内分泌治疗和CDK4/6抑制剂的耐药。cyclin E1蛋白可能在CDK4/6i耐药中起关键作用,直接靶向cyclin E1蛋白可能是克服CDK4/6i耐药的有效途径。之前的研究发现lncRNA DILA1通过稳定cyclin D1蛋白促进乳腺癌他莫昔芬耐药,揭示了lncRNA在细胞周期调控中的作用。然而,lncRNA在CDK4/6i耐药中的作用仍不清楚。该研究发表在《Science Advances》,IF:13.6。
技术路线

主要研究结果
1. Cyclin E1失调促进乳腺癌细胞对CDK4/6抑制剂的耐药
建立CDK4/6i耐药乳腺癌细胞(MCF7-palR和T47D-palR细胞)。为了探索cyclin E1在CDK4/6i耐药细胞中的作用,研究者首先评估了其在耐药细胞及其亲本细胞中的mRNA和蛋白水平。研究者发现,在MCF7-palR和T47D-palR细胞中,cyclin E1的蛋白水平上调,而其mRNA水平保持不变(图1A)。此外,细胞周期蛋白E1蛋白在耐药细胞中比在其亲本细胞中更稳定(图1B)。这些结果表明,细胞周期蛋白E1在翻译后水平失调。为了确定细胞周期蛋白E1表达增加是否有助于CDK4/6i耐药,研究者在耐药乳腺癌细胞中使用特异性小干扰RNA(siRNA)沉默细胞周期蛋白E1,并利用甲基噻唑基二苯基四唑溴盐试验评估其对哌柏西利的敏感性。正如预期,研究者发现,细胞周期蛋白E1敲低恢复了MCF7-palR和T47D-palR细胞对哌柏西利的敏感性(图1C)。这些结果表明,细胞周期蛋白E1蛋白的失调是导致CDK4/6i抵抗的原因。
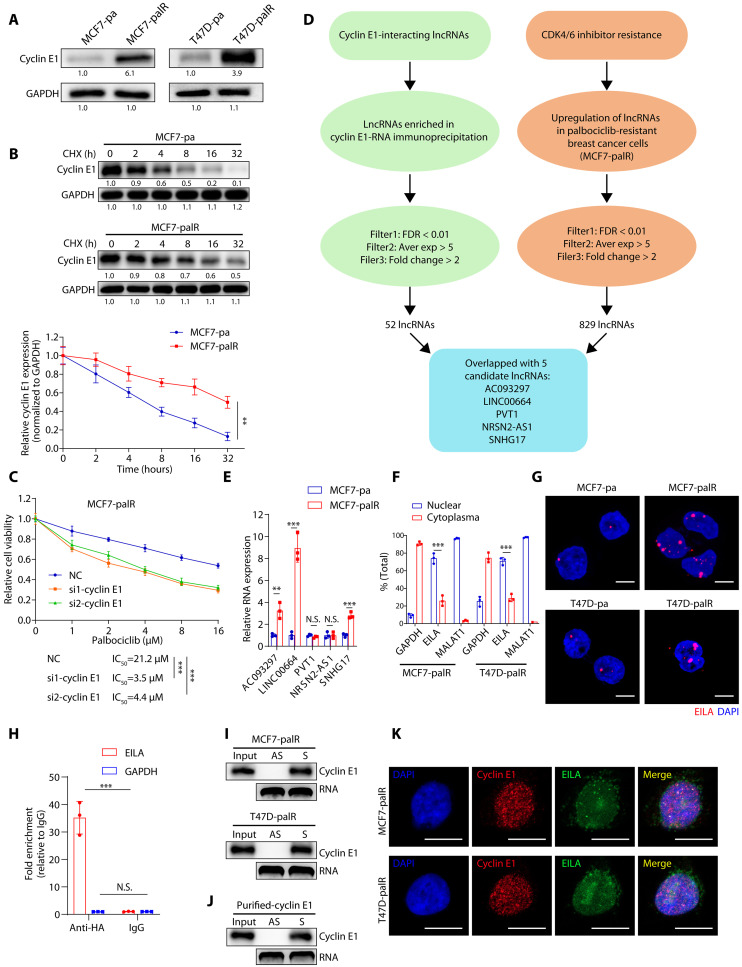
图1 CDK4/6i耐药的乳腺癌细胞表达更高水平的cyclin E1蛋白和cyclin E1相互作用的lncRNA EILA
2. EILA是与细胞周期蛋白e1相互作用的长链非编码RNA
为了鉴定可能与cyclin E1蛋白相互作用并促进CDK4/6i耐药的lncRNA,研究者进行了两个高通量lncRNA测序。用血凝素(HA)抗体进行RNA免疫沉淀(RIP)实验,将稳定表达HA标记的cyclin E1的MCF7-pa细胞中的RNA进行测序。以免疫球蛋白G作为对照,研究者鉴定了52个与细胞周期蛋白e1相互作用的lncRNA。此外,研究者从MCF7-pa和MCF7-palR细胞中提取RNA进行lncRNA测序。共鉴定出829个在MCF7-palR细胞中上调的lncRNA,这些lncRNA可能在促进CDK4/6i耐药中发挥作用。在这些lncRNA中,5个lncRNA(AC093297、LINC00664、PVT1、NRSN2-AS1和SNHG17)在两种测序中均被富集,使其成为进一步研究的候选lncRNA(图1D)。为了验证序列数据,研究者进行了实时定量反转录聚合酶链反应(qRT-PCR)检测,发现MCF7-palR细胞中AC093297、LINC00664和SNHG17的表达水平显著高于其亲本细胞(图1E)。
为了进一步研究EILA的生物学特性,研究者首先测定了其在耐药细胞及其亲本细胞中的RNA水平。然后研究者通过qRT-PCR分析细胞质和细胞核部分来探索EILA的亚细胞定位,发现它大部分位于细胞核(超过70%),少数位于细胞质(约20%)(图1F)。与这些结果一致,RNAscope原位杂交(ISH)也证实了EILA主要定位于细胞核,并且在耐药细胞中表达上调(图1G)。RIP、qRT-PCR和RNA pull-down实验以及蛋白质印迹表明,EILA可以直接与细胞周期蛋白E1相互作用(图1H,I)。这一发现被标记的重组细胞周期蛋白E1进一步验证(图1J)。此外,研究者对EILA进行了RNA荧光原位杂交(FISH)检测,随后对cyclin E1进行了免疫荧光检测,证实了它们在MCF7-palR和T47d-palR细胞核中的共定位(图1K)。总之,这些结果表明,EILA与cyclin E1在细胞核内直接相互作用,这可能在CDK4/6抑制剂耐药中起重要作用。
3. EILA参与细胞周期调控并与乳腺癌不良预后相关
为了评估EILA在乳腺癌中的临床意义,研究者分析了癌症基因组图谱乳腺浸润性癌数据库中109对配对的正常和肿瘤组织的RNA测序数据(图2A)。结果表明,EILA在肿瘤组织中的表达显著高于正常组织。此外,qRT-PCR分析了47对来自中山大学孙逸夫纪念医院的正常和肿瘤组织(SYSMH队列1,n=47),结果也显示EILA在肿瘤组织中表达上调(图2B)。这些发现被RNA ISH进一步证实,表明EILA在乳腺癌中异常表达(图2C)。为了评估EILA的预后价值,研究者分析了bc-GenExMiner v4.7数据库中的乳腺癌转录组数据。EILA高表达与较短的无病生存期(DFS)相关(图2D)。在亚组分析中,EILA高表达预示雌激素受体阳性(ER)乳腺癌患者预后较差,但在雌激素受体阴性(ER+−)乳腺癌患者中无上述情况,提示其可能作为ER乳腺癌的生物标志物(图2D)。与在线数据库的结果一致,研究者在一个独立队列(SYSMH队列2,n=215)中证实,在ER/HER2+ -乳腺癌患者中,EILA高表达与较差的临床结局相关(图2E)。单变量和多变量Cox比例风险回归分析显示,只有EILA和细胞周期蛋白E1的表达是ER/HER2+ -乳腺癌预后的独立预测因素。总之,这些结果表明EILA和cyclin E1蛋白都是预测乳腺癌预后的潜在生物标志物。
Rb是一个肿瘤抑制因子,在细胞周期从G1期到S期的转变过程中被磷酸化,而Ki67是癌细胞的增殖标记物。通过免疫组织化学染色检测磷酸化Rb(pRb)和Ki67的表达,以确定EILA是否与细胞周期进程和细胞增殖相关。研究者发现,与EILA低表达组相比,EILA高表达组肿瘤中pRb和Ki67的表达水平更高,这表明EILA过表达与细胞周期进展和细胞增殖呈正相关(图2、H和I)。在单变量和多变量Cox比例风险回归模型中,较高的EILA表达与Ki67表达显著相关,但与年龄、肿瘤大小、淋巴结转移或临床分期无显著相关。然而,未发现所分析的因素与细胞周期蛋白E1表达有显著相关性。为了进一步探索EILA在细胞周期调控中的作用,研究者分析了TCGA-BRCA数据库中乳腺癌患者的转录组数据。根据EILA表达水平将患者分为高表达组(n=554)和低表达组(n=537)。基因集富集分析结果显示,HALLMARK_E2F_TARGETS基因集和GOBP_MEIOTIC_CELL_CYCLE_PROCESS基因集在高EILA组中比在低EILA组中显著富集(图2J)。此外,对与EILA表达最正相关的500个基因进行GO分析显示,细胞周期通路正调控高度富集(图2K)。总之,这些发现表明EILA是一种预后生物标志物,并与乳腺癌细胞周期进展的正向调节相关。

图2 EILA提示乳腺癌患者预后不良
4. EILA在体外促进细胞增殖和CDK4/6抑制剂耐药
EILA是一种与细胞周期蛋白e1相互作用的lncRNA,在CDK4/6i耐药中发挥重要作用,与细胞周期进展和不良预后密切相关。在MCF7-palR和T47D-palR细胞中,EILA敲低降低了细胞增殖并恢复了对哌柏西利的敏感性(图3A,B)。此外,EdU掺入实验和流式细胞术的细胞周期分析表明,EILA敲低降低了DNA合成并导致G1-S期阻滞,并且在哌柏西利处理后,这种减少程度更大(图3C,D),衰老相关的β半乳糖苷活性测定表明,EILA敲低诱导了耐药细胞的衰老,这一过程被哌柏西利进一步增强(图3E)。总之,这些结果表明EILA对CDK4/6i耐药细胞的耐药性是必需的。
此外,研究者通过在MCF-7和T47D亲本(MCF7-pa和T47D-pa)细胞中过表达EILA进行了功能获得分析。结果表明,EILA过表达使其对哌柏西利产生耐药性(图3F,G)。此外,在哌柏西利处理存在的情况下,MCF7-pa和T47D-pa细胞中EILA的强表达增加了DNA合成,并促进了G1-S过渡(图3H,I)。异位表达的EILA还减少了哌柏西利诱导的细胞衰老(图3J)。综上所述,这些结果表明EILA能够促进乳腺癌细胞对CDK4/6i的耐药性。
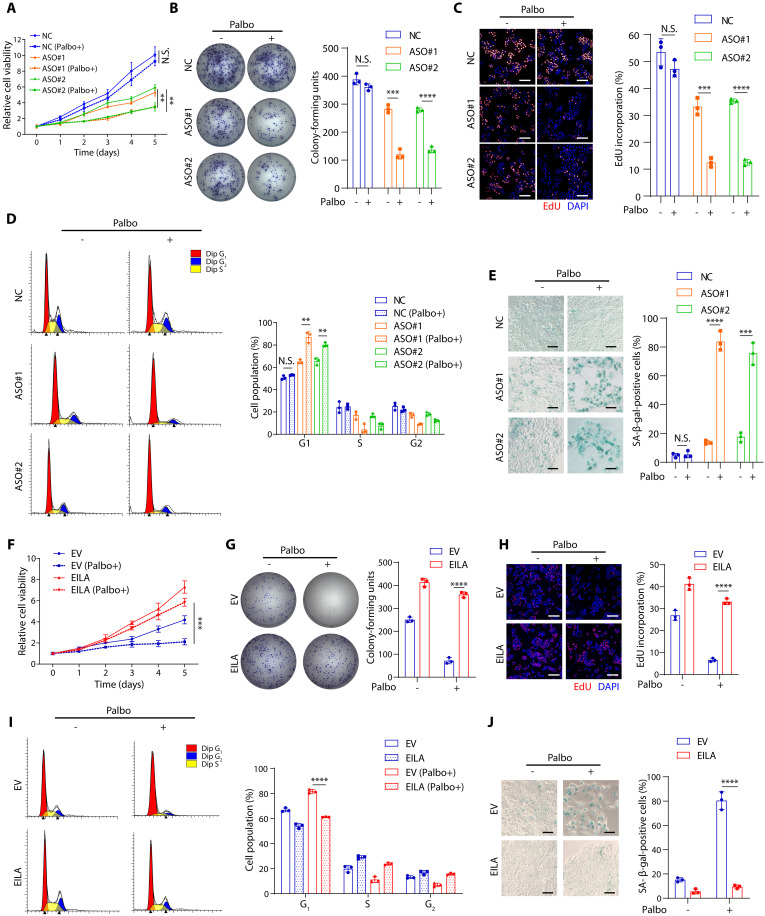
图3 EILA是CDK4/6抑制剂耐药所必需的
5. EILA的发夹A通过与其c末端结构域相互作用来稳定细胞周期蛋白E1蛋白
为了探究EILA与细胞周期蛋白E1的相互作用和调控机制,研究者在MCF7-palR和T47D-palR细胞中沉默EILA,并分别用qRT-PCR和蛋白质印迹检测细胞周期蛋白E1的表达。研究者发现,敲低EILA降低了细胞周期蛋白E1的蛋白水平,但对其mRNA水平影响不大(图4A,B)。此外,沉默EILA显著缩短了细胞周期蛋白E1的半衰期(图4C),表明敲低EILA有助于细胞周期蛋白E1的降解。另一方面,EILA的强表达上调了细胞周期蛋白E1的蛋白水平,延长了其半衰期,但不影响其mRNA水平(图4D-F)。这些结果表明,EILA通过保护细胞周期蛋白E1免受降解而上调其表达。
最近的研究表明,特定的lncRNA可能具有明确的二级结构,这些二级结构可能在它们与蛋白质的相互作用中发挥关键作用。为了确定与细胞周期蛋白E1相互作用的EILA的核苷酸序列,研究者使用一系列EILA缺失突变进行RNA pull down,然后对产物进行蛋白质印迹。结果显示,包含核苷酸1~180的EILA突变体与细胞周期蛋白E1蛋白的结合效率与全长EILA相同,而核苷酸1~180缺失的EILA突变体失去了与细胞周期蛋白E1蛋白的结合能力(图4G,H)。研究者发现,发夹A的强表达增加了细胞周期蛋白E1蛋白表达,延长了其半衰期,而不影响其mRNA水平(图4I)。这些结果表明,EILA的发夹A是必需的,并负责与细胞周期蛋白E1的相互作用来调节其稳定性。
为了确定cyclin E1与EILA的精确相互作用域,研究者构建了ha标记的全长和截短的cyclin E1过表达载体。正如RNA pull down的结果所示,只有F2截短突变体可以被生物素标记的EILA下拉,这表明C端是细胞周期蛋白E1与EILA的相互作用区域(图4J,K)。正如预期的那样,RIP-qPCR试验也显示EILA被F2截短突变体富集(图4L)。这些结果表明,EILA与细胞周期蛋白E1蛋白在其C末端相互作用。
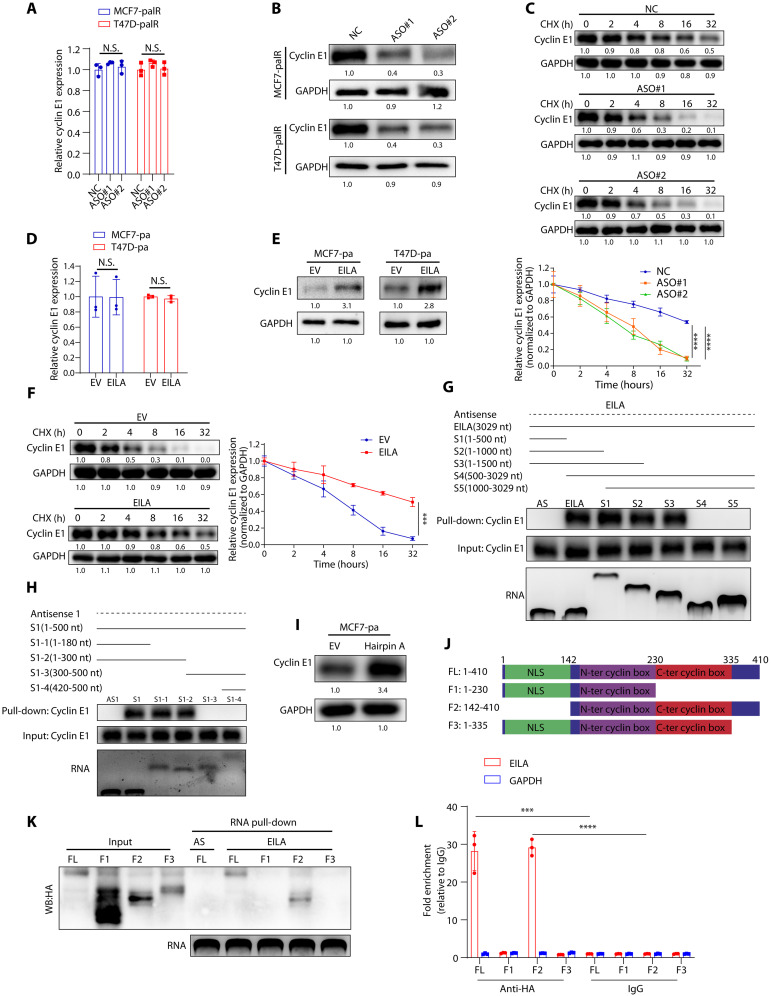
图4 EILA的发夹A通过与其c末端结构域相互作用来稳定细胞周期蛋白E1蛋白
6. EILA抑制细胞周期蛋白E1与FBXW7的结合
众所周知,cyclin E1的蛋白稳定性受到泛素化介导的蛋白酶体降解的精确控制,cyclin E1的磷酸化位点调节其泛素化。由于EILA与细胞周期蛋白E1的C端相互作用并使其稳定,因此研究者假设EILA可能影响其C端磷酸化位点和泛素化介导的降解。因此,研究者检测了耐药细胞和亲本细胞中cyclin E1的c末端磷酸化位点。研究者发现,与亲本细胞相比,耐药细胞表达的s384磷酸化的细胞周期蛋白E1水平较低(图5A)。为了排除CDK2和GSK3β对细胞周期蛋白E1磷酸化的影响,研究者在耐药细胞和亲本细胞中检测了它们的表达,并发现两种细胞表达相似的CDK2和GSK3β水平(图5A)。采用免疫共沉淀和细胞周期蛋白E1特异性抗体泛素化实验检测MCF7-pa和MCF7-palR细胞中泛素化细胞周期蛋白E1的水平。与研究者的假设一致,泛素化介导的cyclin E1降解水平在耐药细胞中降低,而不是在亲本细胞中(图5B)。这些结果表明,耐药细胞中s384磷酸化cyclin E1的减少可能抑制其泛素化介导的降解。为了确定EILA在调节s384磷酸化的细胞周期蛋白E1和泛素化介导的细胞周期蛋白E1降解中的作用,研究者使用特定的ASO沉默EILA,发现EILA敲低显著增加了s384磷酸化的细胞周期蛋白E1和泛素化的细胞周期蛋白E1的水平(图5C,D)。另一方面,EILA过表达降低了磷酸化的细胞周期蛋白E1和泛素化介导的细胞周期蛋白E1降解(图5E,F)。这些结果表明,EILA调节cyclin E1对S384的磷酸化及其泛素化,从而增加其稳定性。
为了检测FBXW7是否在CDK4/6i耐药细胞中调节细胞周期蛋白E1的稳定性,研究者检测了细胞周期蛋白E1和FBXW7之间的结合,并发现MCF7-palR细胞中与FBXW7结合的细胞周期蛋白E1少于MCF7-pa细胞(图5G)。为了确定FBXW7是否在EILA介导的细胞周期蛋白E1稳定性调节中发挥作用,研究者在MCF7-palR细胞中沉默EILA,并通过免疫共沉淀检测细胞周期蛋白E1与FBXW7的结合。研究者发现,敲低EILA使更多的细胞周期蛋白E1与FBXW7结合(图5H),这表明EILA阻碍了细胞周期蛋白E1与FBXW7之间的结合。此外,在FBXW7敲低的MCF7-palR细胞中,沉默EILA的表达并不能降低细胞周期蛋白E1的表达,这表明FBXW7参与了EILA介导的细胞周期蛋白E1稳定性的调节(图5I)。研究者进一步探索了泛素化介导的蛋白酶体降解在EILA介导的细胞周期蛋白E1稳定性调节中的作用,发现在蛋白酶体抑制剂MG-132处理的MCF7-palR细胞中,EILA敲低不能降低细胞周期蛋白E1(图5J)。总之,这些结果表明,EILA通过破坏细胞周期蛋白E1与FBXW7的结合并抑制其泛素化介导的蛋白酶体降解来稳定细胞周期蛋白E1。

图5 EILA可阻碍细胞周期蛋白E1的泛素化介导的蛋白酶体降解
7. CTCF/CDK8/TFII-I复合物调节EILA的表达
为了确定调控EILA表达的转录因子,研究者对其启动子区的不同截短突变体进行了荧光素酶报告分析。研究者发现-500~0bp(碱基对)区域对荧光素酶活性至关重要,这表明EILA的转录因子可能与该区域结合(图6A)。接下来,研究者使用JASPAR数据库预测之前未知的EILA转录因子,发现CTCF在结合评分中排名前列(图6B)。此外,CTCF敲低显著降低了EILA的表达及其荧光素酶启动子活性(图6C,D)。在CTCF转录因子的−500到0bp区域有两个预测的结合位点,分别命名为P1和P2位点。P1位点的突变,而不是P2位点的突变,显著降低了EILA的荧光素酶启动子活性,表明P1位点是CTCF的主要结合位点(图6E,F)。此外,染色质免疫沉淀(ChIP)-PCR实验也证实了EILA启动子区域含有CTCF结合位点(图6G)。这些发现得到了cisstrome数据浏览器上的ChIP测序数据的进一步证实,EILA启动子包含CTCF结合位点(图6H)。
CTCF是染色质结构和基因表达的多功能调节因子,包括转录激活和抑制。它招募并结合蛋白伴侣来调节基因表达,如TFII-I和CDK8。此外,ChIP-PCR检测也显示EILA启动子区域含有CDK8结合位点(图6I)。研究者还观察到,与亲本细胞相比,耐药细胞中TFII-I、CDK8和CTCF的相互作用更强(图6J),这表明CTCF可能与TFII-I和CDK8协同促进EILA表达。为了探索CDK8和TFII-I在调节EILA表达中的作用,研究者在耐药细胞中沉默了CDK8和TFII-I,并发现CDK8和TFII-I的敲低显著降低了EILA的表达(图6K)。为了确定CDK8和TFII-1是否在CDK4/6i耐药中发挥作用,研究者评估了CDK8和TFII-1敲低后的哌柏西利敏感性,发现CDK8和TFII-I敲低均恢复了耐药细胞对CDK4/6i的敏感性(图6L,M)。这些结果表明,CTCF/CDK8/TFII-I复合物通过与EILA启动子区结合来调节其表达,并维持对CDK4/6抑制剂的耐药性。在CDK4/6抑制剂治疗后,通过CDK8抑制剂靶向EILA表达可能是一种有前景的策略。
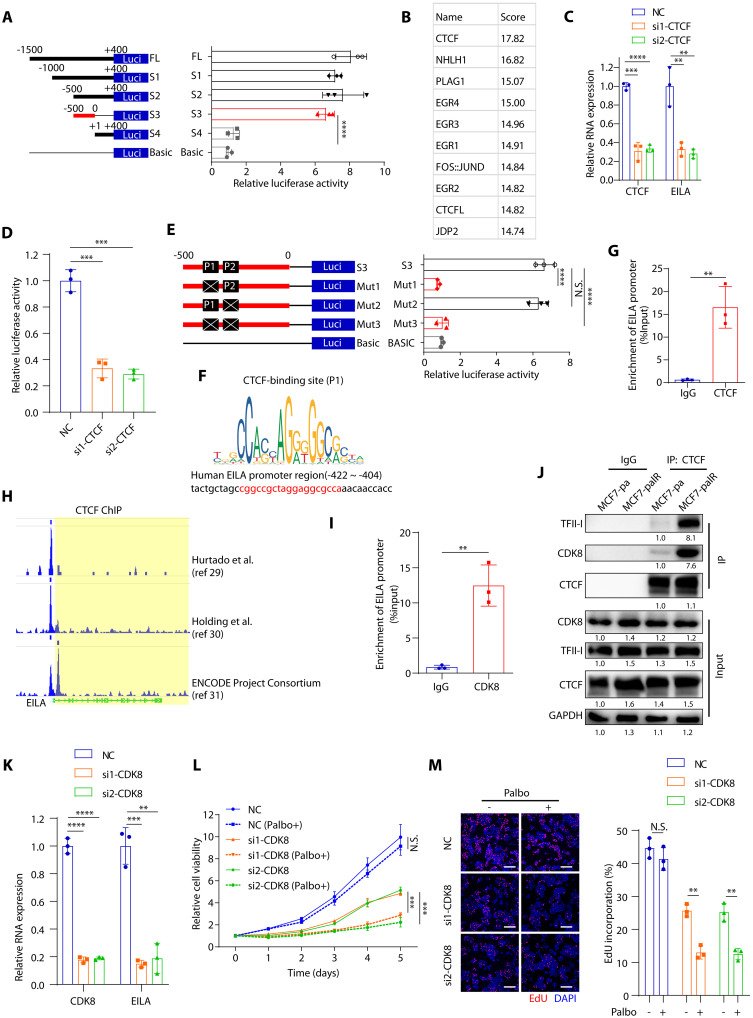
图6 EILA的表达受CTCF/CDK8/TFII-I复合物的调节
8. EILA促进体内CDK4/6抑制剂耐药
为了进一步确定EILA是否在体内促进乳腺癌细胞对CDK4/6i的耐药性,研究者将MCF7-palR细胞接种到非肥胖糖尿病/重度联合免疫缺陷小鼠的乳腺脂肪垫中。在肿瘤可触及后,将其随机分为6组,分别给予对照溶液、哌柏西利、HLA特异性ASO、对照ASO及其联合治疗。与之前的体外研究结果一致,EILA特异性ASO显著抑制了肿瘤生长,而哌柏西利和EILA特异性ASO的组合进一步缩小了肿瘤(图7A,B),表明EILA特异性ASO使耐药肿瘤对CDK4/6抑制剂重新敏感。此外,哌柏西利和EILA特异性ASO的组合对小鼠体重的影响很小(图7C),这表明这些组合是可耐受的。
EILA特异性ASO显著降低了EILA的表达和细胞周期蛋白E1的蛋白水平(图7D,E)。此外,EILA敲低也显著降低了Ki67和pRb的表达,palbociclib和EILA特异性ASO的组合更大程度地降低了它们的表达(图7D,E)。总之,这些结果表明,用特异性ASO靶向EILA的表达在体内克服了CDK4/6i的耐药性。
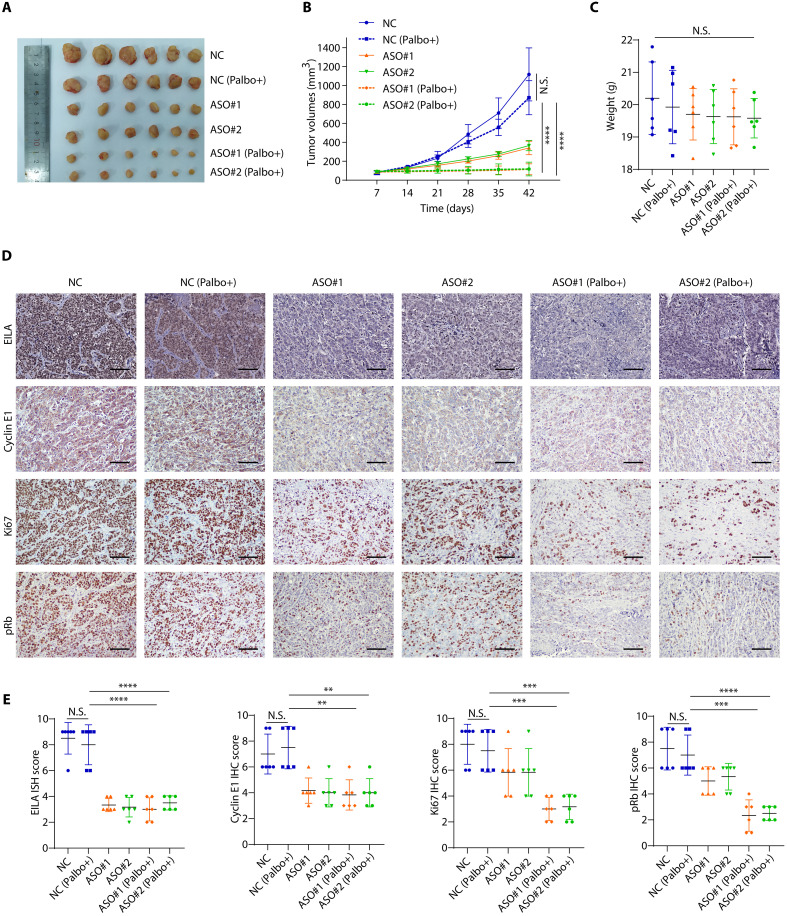
图7 EILA促进体内CDK4/6抑制剂耐药
9. EILA可预测对CDK4/6抑制剂的应答,并且在CDK4/6抑制剂进展后上调
为了进一步证明EILA在CDK4/6i耐药中的临床意义,研究者检测了37例接受CDK4/6抑制剂治疗的ER晚期乳腺癌患者中EILA的表达。根据EILA的ISH评分将患者分为高EILA组和低EILA组。Kaplan-Meier曲线分析显示,EILA高表达预测这些患者的PFS缩短(图8A)。同样,cyclin E1蛋白高表达也与这些患者的不良临床结局相关(图8B)。此外,在治疗前和CDK4/6抑制剂治疗进展后,对这些患者进行了7对活检。对这些配对活检进行的分析表明,耐药肿瘤的EILA表达水平高于naïve肿瘤,细胞周期蛋白E1蛋白上调(图8C,D)。这些结果表明,EILA表达与CDK4/6抑制剂应答相关,并且在进展后上调,这可能是CDK4/6i耐药的生物标志物,并可作为克服耐药的治疗靶点。

图8 EILA预测对CDK4/6i治疗反应差,并且在CDK4/6i耐药的乳腺癌中上调
结论
综上所述,该研究表明在E1相互作用的lncRNA EILA中,cyclin-交互lncRNA EILA在调节环蛋白E1稳定性和保持对CDK4/6抑制剂的抗性方面起着重要的作用。EILA是CDK4/6i治疗的一个预测生物标志物,也是CDK4/6i进展后的潜在治疗目标。
实验方法
RNA免疫沉淀,RIP测序,lncRNA测序,RNA ISH,IHC,RNA FISH,免疫荧光,RNA scope,蛋白质印迹,免疫共沉淀,泛素化测定,实时荧光定量PCR,染色质免疫沉淀,RNA pull-down,荧光素酶报告基因检测,小鼠肿瘤异种移植物形成,EILA,菌落形成测定,EdU掺入实验,细胞周期流式细胞术
参考文献
Cai Z, Shi Q, Li Y, Jin L, Li S, Wong LL, Wang J, Jiang X, Zhu M, Lin J, Wang Q, Yang W, Liu Y, Zhang J, Gong C, Yao H, Yao Y, Liu Q. LncRNA EILA promotes CDK4/6 inhibitor resistance in breast cancer by stabilizing cyclin E1 protein. Sci Adv. 2023 Oct 6;9(40):eadi3821. doi: 10.1126/sciadv.adi3821.















