产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
乳酸化修饰介导饮食限制的长寿秘诀
发布时间:2024-03-15 08:42 | 点击次数:
众所周知,饮食限制(DR)能促进自噬,从而发挥其长寿效应。虽然SAMS-1(S-腺苷蛋氨酸合成酶-1)已被证明是DR反应的关键介质,但人们对S-腺苷蛋氨酸(SAM)和 SAM 依赖性甲基转移酶在自噬和 DR 诱导的长寿中的作用知之甚少。在这项研究中,我们发现 DR 和 SAMS-1 通过限制 SAM 的供应,抑制了组蛋白 H3K4 甲基转移酶 SET-2 的活性。因此,降低的 H3K4me3 水平促进了两种转录因子 HLH-30/TFEB 和 PHA-4/FOXA 的表达和活性,这两种转录因子都能调节自噬相关基因的转录。然后我们发现,HLH-30/TFEB 和 PHA-4/FOXA 在它们共同的靶基因上协同作用,介导了自噬相关基因的转录反应,从而延长了动物的寿命。因此,我们的研究表明,SAMS-1-SET-2轴是一个营养传感模块,可从表观遗传学角度协调HLH-30/TFEB和PHA-4/FOXA转录因子的激活,从而控制大自噬/自噬和对DR的长寿反应。
本文于2023年1月发表在《Autophagy》IF: 13.3期刊上。
技术路线

实验结果
1、自噬激活是sams-1突变体长寿的必要条件
为了解sams-1是否控制自噬以调节衰老速度,首先使用表达GFP标记的LGG-1,Atg8/LC3的同源物,来监测自噬。作者发现,在sams-1(ok2946)突变体的不同组织中,GFP::LGG-1自噬小体的数量都有所增加,包括下胚层接缝细胞、肌肉细胞、咽球和肠细胞(图1A)。还发现与对照组相比,sams-1 RNAi显著增加了自噬通量(图1B)。接下来探究自噬相关基因是否是sams-1突变体长寿的必要条件。结果发现,一些自噬相关基因,如bec-1、vps-34或lgg-1/lgg-2/Atg8的敲除抑制了sams-1(ok2946)突变体的寿命(图1c)。总之,这些结果表明,sams-1失活可刺激自噬,从而促进长寿。
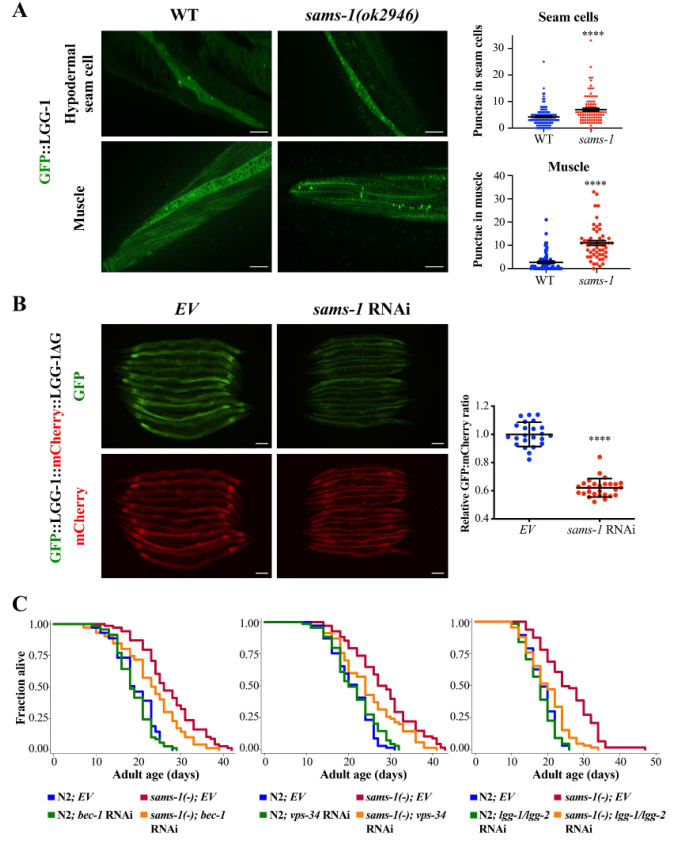
图1自噬激活是sams-1突变体长寿的必要条件
2、HLH-30/TFEB和PHA-4/FOXA介导sams-1突变体的自噬和寿命
通过文献发现HLH-30/TFEB和PHA-4/FOXA与自噬相关。本文发现当sams-1基因敲除时,HLH-30和PHA-4的蛋白和mRNA表达均上调(图2a-c),表明sams-1 可能调控hlh-30和pha-4的转录。此外,通过测量HLH-30的核与细胞质比率,发现在sams-1基因敲除突变体中,HLH-30的核易位增强(图2d)。与此相一致的是,在sams-1(ok2946)突变体中,一些自噬相关基因,包括lgg-1、lgg-2、sqst-1/p62、atg-4.1、atg-11、epg-3、epg-5、allo-1和vps-34的表达水平都有所增加(图2c)。
此外,作者发现,SAM补充显著废除了HLH-30的核易位(图2D)。为研究在sams-1突变体中观察到的自噬活性和寿命的增加是否需要HLH-30或PHA-4的活性,首先评估hlh-30或pha-4 RNAi对自噬活性的影响。发现hlh-30或pha-4的敲除显著抑制sams-1(ok2946)突变体自噬通量的增加,其次也抑制了eat-2(-)DR动物自噬通量的增加(图2e、f)。敲除hlh-30或pha-4完全抑制了sams-1(ok2946)突变体寿命的延长(图2g,h),表明HLH-30或PHA-4的活性对sams-1(ok2946)突变体寿命的延长至关重要。综上所述,sams-1可能调节HLH-30和PHA-4的表达和活性,从而介导自噬和寿命。
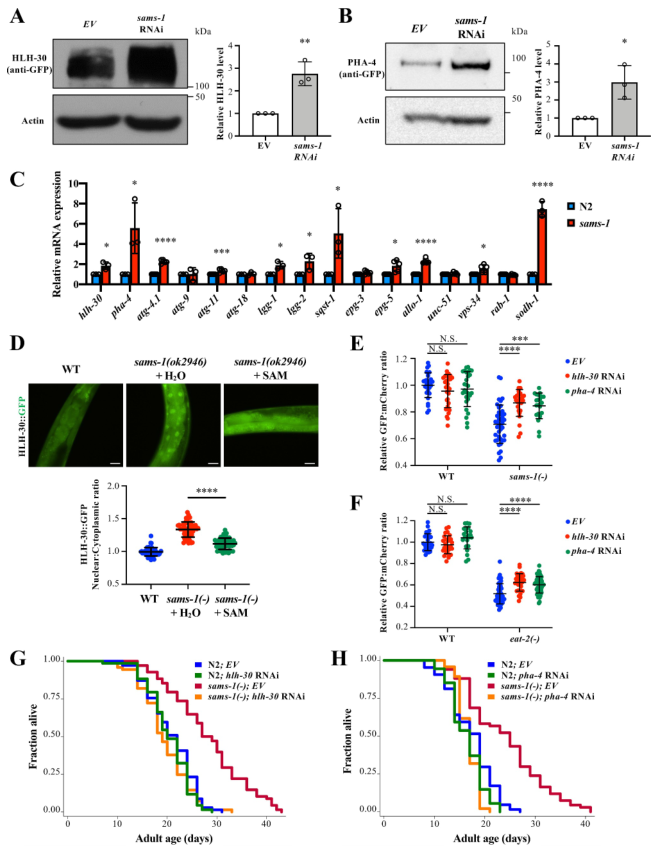
图2 HLH-30/TFEB和PHA-4/FOXA介导sams-1突变体的自噬和寿命
3、SET-2是一种H3K4甲基转移酶,通过HLH-30/TFEB和PHA-4/FOXA调节自噬
由于补充SAM可完全消除sams-1突变体中的HLH-30核易位表型,作者推测SAMS-1的下游有一个或多个甲基转移酶在调节HLH-30的活性。因此,以HLH-30核易位为读数,进行了小规模的蛋白质甲基转移酶RNAi筛选。set-2的无效突变也显著增加了HLH-30的核易位(图3a)。值得注意的是,在sams-1(ok2946)无效突变体中,HLH-30核质比高于set-2(bn129)无效突变体(图3a),这表明在sams-1突变体中HLH-30核易位的诱导作用强于set-2突变体。因此,其他基因也可能在sams-1的下游发挥作用,与set-2平行调节HLH-30的核易位。
与sams-1基因缺失类似,set-2 基因缺失也增加HLH-30和PHA-4的mRNA和蛋白表达(图3b-d)。此外,发现在set-2(ok952)突变体的下胚层缝细胞、肌肉细胞、咽球和肠细胞中,GFP::LGG-1点的数量增加,这表明set-2(ok952)突变体的自噬活性增强(图3e)。在表达gfp::lgg-1::mcherry::lgg-1ΔG的set-2(bn129)突变体中,GFP:mCherry信号比降低,这也表明自噬通量增加(图3f)。此外,作者发现自噬通量的增加需要HLH-30和PHA-4的活性(图3g)。总之,这些结果表明SET-2通过HLH-30/TFEB和PHA-4/FOXA调节自噬。

图3 SET-2是一种H3K4甲基转移酶,通过HLH-30/TFEB和PHA-4/FOXA调节自噬
4、SET-2在DR通路中起作用,需要自噬相关基因来促进寿命
为进一步了解SET-2在DR诱导的长寿中的作用,作者进行了各种遗传显性分析,以探究set-2与sams-1和DR在寿命调控中的遗传关系。首先创建了set-2过表达株系,提高了全局H3K4me3水平,改善了set-2(bn129)突变体的长寿表型,结果发现,set-2过表达能改善sams-1突变体的寿命表型(图4a),这表明set-2在寿命调控中作用于sams-1的下游。过表达set-2会缩短eat-2(ad1116)突变体的寿命(图4b)。总之set-2在调控DR诱导的长寿过程中作用于sams-1 的下游。
接着询问自噬相关转录因子和基因是否也是延长set-2突变体寿命所必需的,正如在sams-1突变体(图1c,图2g,h)和eat-2突变体中所观察到的那样。敲除转录因子hlh-30或pha-4(图4c、d)或自噬相关基因bec-1、vps-34或lgg-1/lgg-2完全抑制了set-2(ok952)突变体寿命的延长(图4e、f)。综上所述,SET-2甲基转移酶活性降低会激活HLH-30和PHA-4,从而介导DR诱导的长寿。

图4 SET-2在DR通路中起作用,需要自噬相关基因来促进寿命
5、AMX-1 H3K4去甲基化酶在调控HLH-30/TFEB中拮抗SET-2
接下来研究amx-1耗竭对SAMS-1/SET-2介导的HLH-30活化的影响。结果发现,amx-1 RNAi抑制了sams-1 RNAi诱导的HLH-30核易位(图5a)。amx-1 RNAi还抑制了eat-2(ad1116)和set-2(bn129)动物的HLH-30核易位(图5b)。amx-1的RNAi敲除也降低了eat-2和set-2突变体中hlh-30的mRNA和蛋白表达(图5c)。此外,amx-1 RNAi抑制了sams-1 RNAi诱导的自噬通量激活,这表明amx-1调控自噬激活(图5d)。通过遗传显性分析,发现敲除amx-1能显著缩短sams-1(ok2946)、set-2(ok952)和eat-2(ad1116)突变体的寿命(图5e-g)。综上所述,amx-1能拮抗set-2对自噬和寿命的调控作用。
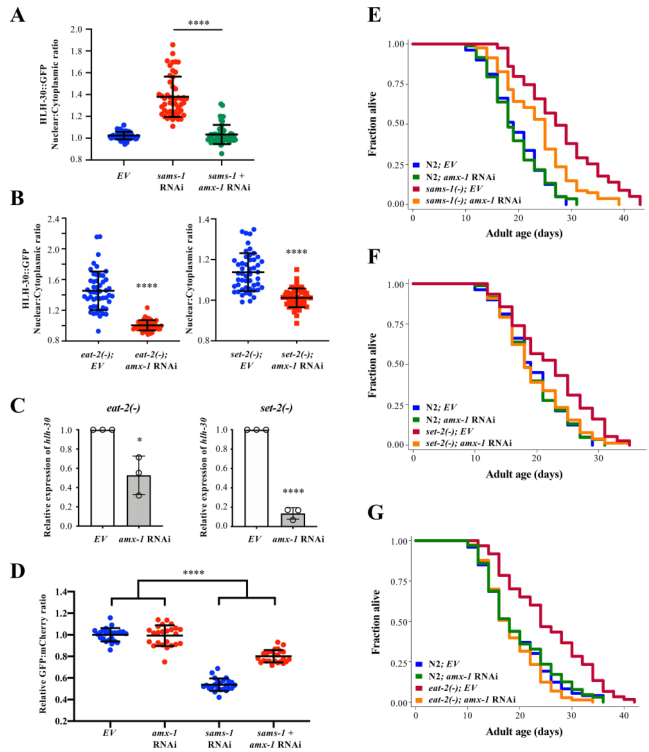
图5 AMX-1 H3K4去甲基化酶在调控HLH-30/TFEB中拮抗SET-2
6、SET-2和AMX-1调节H3K4me3水平,控制HLH-30/TFEB和PHA-4/FOXA的表达
由于SET-2和AMX-1控制组蛋白H3K4三甲基化的动态变化,因此假设HLH-30和PHA-4的表达受hlh-30和pha-4启动子区H3K4三甲基化状态的转录调控。结果发现,在sams-1(ok2946)和eat-2(ad1116)突变体中,全局H3K4me3水平明显下降(图6a)。
然后,通过染色质免疫沉淀(ChIP)实验研究set-2和sams-1突变体中hlh-30启动子的H3K4me3水平。发现,在set-2(bn129)和sams-1(ok2946)突变体中,hlh-30启动子的H3K4me3水平显著降低(图6b)。HLH-30与自身启动子结合的增加表明启动子活性增加。在sams-1(ok2946)和set-2(bn129)突变体中,HLH-30在其启动子上的招募都有所增加(图6c)。因此,在sams-1和set-2突变体中,低H3K4me3水平和HLH-30与hlh-30启动子结合的增加可能与这些动物中hlh-30转录的诱导相对应。
DR增加pha-4的表达,但这种诱导的基本机制完全未知。作者假设,与hlh-30相似,pha-4的表达也受H3K4me3水平变化的控制。在这里,作者发现与WT N2相比,sams-1(ok2946)和set-2(bn129)突变体中pha-4启动子的H3K4me3 水平也有所下降(图6d),这表明饥饿过程中hlh-30和pha-4的诱导都是组蛋白标记变化的结果。同样,在amx-1突变体中,hlh-30和pha-4启动子的H3K4me3水平也有所增加(图6e,f)。综上所述,DR可能通过SAMS-1和SET-2调节H3K4me3的动态,从而控制hlh-30和pha-4的表达,进而控制自噬和寿命。

图6 SET-2和AMX-1调节H3K4me3水平,控制HLH-30/TFEB和PHA-4/FOXA的表达
7、HLH-30/TFEB和PHA-4/FOXA协同调节自噬和寿命
作者猜测HLH-30和PHA-4也可能共同占据自噬相关基因的启动子,并对其转录进行核心调节。为验证这一假设,分析了modENCODE项目(ftp://data.modencode.org/)中的HLH-30和PHA-4 ChIP测序数据集。对结合位点分布的分析表明,HLH-30和PHA-4结合位点富集在转录起始位点(TSS)上游约50 bp的范围内(图7a)。51%的HLH-30结合位点与PHA-4结合位点重叠,而38%的PHA-4结合位点与HLH-30结合位点重叠(图7b)。有886个基因的启动子区域同时包含HLH-30和PHA-4结合位点(图7b)。值得注意的是,这些数据集来自喂养的蠕虫,表明在非刺激条件下,这两种转录因子与共同靶基因的结合存在基础水平。
然后,比较HLH-30和PHA-4的峰值中心之间的距离。距离分布显示,它们的峰值中心之间的距离大多为~100 bp,表明这两个转录因子在基因组上的存在位置很近(图7c)。这些数据表明,这两个转录因子可能共同占据了相同的启动子区域,或者至少结合到了附近的位点,从而合作调控它们共同靶标的转录。
然后,进行GO富集分析,以确定这886个共同靶基因的功能注释。发现"自噬"和"衰老"在其中占了很大比例(图7d)。与ChIP-seq分析一致,在非刺激条件下,HLH-30和PHA-4都与lgg-1启动子结合(图7e,f)。在sams-1(ok2946)和set-2(bn129)突变体中,这两种转录因子在lgg-1启动子上的结合都有所增加,这可能导致了lgg-1的转录诱导。
有趣的是,作者发现HLH-30在lgg-1和sodh-1启动子区域的结合不受RNAi 敲除pha-4的影响,而PHA-4在lgg-1和sodh-1启动子区域的结合也不受RNAi 敲除hlh-30的影响(图7g,h)。因此,综合来看,HLH-30和PHA-4可能独立地结合到它们共同靶标启动子区域的相邻位点,而不是共同占据相同的位点,从而协同控制它们的转录。

图7 HLH-30/TFEB和PHA-4/FOXA协同调节自噬和寿命
总而言之,本文揭示,通过SAMS-1/SET-2轴、H3K4甲基化和HLH-30/PHA-4模块协同调节自噬相关基因的表达,提出饮食限制介导的长寿模型。在自由饮食条件下,SAMS-1合成SAM,SAM是SET-2进行组蛋白H3K4甲基化的底物。hlh-30和pha-4的基础转录水平提供了基础的自噬相关基因的转录。在DR条件下,sams-1水平降低,因此SET-2催化的H3K4甲基化所需的SAM减少。AMX-1的活性超过了SET-2的活性。因此,H3K4me3在hlh-30和pha-4启动子上的低甲基化增强了它们的转录,这反过来又导致自噬相关基因的转录增加,从而激活自噬并延长寿命。

图8通过SAM依赖性甲基化实现自噬和长寿的模型。
实验方法
C. elegans strains的培养,转基因细胞系的构建,寿命分析实验,核定位实验,GFP::LGG-1荧光标记自噬,WB,RT-qPCR,ChIP
参考文献
Lim CY, Lin HT, Kumsta C, Lu TC, Wang FY, Kang YH, Hansen M, Ching TT, Hsu AL. SAMS-1 coordinates HLH-30/TFEB and PHA-4/FOXA activities through histone methylation to mediate dietary restriction-induced autophagy and longevity. Autophagy. 2023 Jan;19(1):224-240. doi: 10.1080/15548627.2022.2068267. Epub 2022 May 3. PMID: 35503435; PMCID: PMC9809948.















