产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
组织因子是放射治疗诱导的胶质母细胞瘤重塑的关键调节因子
发布时间:2024-03-05 08:54 | 点击次数:

胶质母细胞瘤(GBM)是最致命的脑癌,尚无有效的治疗方法。目前,手术切除后放射治疗(RT)和替莫唑胺化疗是新诊断的GBM患者的标准疗法。RT对GBM具有细胞抑制和细胞毒性的抗肿瘤作用,但肿瘤复发几乎不可避免。在放疗后,GBM肿瘤通过表观遗传和转录组景观的全局重塑经历表型转变。RT增强肿瘤细胞分泌各种趋化因子、细胞因子和细胞外基质分子。已知许多RT诱导的化学/细胞因子可诱导GBM细胞状态转变并介导GBM细胞与免疫细胞之间的相互串扰。此外,RT是凝血功能障碍和免疫调节的有效诱导剂。虽然上述RT诱导的全局变化长期以来一直被假设为肿瘤进化和复发肿瘤的侵袭性,但这些过程的上游启动者知之甚少。在许多恶性肿瘤如GBM中,照射和靶向抑制剂可瞬间诱导肿瘤细胞衰老,称为治疗诱导衰老(TIS)。由于衰老程序涉及全局表观基因组重编程和多种蛋白质分泌的升高,称为衰老相关分泌表型(SASP),TIS可能在RT诱导的全局变化中发挥作用。肿瘤细胞衰老的定义仍然不明确,关键问题尚未解决,包括衰老的肿瘤细胞状态是如何调节的,以及TIS如何影响治疗耐药性和肿瘤复发。该研究发表在《Cancer Cell》,IF:38.585。
技术路线

机制图

主要研究结果
1. 照射诱导的SA-βGal+ GBM细胞具有干性和衰老样特征
为了确定GBM肿瘤的衰老程度,研究者使用了三种不同的原位患者来源的GBM模型(图1A)。照射荷瘤小鼠的大脑,用比色底物X-Gal或细胞透性荧光底物C12FDG20测量SA-βGal的活性(图1A)。照射诱导了强烈的SA-βGal活性,特别是在肿瘤区域(图1A)。为了确定SA-βGal+细胞的细胞类型,研究者植入红色荧光蛋白(RFP)转导的GBM肿瘤,在体内照射小鼠,并用C12FDG染色(图1B)。流式细胞术分析显示,照射脑中超过90%的SA-βGal+细胞RFP阳性,表明主要是GBM细胞获得了RT诱导的SA-βGal活性(图1B)。
为了研究照射后SA-βgal + GBM细胞的细胞状态,研究者通过C12FDG染色和随后的荧光激活细胞分选(FACS)分离SA-βgal +和SA-βgal-GBM亚群。DNA损伤修复活性和克隆生长能力是GBM放射抗性和随后复发的关键照射后的C12FDG+细胞(RT-C12FDG+)显示,与匹配的C12FDGlow/-或模拟分选的散装肿瘤细胞相比,失调性毛细血管扩张突变和DNA检查点激酶的活性增强(图1C)。此外,RT-C12FDG+细胞表达巢蛋白,并且通过体外集落形成分析发现,克隆生成细胞高度富集(图1D,E)。接下来,研究者确定了有或没有照射的GBM肿瘤中代表性衰老标志物的水平。RT-C12FDG+细胞具有高水平的HP1γ和H3K9me3,但很少或不表达CDKN2A(图1F-I)。值得注意的是,RT增加了同时表达nestin和H3K9me3的GBM细胞的数量,并在RT-C12FDG +细胞中进一步富集(图1G)。
为了检测SA-βGal+ GBM细胞的全局转录组,研究者进行了scRNA-seq和大量RNA测序分析。研究者分析了大约100,000个单个GBM细胞,并根据干细胞的表达水平和细胞周期进展对这些细胞进行了分类。未处理和照射的GBM细胞都含有高表达细胞周期和/或干性基因特征的细胞群,反映了它们的侵袭性。值得注意的是,RT-C12FDG+亚群拥有大多数在干性基因特征上得分最高的单细胞(图1H,I)。
为了正式测试RT-SA-βGal+ GBM细胞是否可以克隆扩增并促进RT后肿瘤生长,研究者使用慢病毒介导的条形码/RFP转导技术对GBM细胞进行标记。研究者从照射标记的GBM肿瘤中分离出C12FDG+细胞,并立即将这些细胞注射到新受体小鼠的大脑中(图1J-M)。RT- C12FDG+ GBM细胞在新受体小鼠中产生的肿瘤明显大于未照射或照射的大块肿瘤细胞(图1K)。通过条形码测序进行克隆扩增分析显示,与未处理或散装细胞相比,RT-C12FDG+ GBM细胞衍生的肿瘤中检测到更多的单个条形码(图1L)。这一趋势很好地证实了目前癌症治疗后克隆多样性的概念。最后,研究者使用上述细胞群进行了体内限制稀释肿瘤形成试验。来自两种不同患者GBM的RT-C12FDG+细胞比RT-bulk或C12FDG−细胞含有更高的肿瘤形成细胞频率(图1M)。总的来说,这些数据表明,照射诱导的SA-βGal+ GBM细胞具有干性和一些衰老样特征,并且它们是促进放射治疗后肿瘤生长的细胞群。

图1 辐射诱导的SA-βGal+ GBM细胞在体内克隆扩增
2. F3在照射后的C12FDG+ GBM细胞中高表达,与干细胞、细胞状态转变和分泌表型增强有关
为了研究SA-βGal+ GBM细胞的细胞状态和分子调节因子,研究者分析了细胞表面蛋白的水平。用C12FDG染色匹配的初始和照射的GBM细胞,分成单独的孔,并与242个人类分化(CD)抗体簇中的每一个共染色(图2A)。流式细胞术定量共染色结果,计算各CD标记物的表达水平。RT-C12FDG+细胞中富集的细胞表面受体包括ABCG2、JAMA、PDGFR、CD109和整合素蛋白,与干细胞性、GBM间质转化和治疗耐药性有关(图2B)。在研究者的筛选中,最富集的CD标记物是CD142,最初被认为是一种启动血液凝固的细胞表面受体与匹配的初始细胞相比,照射细胞中的组织因子/F3水平增加了10倍以上,RT-C12FDG+细胞中的组织因子/F3水平进一步增加(图2B)。在受照射的患者来源的异种移植瘤(PDX)荷瘤小鼠中,研究者发现F3具有强大的诱导作用,与C12FDG+肿瘤细胞共定位(图2C)。
为了检验照射后的F3high细胞是否富集体内致瘤能力,研究者在体内照射5天后,通过F3抗体细胞分选从PDX肿瘤中分离出匹配的F3high和F3low/-细胞,然后将这些细胞注射到免疫缺陷小鼠体内。与匹配的F3low/-或模拟分选的散装肿瘤细胞相比,照射后的F3high亚群的肿瘤形成能力明显更高(图2D,E)。
为了深入了解与F3相关的信号节点,研究者进行了ATAC-seq分析,以绘制匹配F3high和F3low/-亚群中具有开放染色质结构的基因组区域。RT-F3+ GBM细胞中最富集的转录因子结合基序是STAT3、FOSL2、RELA以及Foxo4和TEAD2,其中大多数也在RT-C12FDG+ GBM细胞中富集(图2F)。RT后,GBM肿瘤向MES亚型表型转变,这是由NF-κB和STAT3信号激活介导的。然后,研究者通过免疫印迹、免疫染色和转录组分析来确定这些通路的激活状态(图2G-L)。与ATAC数据一致,照射的F3high GBM细胞活性NF-κB和STAT3以及干细胞相关蛋白的水平升高(图2G,H)。通过使用抗F3抗体和240个人类CD标记进行额外的表面标记筛选,进一步支持了该亚群中活跃的整合素信号传导。此外,RT-F3+细胞具有高水平的GBM间质标志物(图2J,K)。最后,分泌组分析和基因标记分析显示,与大量未处理或照射的肿瘤细胞相比,照射的F3high的GBM细胞分泌的SASP因子如IL6、IL8、肝细胞生长因子和表皮生长因子水平明显更高(图2L,M)。总之,这些数据表明,RT-F3+群体具有丰富的干性、间充质GBM细胞转化、衰老样表观基因组重编程和SASP特征。
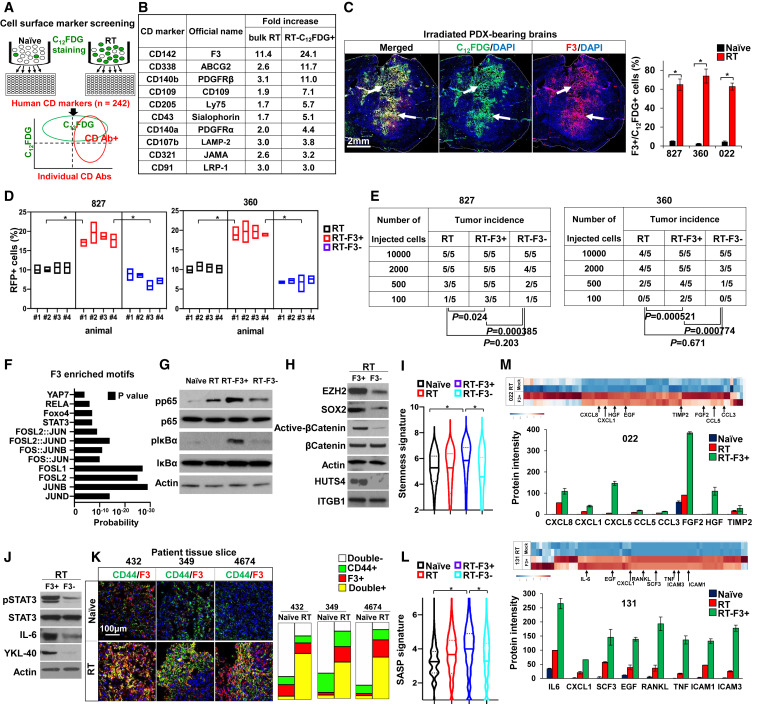
图2 F3在照射后的C12FDG+ GBM细胞中高度表达,与干性、细胞状态转变和分泌表型增强有关
3. F3信号在胶质母细胞瘤和TME中引发辐射诱导的变化
为了探讨F3在体内GBM辐射反应中的作用,研究者使用人PDX、GBM切片和同源小鼠胶质瘤模型进行了免疫组织化学染色分析(图3)。原位PDX荷瘤小鼠接受辐射,5天后采集脑组织。在F3强烈上调的区域,研究者发现F3与高水平的纤维蛋白正相关,纤维蛋白是F3启动的凝血级联的关键效应物(图3A)。F3阳性的GBM细胞YKL-40、CD44 和FN1也呈阳性。已知纤维蛋白聚合物和FN1一起形成网状结构,称为致癌临时ECM。它为巨噬细胞、活化血小板、中性粒细胞胞外陷阱和各种生长因子和趋化因子的募集提供了一个支架事实上,研究者发现在放疗肿瘤中F3阳性、纤维蛋白/FN1复合物富集区域的TAM和M2样TAM数量显著增加(图3B,C)。
为了在完整的免疫微环境中验证上述发现,研究者采用了PDGFβ驱动的、p53缺失的同基因小鼠胶质瘤,这是一种具有代表性的前膜亚型肿瘤初始肿瘤显示相对较低的纤维蛋白、TAM和CD44+细胞的基础水平。然而,照射后,研究者发现纤维蛋白聚合和TAM浸润以及F3和CD44水平大量增加(图3D-F)。值得注意的是,大多数CD163+、CD206+M2样TAM在纤维蛋白聚合物富集、F3+、CD44+肿瘤区域检测到,表明它们之间存在很强的正相关性(图3G)。总之,这些数据进一步表明,RT诱导的凝血、致癌TAM和GBM间质转化之间存在联系。

图3 辐射诱导肿瘤和微环境中F3 prime的全局变化
4. F3信号在GBM重编程和无线电抗性中的分子机制
鉴于F3与RT诱导的GBM重塑之间存在强烈的时空关联(图3),研究者首先通过shRNA介导的F3敲低(KD)确定了F3在体内的作用。将非靶向shRNA或表达F3 KD shRNA的GBM细胞移植到裸鼠脑内,20天后开始体内辐射(图4A,B)。荷瘤脑切片的免疫染色分析显示,F3抑制显著消除了RT诱导的纤维蛋白聚合物和IBA1+和CD44+细胞的积累(图4A)。与对照组相比,F3 KD或单独照射可延长荷瘤小鼠的存活时间。值得注意的是,注射F3 KD细胞并给予辐射的组比其他所有组的存活时间要长得多(图4B)。
然后,研究者确定了F3 KD对NF-κB、STAT3和整合素信号激活状态的影响(图4)。在初始状态下,F3 KD并没有引起pp65和pSTAT3的显著降低,这可能反映了F3的低水平。相反,F3 KD能有效抑制RT诱导的NF-κB、STAT3和整合素活性上调,以及间质性状的上调(图4C,D)。相反,NF-κB或STAT3信号组构活性突变体的过表达挽救了RT-F3 KD细胞的细胞存活,这表明NF-κB和STAT3活性都是RT诱导的F3信号传导的关键下游效应物(图4E)。
研究者测定了照射或不照射下F3 KD GBM细胞分泌的细胞因子/趋化因子水平。F3 KD显著降低了RT诱导的多种细胞因子/趋化因子的上调(图4F)。为了研究F3在趋化因子介导的TAM募集中的作用,研究者使用U937巨噬细胞样细胞进行了体外transwell实验与来自匹配的初始细胞的条件培养基相比,来自照射GBM细胞的条件培养基吸引的U937细胞数量显著增加。F3 KD使巨噬细胞募集水平降低约80%(图4G)。在受辐射的F3 KD细胞中,NF-κB活性被强制激活而STAT3活性未被激活,可恢复SASP因子的分泌,p65 shRNA抑制NF-κB可显著抑制RT诱导的SASP因子分泌,提示RT诱导的GBM中SASP在很大程度上依赖于NF-κB信号传导(图4H,I)。最后,在强力霉素介导的诱导F3 KD系统中,F3在肿瘤和体内TME中的作用得到了进一步证实(图4J)。这些数据支持F3是照射GBM细胞存活和细胞状态转变以及SASP因子分泌的关键调节因子。
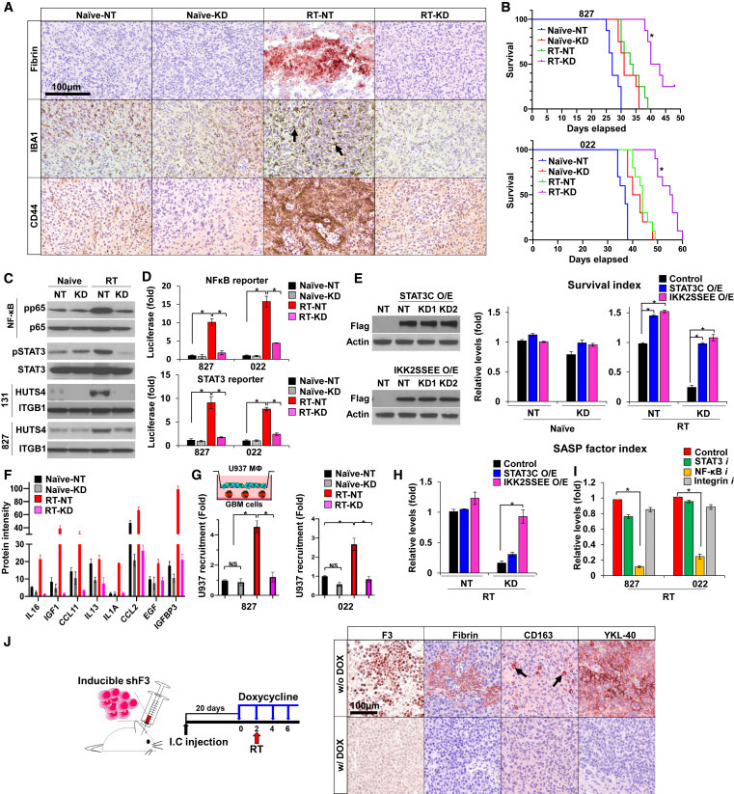
图4 F3基因敲低抑制辐射诱导凝血、SASP因子分泌和TAM激活
5. 重组ΔFVII蛋白在体内抑制辐射诱导的凝血、SASP因子分泌和TAM积累
由于F3蛋白在与其配体F7结合后,最终通过泛素途径被降解,研究者假设特定的F7衍生物可能直接触发F3降解,而不会引发F3介导的致癌作用为了进行测试,研究者通过慢病毒转导在GBM细胞中过表达一系列F7缺失突变体,并测定照射后这些GBM细胞的增殖情况(图5A)。通过筛选,研究者发现了一个缺失突变体,可以有效地阻碍照射GBM细胞的生长,研究者将其命名为ΔFVII。
ΔFVII强烈诱导泛素介导的F3蛋白降解,并显著降低照射GBM细胞中F3蛋白的水平(图5B,C)。与此一致的是,用ΔFVII处理一天的GBM细胞显示磷酸化p65和STAT3蛋白显著降低(图5D)。此外,研究者发现ΔFVII降低了共免疫沉淀的F3 -整合素复合物、HUTS4和磷酸化的FAK的水平(图5E)。然后研究者确定ΔFVII对GBM细胞存活和克隆生长的影响(图5F,G)。ΔFVII处理有效地损害了辐射GBM细胞的存活,IC50在0.1-1 nM范围内(图5F)。相比之下,正常神经祖细胞和原代星形胶质细胞即使在微摩尔ΔFVII浓度下也没有表现出细胞毒性(图5F)。实时细胞成像分析表明,ΔFVII处理可显著损害照射后F3high GBM细胞的克隆生长(图5G)。最后,为了确定ΔFVII对SASP因子分泌的影响,研究者用ΔFVII处理照射过的GBM细胞1天,并收集条件培养基。ΔFVII治疗显著降低了细胞因子的分泌(图5H)。总之,这些数据表明ΔFVII是一种有效的抗GBM药物,可减轻f3介导的致癌信号,特别是与RT联合使用时。
为了确定ΔFVII在体内的作用,研究者从皮下肿瘤模型开始。当肿瘤达到~ 500 mm3时,研究者局部照射人PDX肿瘤,并通过静脉注射ΔFVII蛋白(50μg/kg)。与初始对照组相比,放疗后5天收获的肿瘤显示纤维蛋白/FN1复合物、肿瘤浸润性CD11b+、F4/80+、CCR2+免疫细胞和CD163+ M2样TAM显著增加,F3大量上调(图5I)。值得注意的是,ΔFVII处理有效地抑制了上述所有变化,C-Cas3+细胞的数量急剧增加(图5I)。为了评估ΔFVII对信号通路激活和衰老样特征的体内影响,研究者从每组中收集肿瘤并对其进行处理以进一步分析。ΔFVII治疗显著降低了RT诱导的细胞存活信号,如STAT3,但增加了肿瘤中细胞死亡相关蛋白的水平(图5J)。为了分析放射、ΔFVII或两者治疗的肿瘤内的趋化因子/细胞因子微环境,研究者使用肿瘤裂解物进行了细胞因子分析。照射诱导分泌蛋白显著上调,其中许多蛋白在巨噬细胞募集、M2样TAM极化和细胞状态转变中具有众所周知的功能。值得注意的是,ΔFVII治疗显著且全面地抑制了趋化因子/细胞因子水平(图5K)。
为了确定肿瘤和ΔFVII对全身止血的影响,研究者通过标准尾出血试验测量了血液凝固活性(图5M)。与对照小鼠相比,荷瘤小鼠的凝血时间较短,照射后凝血时间进一步缩短。虽然ΔFVII治疗对非荷瘤小鼠的凝血时间没有影响,但照射和ΔFVII联合治疗使RT荷瘤小鼠的高凝状态恢复到接近正常范围(图5M)。肿瘤生长动力学研究表明,单独照射或ΔFVII单药治疗可将肿瘤的生长速度抑制至未发肿瘤的50-60%左右,但单独使用这两种药物的作用都是短暂的,并导致肿瘤快速再生(图5L,N)。相比之下,联合治疗使肿瘤几乎完全消退(图5N)。

图5 ΔFVII治疗抑制了RT诱导的体内凝血、SASP因子分泌和TAM积累
6. ΔFVII治疗对原位PDX模型GBM肿瘤放射敏感
研究者使用患者来源的022或827 GBM细胞测试了ΔFVII重组蛋白在原位GBM PDX模型中的作用。肿瘤细胞植入后20天或25天开始照射,并在照射的同时静脉注射ΔFVII蛋白(图6A)。照射5天后,采集各组脑组织进行免疫染色和肿瘤解剖免疫印迹分析。放疗和ΔFVII联合治疗显著降低了RT诱导的纤维蛋白积累、MES细胞状态转变、TAM极化、整合素和NF-κB信号活性,但增加了C-Cas3+细胞数量(图6A-D)。值得注意的是,在植入后38天接受联合治疗的小鼠的脑切片组织学检查显示,肿瘤细胞很少,纤维蛋白聚合物只有微弱的染色(图6E)。研究者还通过D-二聚体和尾出血试验确定了原位GBM肿瘤和ΔFVII对全身止血的影响(图6F,G)。与皮下肿瘤结果类似,ΔFVII治疗有效地抑制了RT-荷瘤小鼠的高凝状态(图6F,G)。最后,与对照组相比,单独照射或ΔFVII单药治疗可使荷瘤小鼠的存活时间延长约10天(图6H)。值得注意的是,接受联合治疗的组显示出更大的生存延长,大约50%的小鼠存活,三个月后没有可检测到的肿瘤(图6H)。
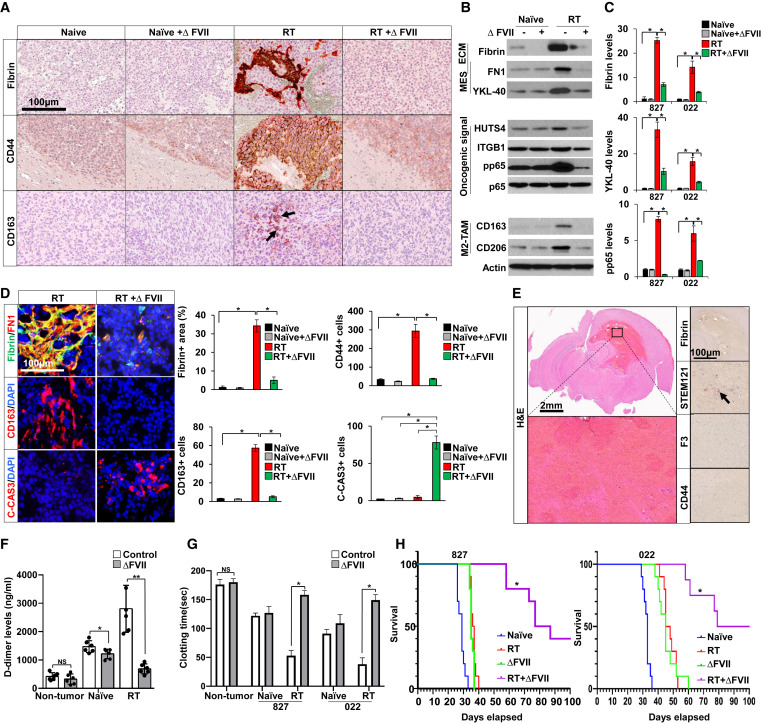
图6 ΔFVII原位PDX模型中治疗对GBM肿瘤的放射敏感性
7. 早期复发GBM患者的复发肿瘤具有衰老和凝血途径的基因信号上调
比较原发性和复发性GBM的匹配可以为治疗诱导的表型肿瘤演变提供信息,包括GBM细胞状态和TME成分之间的关联。因此,研究者使用来自GLASS联盟的数据集分析了RT治疗的原发性GBM的转录谱,并将早期复发与晚期复发分离。通过代表性基因特征集的途径富集分数推断每个肿瘤的途径激活状态(图7A,B)。研究者观察到早期和晚期复发的原发肿瘤的特征基因集水平没有显著差异。然而,在比较复发的GBM时,研究者发现,与晚期复发的GBM相比,早期复发的GBM中M2巨噬细胞的预测存在以及衰老、凝血和NF-κB特征的富集明显更高(图7B)。此外,衰老、凝血和NF-κB特征的富集评分彼此高度相关,特别是在早期复发肿瘤对中(图7C,D)。这些数据与研究者的结果一致,并可能为ΔFVII-based疗法的潜在翻译提供临床相关性。
研究者的数据共同支持了以前未确定的概念,即TIS期间F3信号的激活是触发肿瘤细胞和TME中全局适应程序的核心启动器,导致治疗抵抗和肿瘤复发(图7E)。
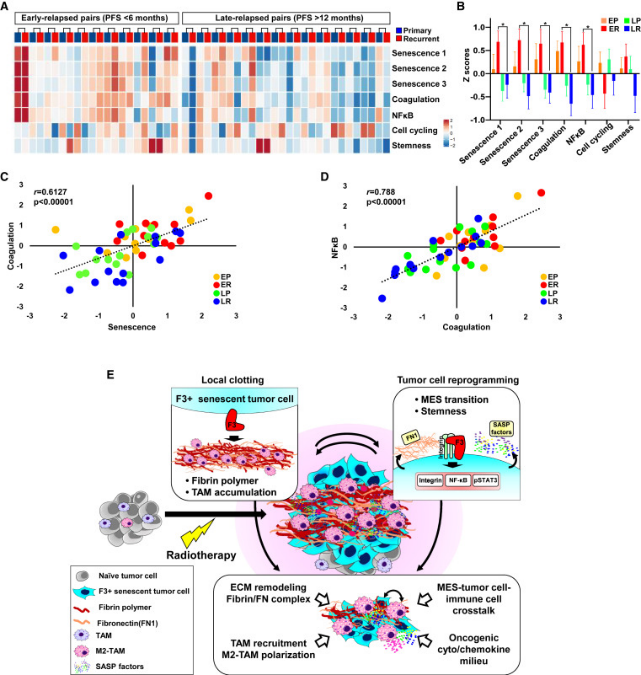
图7 人类原发性和复发性GBM配对中衰老和凝血基因组的表达
结论
该研究显示,GBM中的F3信号是一个主动适应程序,以逃避治疗压力并利用TIS的致癌方面。因此,抑制F3信号可能是一种有希望的策略,可以显著增强其他次优的抗GBM治疗。该发现可能为更好地理解F3信号提供了一步,这可能对推进治疗策略至关重要。
实验方法
酶联免疫吸附检测,荧光活化细胞分选,流式细胞术,单细胞RNA测序,ATAC测序,生物信息学分析,免疫荧光,免疫组织化学,免疫印迹,免疫共沉淀
参考文献
Jeon HM, Kim JY, Cho HJ, Lee WJ, Nguyen D, Kim SS, et al. Tissue factor is a critical regulator of radiation therapy-induced glioblastoma remodeling. Cancer Cell. 2023 Aug 14;41(8):1480-1497.e9. doi: 10.1016/j.ccell.2023.06.007.















