产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
单细胞测序揭示新的CAF细胞亚群在食管癌恶性进展中的作用
发布时间:2024-03-04 09:20 | 点击次数:
食管鳞状细胞癌(ESCC)是一种常见的恶性肿瘤,其发生过程由正常上皮细胞向上皮内瘤变,最后向浸润性癌转变。然而,癌前病变如何进展为癌仍然是一个谜。本研究报告了一个全面的细胞RNA测序和空间转录组研究79个多阶段食管病变29例食管鳞癌患者。研究揭示了ANXA 1表达在上皮细胞中的逐渐和显着的损失,是由于其转录因子KLF 4沿着病变进展。本研究于2023年5月发表于《Cancer Cell》上,IF=50.3 。
技术路线









主要研究内容
1.单细胞转录组学分析解读多阶段食管鳞癌肿瘤发生中的不同细胞类型
对79个手术取出的食管样品进行scRNA-seq,包括45个NOR、9个LGIN、9个HGIN和来自29名ESCC患者的16个肿瘤(图1A)。基于图的聚类和典型细胞标记注释揭示了七种主要的细胞类型,即,上皮细胞(n = 5,218)、成纤维细胞(n = 28,530)、内皮细胞(n = 14,388)、T细胞(n = 63,332)、B细胞(n = 38,220)、骨髓细胞(n = 21,627)和肥大细胞(n = 5,177),这些细胞类型的组成在不同的疾病阶段不同(图1B)。发现>25%的NOR和LGIN阶段的上皮细胞高度表达MD程序,而该细胞亚型的比例在HGIN和ESCC阶段降低至<6%,表明MD程序在保持食管上皮细胞的正常表型中起重要作用(图1C)。超过95%的NOR和LGIN阶段的成纤维细胞被鉴定为NF。CAF出现在HGIN阶段,占ESCC中总成纤维细胞的63%(图1D)。以表达IGFBP 3(Endo-IGFBP 3)为特征的内皮细胞亚型在ESCC中增加至50%,但仅分别占NOR、LGIN和HGIN阶段的总内皮细胞的近25%(图1 E)。如预期的,在ESCC肿瘤发生期间的不同阶段,五种免疫细胞类型B细胞、CD4+T细胞、CD8+T细胞、肥大细胞和骨髓细胞的比例变化(图1F)。结果发现,虽然B细胞比例由NOR的27%下降到ESCC的16%,但LGIN和HGIN的B细胞比例增加,分别为43.2%和47.0%;虽然ESCC中CD 8 + T细胞比例(51.3%)明显高于NOR(26.7%),但NOR、LGIN(26.1%)和HGIN(24.3%)的比例相似。这些结果提示,食管鳞癌微环境中免疫细胞数量的变化可能是食管鳞癌发生的晚期事件。
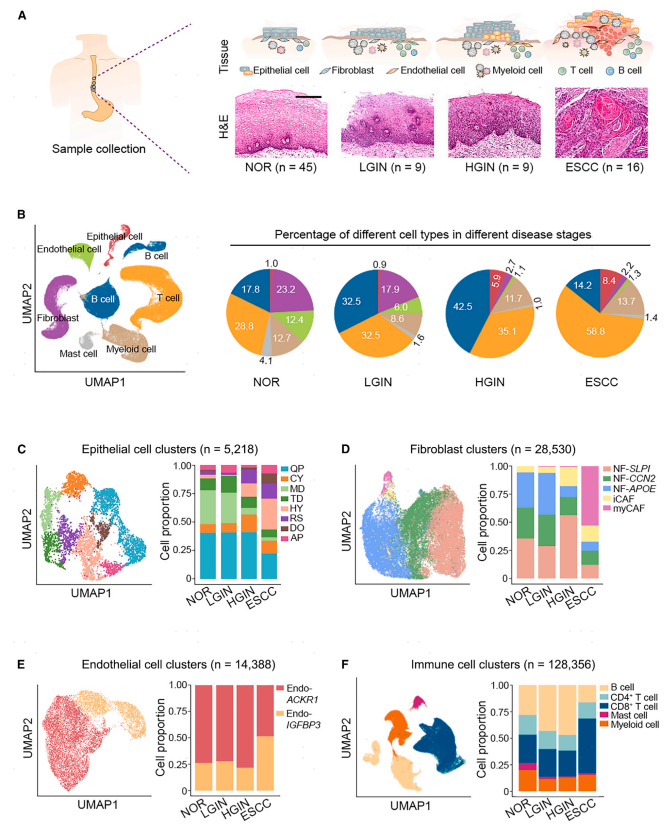
图1:单细胞转录组学分析解读多阶段食管鳞癌肿瘤发生中的不同细胞类型
2.食管鳞癌发生过程中ANXA1在上皮细胞中的表达逐渐受到抑制
进一步探索了不同疾病阶段上皮细胞的组成和转录改变。分析的上皮细胞(n = 5,218)由来自NOR的1,002个细胞、来自LGIN的205个细胞、来自HGIN的1,097个细胞和来自ESCC的2,914个细胞组成(图2A)。无监督聚类分析揭示了在ESCC发展期间以不同表达程序为特征的八种不同上皮细胞类型(图1C、2A和S2 A;表S2)。具有四种表达程序的上皮细胞,即,QP、CY、MD和TD占正常上皮细胞的88.1%(883/1,002);然而,在ESCC肿瘤中表达这些程序的细胞的百分比下降到43.1%(2,914个中的1,256个)(图2A)。相比之下,在ESCC发展过程中,表达其他四种癌症相关程序(包括HY、RS、DO和AP)的上皮细胞的比例从9.8%增加到56.9%(图2A和2B)。计算了程序标记基因的平均表达的Z评分,并且结果还显示与NOR相比,HGIN(p = 1.45×10-58)和ESCC(p = 1.94 ×10-105)中MD程序的显著降低(图2B)。选择了ANXA 1进行验证和深入分析,发现ANXA 1表达水平从NOR逐渐降低到LGIN、HGIN和ESCC(图2C,趋势检验,p = 4.45×10-80),这通过空间转录组学分析证实,显示位于上皮中的ANXA 1 RNA水平与NOR(分别为p = 3.80×10-161和p<10-308)或LGIN(分别为p=2.14×10-114和p=4.84×10-187)相比显著降低,趋势检验P为6.57 ×10-17(图2D和2 E)。还对不同疾病分期的组织进行了ANXA 1免疫组化染色,结果进一步证实,与NOR组织相比,ANXA 1在癌前和ESCC部位的蛋白水平显著下调(p=7.41×10-3,p=9.69×10-4和p = 3.52×10-6;趋势检验,p= 7.36×10-15;图2F)。这些结果有力地表明,食管特异性蛋白ANXA 1的功能丧失可能是ESCC肿瘤发生的关键事件。
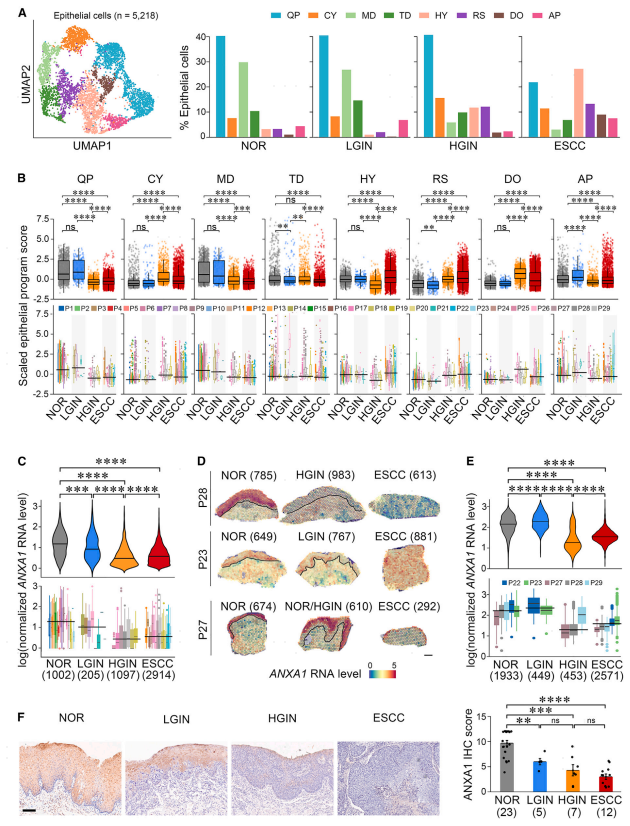
图2:食管鳞癌发生过程中上皮细胞ANXA1表达的逐渐抑制
3.上皮细胞中ANXA1抑制促进NFs向CAFs的转化
鉴定了表达SLPI(NF-SLPI)、CCN 2(NF-CCN 2)或APOE(NF-APOE)标志物基因的三种NF,以及两种CAF类型,即:基于已知的CAF标志物基因,可以鉴定炎性CAF(iCAF)和成肌纤维细胞CAF(myCAF)(图3A)。iCAF显示活性趋化因子产生途径,具有高表达水平的诸如IL 24和CXCL 18的基因,而myCAF具有高表达水平的与ECM重塑和降解相关的基因,诸如MMPl和MMPll(图3B和3C)。然后,构建了成纤维细胞状态转变的轨迹,结果显示CAF活化轨迹从NF-SLPI亚型开始,通过NF-CCN 2到iCAF和最终的myCAF,而NF-APOE通过次要轨迹被活化为NF子集(图3D)。沿着该轨迹,一致地鉴定了在NF中活化的途径在起始点富集,而胶原蛋白三聚体中的CAF相关基因(即,CAF相关基因)在起始点富集。COL 1A 1和CTHRC 1)、炎症(即,CXCL 1、CXCL 8和IL 24)和ECM重塑(即,FAP、MMPl和MMPll)在成纤维细胞活化的晚期富集(图3E)。提示在食管鳞癌的形成和发展过程中,早在HGIN甚至LGIN阶段,微环境中的NF就被激活为CAFs。计算成纤维细胞标志物基因在NFS和CAF中的表达分数以量化其生物学功能,并与上皮细胞表达程序分数进行相关性分析。结果表明,在8种上皮细胞方案中,只有MD方案的评分与NF签名评分显著正相关(r=0.29,p=0.014),而与ICAF(r=-0.24,p=0.041)和myCAF0.27(r=-0.27,p=0.022)签名评分显著负相关(图3F)。空间转录组学结果进一步验证了ANXA 1与NF活性呈负相关,与CAF活性呈负相关。具体地,揭示了随着上皮中ANXA 1 RNA水平从LGIN/HGIN到ESCC降低,固有层和粘膜下层中的NF特征评分也显著降低;然而,当ANXA 1表达在ESCC发展期间被抑制时,iCAF和myCAF特征评分显著增加(图3 H和3 I)。这些结果表明,食管上皮细胞分泌的ANXA 1可能通过上皮细胞-成纤维细胞的相互作用在调控微环境NF中发挥重要作用,上皮细胞ANXA 1功能的缺失可能导致NF向CAF转化。
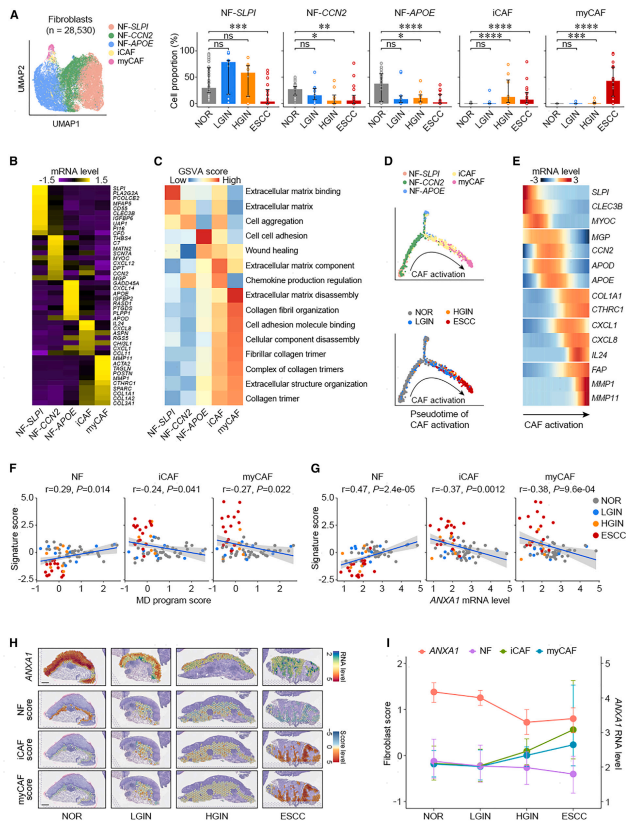
图3:上皮细胞中的ANXA 1抑制促进NF转化为CAFs
4.上皮ANXA1抑制促进myCAF在体外和体内的活化
分别从5例ESCC患者的NOR、LGIN、HGIN和ESCC组织中获得食管类器官和成纤维细胞。成纤维细胞的免疫荧光染色和类器官及其相应组织的组织病理学表征以及选择标志物的免疫化学染色的图像示于图4A。食管组织的免疫荧光分析还显示,上皮细胞和ECM中的ANXA 1水平被抑制,同时HGIN和ESCC组织中周围基质中的FAP(CAF活化标志物)水平显著增加(图4 B),进一步证实了两种细胞类型之间的相关性和潜在的相互作用。然后建立了ANXA 1缺失或过表达的ESCC和正常食管上皮细胞系(OE;图4C),并将它们与NF共培养。结果显示,与对照细胞共培养的那些相比,NF在与ANXA 1耗尽的ESCC细胞共培养时具有显著更高的迀移能力,但在与ANXA 1-OE ESCC细胞共培养时具有显著更低的迀移能力(图4D)。与相应的对照相比,myCAF活化标志物在与ANXA 1敲除(KO)细胞共培养的NF中显示一致的上调,但在与ANXA 1-OE细胞共培养的NF中显示一致的下调。然而,在这些体外实验环境中,未检测到iCAF相关标志物变化(图4 E)。此外,将重组人ANXA 1蛋白(rANXA 1)添加到NF和ESCC的共培养物中以剂量依赖性方式基本上抑制myCAF活化,并且该效果与与具有强制ANXA 1过表达的ESCC细胞共培养的效果相同(图4F)。接下来检测ECSS细胞中ANXA1表达的变化是否会影响与或不与从食管组织样本中分离的NF共移植的小鼠肿瘤异种移植物的生长速率。如图4G所示,与仅来源于ESCC细胞的异种移植物相比,来源于KYSE30细胞加NF的异种移植物具有显著增加的生长速率,表明CAF可以促进ESCC进展。
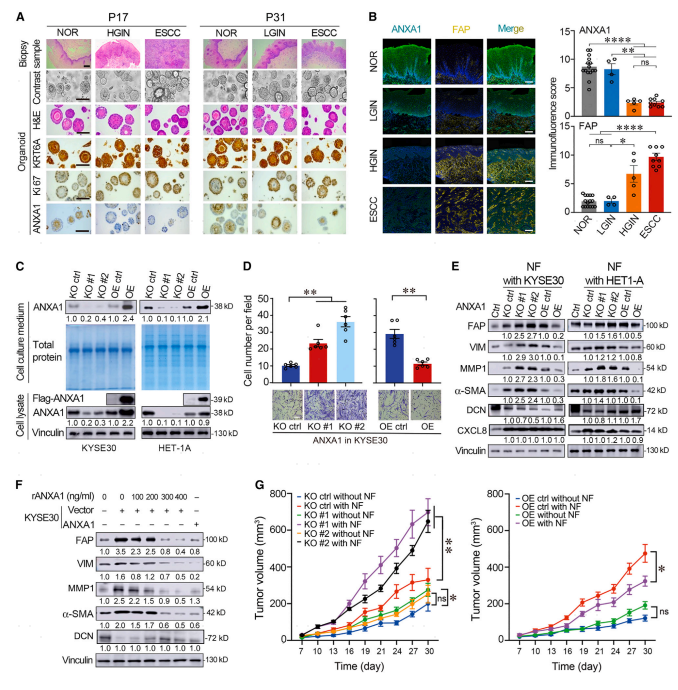
图4:上皮ANXA1抑制促进myCAF在体内外的活化
5.ANXA1缺失通过减弱其与FPR2的相互作用促进myCAF活化
通过使用相互免疫共沉淀分析来检查结合是否是通过FPR,如果是,则哪个FPR家族成员是ANXA1靶标,结果显示ANXA1特异性结合FPR2,而不是其他两个FPR成员(图5A和B)。这种配体-受体相互作用进一步得到免疫荧光测定的支持,所述免疫荧光测定显示rANXAl和FPR 2在NF和CAF细胞膜中的共定位(图5C)。还观察了ANXA 1-FPR2结合破坏后NF向myCAF转化的功能改变,并且发现当FPR 2敲低NF与ANXA 1-OE ESCC细胞共培养时,myCAF活化标志物的表达水平显著增加(图5D),表明ANXA 1通过NF中与FPR 2的配体-受体相互作用对NF向myCAF转化的控制作用。进一步检查了抑制NF向myCAF转化的ANXA 1FRP 2信号传导的下游效应子,并且发现ANXA 1-FPR 2相互作用强烈抑制AKT、ERK和SMAD 3的磷酸化,这伴随着myCAF标志物FAP、Vim、MMP 1和a-SMA的水平显著降低(图5E)。当用rANXAl或ERK(SCH 772984)、AKT(MK-2206)和SMAD 3(SIS 3)的抑制剂处理NF时,也观察到这些类似的变化(图5 F)。尽管ANXAl和TGF-b作用的下游分子模块可能相似,但TGF-b对NF转化为myCAF的作用不依赖于FPR 2(图5E)。这些结果表明正常或癌性上皮细胞与NF或CAF之间的实质性相互作用。最后,检查了ANXA 1在由致癌物4-NQO诱导的小鼠ESCC模型中抑制ESCC发展和进展的潜在功能。我们向小鼠施用Ac2 -26(一种结合FPR受体的ANXA 1模拟肽)持续5周,并发现与用媒介物处理的对照小鼠相比,Ac 2 -26处理组中癌前病变和肿瘤的负担显著降低(图5G)。这些体内结果进一步支持ANXA 1在抑制ESCC中的重要作用。
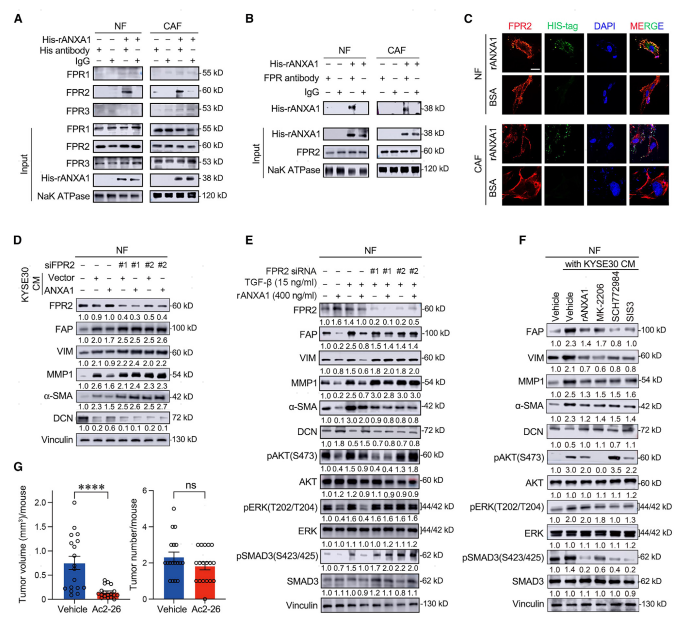
图5:ANXA1缺失通过减弱其与FPR2的相互作用促进myCAF活化
6.ANXA1功能的丧失是由其转录因子KLF4的抑制引起的
使用四个公共数据库进行了计算机模拟分析,得到了ANXA 1的11个候选TF。然后,分析了scRNA-seq数据中这些TF的表达水平与ANXA 1之间的相关性,结果表明四种潜在的TF,KLF 4、KLF 5、CEBPB和FOXA 1,与ANXA 1 RNA水平显著正相关(r > 0.3,p < 0.05;图6A)。通过scRNA-seq和免疫化学染色,我们发现与NOR相比,从LGIN、HGIN到ESCC,KLF4 RNA和蛋白质水平均显著 降低(图6 B和6C)。ANXA 1 RNA和KLF 4 RNA水平之间存在显著正相关(r = 0.39,p = 5.4×10-5;图6D)。HET-1A和KYSE 450细胞中的基因敲低测定显示,在四种TF中,仅靶向KFL 4的小干扰RNA(siRNA)显著抑制ANXA 1表达(图6 E)。电泳迁移率变动测定证实KLF 4特异性结合ANXA 1启动子序列,其可被抗KLF4的抗体消除(图6 F)。染色质免疫沉淀与定量聚合酶链反应测定偶联显示ANXA 1被KLF4抗体显著富集,并且结果在HET-1A、KYSE 450和KYSE 30细胞中是一致的(图6 G)。总之,这些生化结果证明KLF 4是一种真正的TF,它能正向调节食管上皮细胞中ANXA 1的表达。最终证明了KLF 4调节ANXA 1转录,这连接到NFs向CAFs的转化。为此,进行了体外实验,以探讨KLF 4表达状态对CAF迁移和激活的影响。结果显示,沉默KLF 4显著增强CAF活化和迀移,而恢复ANXA 1(通过向共培养基中添加rANXA 1)可以显著抑制由KLF 4抑制引起的CAF活化和迀移(图6 H和6I)。这些结果支持KLF4调控ANXA1的转录,ANXA1调控NF向myCAF的转化。我们还在正常食管样品中进行了KLF4和ANXA1蛋白的免疫荧光染色,结果显示这两种分子共定位且正相关(图6J)。

图6:ANXA1缺失是由其转录因子KLF4的抑制引起的
结论
总之,本研究通过利用来自同一个ESCC个体的NOR、LGIN、HGIN和癌标本,并使用整合的scRNA-seq、空间转录组学分析、功能测定和动物实验,已经发现了ESCC从其癌前病变通过上皮细胞和成纤维细胞之间的异常串扰的进展的重要机制。本研究结果可能对了解癌症的发展和ESCC的预防和临床治疗具有深远的意义。
实验方法
收集临床样本,单细胞转录组测序,轨迹分析,基因集变异分析,空间转录组测序, ANXA 1表达改变的细胞系的建立,基因表达的RNA干扰, Co-培养实验,成纤维细胞迁移测定,小鼠异种移植实验,小鼠原代ESCC模型和Ac 2 -26治疗,定量实时PCR分析,蛋白质印迹测定,免疫组织化学和多重免疫荧光分析,免疫荧光分析,免疫沉淀测定,酶联免疫吸附测定,电泳迁移率转移试验,报告质粒构建和报告试验,染色质免疫沉淀偶联定量PCR分析。
参考文献
Chen, Y., Zhu, S., Liu, T., Zhang, S., Lu, J., Fan, W., Lin, L., Xiang, T., Yang, J., Zhao, X., Xi, Y., Ma, Y., Cheng, G., Lin, D., & Wu, C. (2023). Epithelial cells activate fibroblasts to promote esophageal cancer development. Cancer cell, 41(5), 903–918.e8. https://doi.org/10.1016/j.ccell.2023.03.001















