产品分类
公司荣誉
公司图片
联系我们
- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
最新研究动态
Treg细胞来源的外泌体miR-2861-脊髓损伤治疗的新靶点
发布时间:2024-03-01 08:52 | 点击次数:
血脊髓屏障(BSCB)是血液和脊髓实质之间的物理屏障。目前的证据表明,脊髓损伤后BSCB完整性的破坏可导致继发性损伤,如脊髓水肿和过度炎症反应。Treg细胞是有效的抗炎细胞,可抑制脊髓损伤后的神经炎症反应,其在脊髓损伤后的浸润表现出与BSCB自动修复相同的时空特征。然而,很少有研究评估Treg细胞与脊髓损伤之间的关系,强调BSCB的完整性。本研究探讨Treg是否影响脊髓损伤后BSCB的恢复及其机制。我们证实脊髓损伤后同时发生血管生成和Treg细胞浸润。此外,我们观察到Treg细胞敲除和过表达对小鼠BSCB修复和运动功能的显著影响。随后,我们在体外证明了外泌体的存在和功能。此外,我们发现Treg细胞来源的外泌体包裹miR-2861,miR-2861调节血管紧密连接(TJs)蛋白的表达。荧光素酶报告基因实验证实了miR-2861对IRAK1的负调控,一系列拯救实验证实了IRAKI在调节BSCB中的生物学功能。总之,我们证明Treg细胞来源的外泌体可以包装和递送miR-2861并调节IRAK1的表达,从而影响小鼠脊髓损伤后BSCB的完整性和运动功能,这为脊髓损伤后的功能修复和限制炎症提供了新的见解。本文于2023年10月发表于“Journal of Nanobiotechnology”(IF=10.2)上。
技术路线

结果
1)脊髓损伤后血脊髓屏障完整性的破坏和损伤部位Treg细胞的浸润
在本研究中,我们利用CD31标记来跟踪健康脊髓组织和损伤部位,以监测脊髓损伤后血管恢复和血脊髓屏障的任何破坏(图1A)。我们发现,损伤部位的血管密度在第3天低于正常脊髓组织(1A, 1B)。第7天损伤部位与正常脊髓组织的血管密度无明显差异(图1A, 1B)。这些结果证实脊髓损伤后第3天损伤部位血管开始修复,并在第7天达到稳定状态。然后将FITC-葡聚糖注射到脊髓损伤小鼠和正常小鼠体内,量化其荧光强度,观察脊髓损伤后血脊髓屏障的状态。我们发现,与正常组相比,脊髓损伤组损伤部位的荧光强度明显增加(图1C, 1D),这意味着BSCB受到严重损伤,导致SCI后FITC-葡聚糖渗透。对脊髓损伤后脊髓组织损伤区和非损伤区血管紧密连接相关蛋白进行免疫荧光染色,观察血管紧密连接情况。我们的研究结果表明,与非损伤区域相比,ZO-1和Occludin与CD31在损伤区域的共定位显著减少(图1E-1H)。同时,western blotting显示TJS相关蛋白的表达逐渐减少(图1F)。这些结果证实了脊髓损伤后损伤区BSCB的完整性受到影响并逐渐加重。免疫荧光实验显示,脊髓损伤后损伤部位有显著的Treg细胞浸润(图1H、1I)。据此,我们推测Treg细胞可能影响BSCB的修复。

2)Treg细胞促进脊髓损伤小鼠BSCB修复和运动功能恢复
为了探讨Treg细胞对BSCB修复的影响,我们首先建立了Foxp3DTR转基因小鼠,通过注射白喉毒素(DT)选择性敲除Treg细胞并验证敲除效率。将Treg细胞注射到Foxp3DTR转基因小鼠的尾静脉后,建立Treg细胞过表达小鼠模型。Foxp3DTR + DT组TJs蛋白与血管的共定位低于Foxp3DTR + PBS和Foxp3DTR + Treg组(图2A、2B),而Foxp3DTR + Treg组TJs蛋白与血管的共定位明显高于其他两组(图2A、2B)。这些结果表明敲除Treg细胞可以抑制SCI小鼠脊髓中TJs相关蛋白的表达。Treg细胞的过表达可以帮助TJs蛋白和血管更好地共定位,与Western blotting结果一致(图2C)。为探讨不同治疗方法对脊髓损伤小鼠运动功能的影响,分别对三组脊髓损伤小鼠进行足迹分析。Foxp3DTR + DT组的足迹分析结果最差,其次是Foxp3DTR + PBS组,Foxp3DTR + Treg组(图2D, 2E)。游泳试验和Basso小鼠量表(BMS)行为分析显示相似的结果(图2F-2H)。这些结果证实了Treg细胞对脊髓损伤小鼠运动功能的影响。根据上述结果,我们认为损伤部位Treg细胞的积累可以促进脊髓损伤后小鼠BSCB的恢复,改善运动功能。

3)Treg来源的外泌体促进bEND.3细胞中紧密连接蛋白的表达
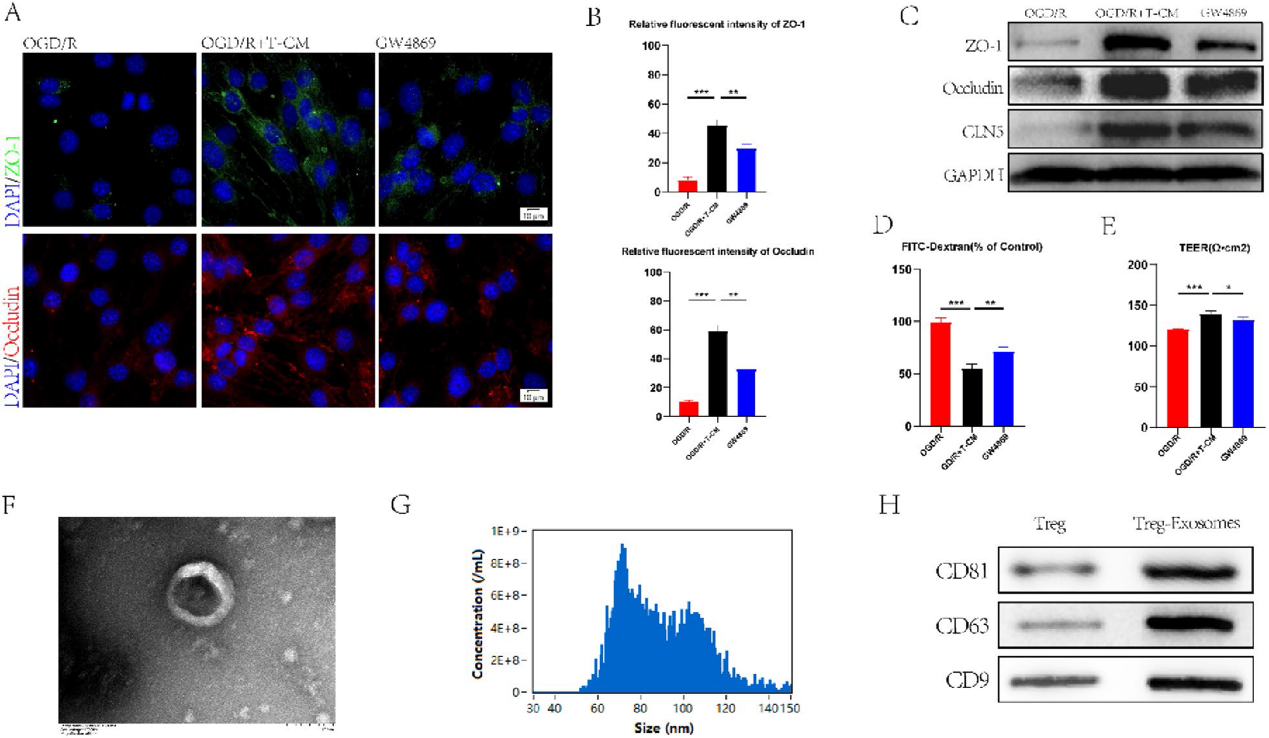
为了进一步探讨Treg细胞对脊髓损伤小鼠BSCB的作用机制,我们采用氧-葡萄糖剥夺/再氧化(OGD/R)处理bEnd. 3细胞体外构建BSCB损伤模型,并进行免疫荧光染色。实验结果表明,与OGD/R 处理的bEnd. 3细胞相比,T-CM处理组Occludin和ZO-1蛋白的表达明显增加(图3A, 3B)。细胞分泌的外泌体已被证明在细胞通讯中起作用。为了进一步探讨T-CM的作用,用外泌体抑制剂GW4869处理与T-CM共培养的bEnd. 3细胞。GW4869的加入逆转了T-CM对TJs蛋白表达的刺激作用(图3A,3 B)。western blotting验证了上述结果(图3C)。内皮通透性和跨内皮电阻(TEER)被用来评估外泌体的治疗效果(图3D, 3E)。上述证据证实了Treg细胞可以通过分泌外泌体影响bEND. 3细胞中TJs蛋白表达的猜想。我们通过透射电子显微镜(TEM)和纳米颗粒跟踪分析(NTA)(图3F, 3G)鉴定了Treg细胞来源的外泌体,并通过western blotting(图3H)验证了它们。
4)Treg来源的外泌体促进脊髓损伤小鼠的BSCB修复和运动功能恢复
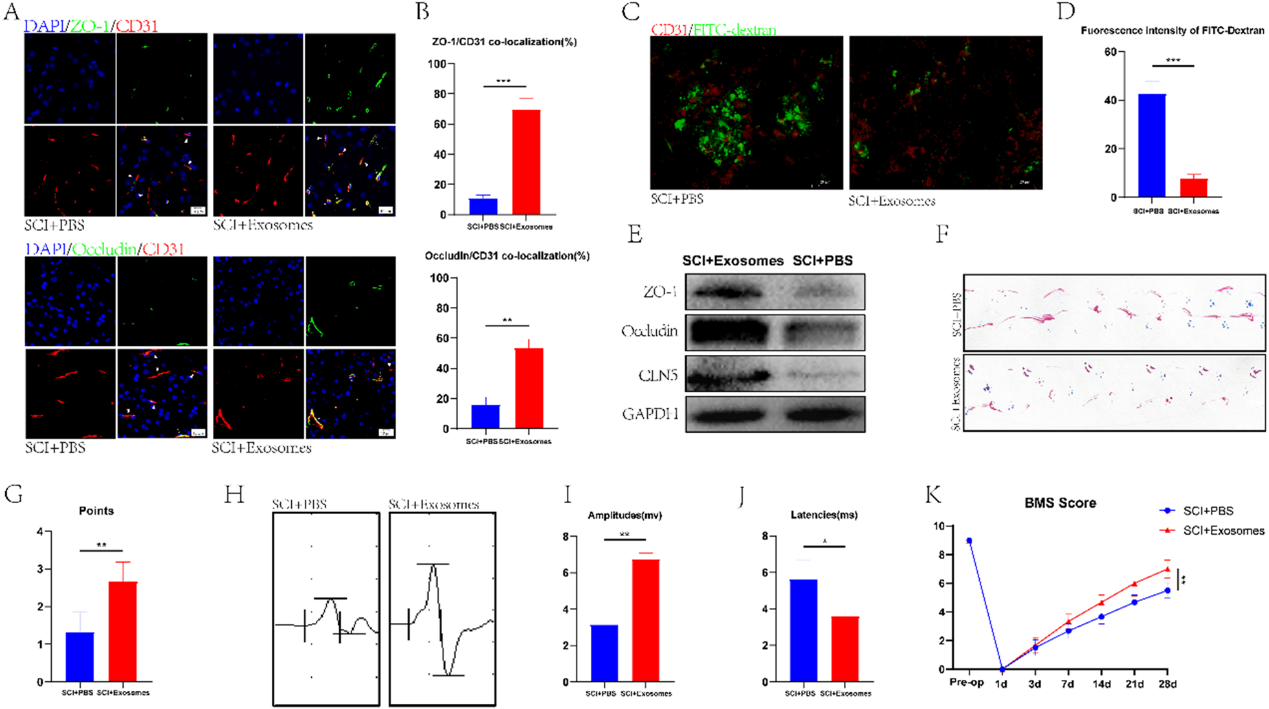
为了探讨Treg来源的外泌体(Treg-Exos)是否在SCI小鼠BSCB修复中发挥作用,我们将分离的外泌体注射到SCI小鼠体内,然后对小鼠脊髓进行免疫荧光染色。与SCI + PBS组相比,SCI +外泌体组Occludin和ZO-1与CD31的共定位更为明显。(图4A, 4B)。这些结果表明,注射外泌体后,SCI小鼠的BSCB修复更为显著,与FITC-葡聚糖渗透实验和western blot的结果相似(图4C-4E)。我们通过多项行为分析比较了SCI +外泌体组与SCI + PBS组的运动功能,发现外泌体治疗后,前者的运动功能较后者有明显改善(图4F-4K)。
5)外泌体在体外递送miR-2861作用于bEND.3细胞以改善TJs蛋白表达
考虑到外泌体可以传递miRNA并发挥调控作用,我们从GEO数据库中选择了来自Treg细胞和源自Treg的外泌体的TOP20 miRNA,经交叉后获得5个miRNA,其中选择了miR-2861进行进一步研究。在确定miR-2861在外泌体中的存在后,我们试图确认外泌体中的miR-2861是否可以在BSCB恢复中发挥关键的生物学作用。因此,我们通过慢病毒转染敲低和过表达miR-2861,并分别构建相应的阴性对照(miR-2861KD、miR-NCKD、miR-2861OE和miR-NCOE)。通过qRT-PCR验证转染效率(图5A)。为了观察miR-2861在细胞水平上的作用,我们从慢病毒转染的Treg细胞模型中提取外泌体(miR-NCKD-Exos, miR-2861KD-Exos, miR-NCOE-Exos和miR-2861OE-Exos),并将外泌体与OGD/ R处理的bEnd. 3细胞共培养。我们发现miR-2861在miR-2861KD-Exos组中的表达明显低于miR-NCKD-Exos组。此外,miR-2861在miR-2861OE-Exos组中的表达明显高于miR-NCOE-Exos组(图5B)。在bEnd. 3个细胞中,各组miR-2861的表达趋势相同,这与外泌体组miR-2861的表达水平相对应(图5C)。免疫荧光染色显示,miR-2861KD-Exos组Occludin和ZO-1的荧光强度明显低于miR-NCKD-Exos组。在miR-2861OE-Exos组中观察到相反的结果(图5D,5 E),与WB(图5F)一致。这些结果表明miR-2861的敲低和过表达可能会降低和增加TJs蛋白的表达。我们还观察了bEND. 3细胞的渗透性和TEER。发现miR-2861KD-Exos组通透性增加,miR-2861OE-Exos组通透性降低(图5G)。miR-2861KD-Exos组TEER显著降低,miR-2861OE-Exos组TEER升高(图5H)。以上结果有力地证明了miR-2861是一种促进BSCB修复的生物介质,探索其潜在机制具有重要意义。

6)miR-2861在体内修复BSCB并增加运动功能
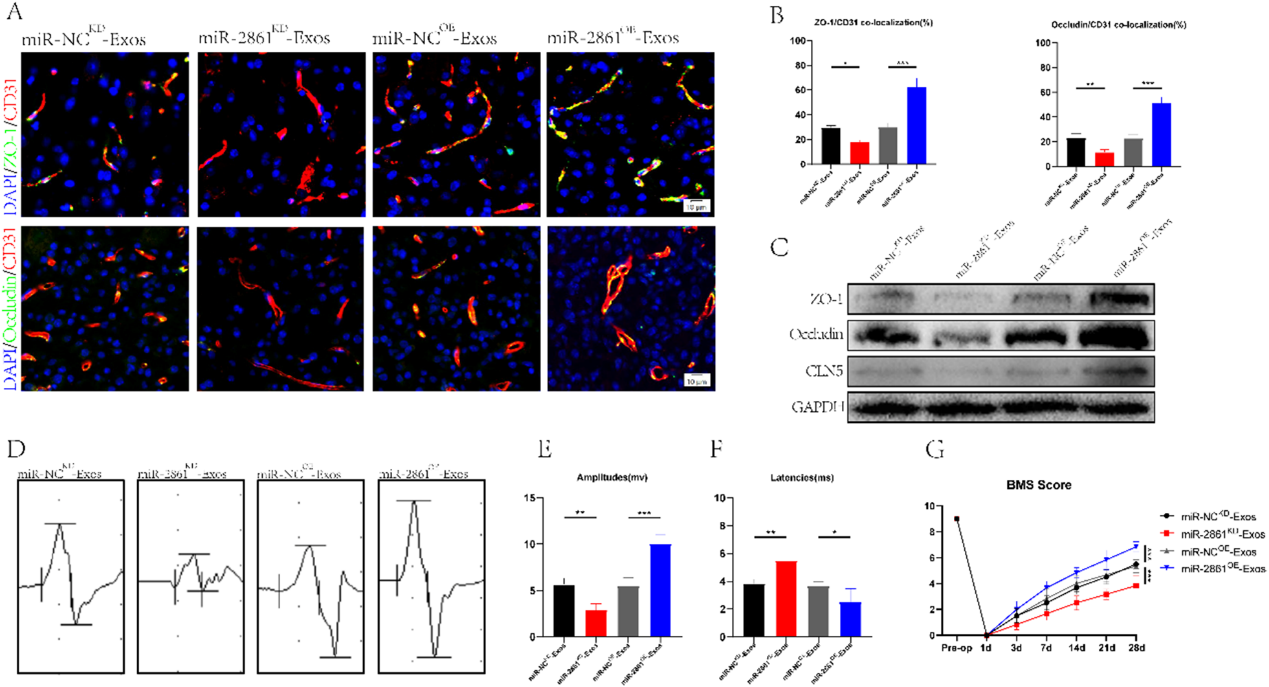
在验证了miR-2861在细胞水平上的作用后,我们试图阐明miR-2861在SCI小鼠体内的功能。我们将外泌体分为miR2861KD-Exos、miR-NCKD-Exos、miR-2861OE-Exos和miR-NCOE-Exos,并将其注射到SCI小鼠体内。我们发现miR-2861KD-Exos组TJs蛋白和血管的共定位强度明显低于miR-NCKD-Exos组,而miR-2861OE-Exos组TJs蛋白和血管的共定位强度高于miR-NCOE-Exos组(图6A, 6B)。这一发现得到了Western blot结果的支持(图6C)。采用行为分析实验观察脊髓损伤小鼠运动功能的改善。MEP和BMS评分分析显示,低表达miR-2861不利于运动功能的恢复,而高表达miR-2861可以增强运动功能(图6D-6G)。总之,我们证实miR-2861可以通过外泌体运输,调节BSCB的修复,从而改善运动功能。
7)miR-2861通过抑制IRAK1表达促进BSCB修复
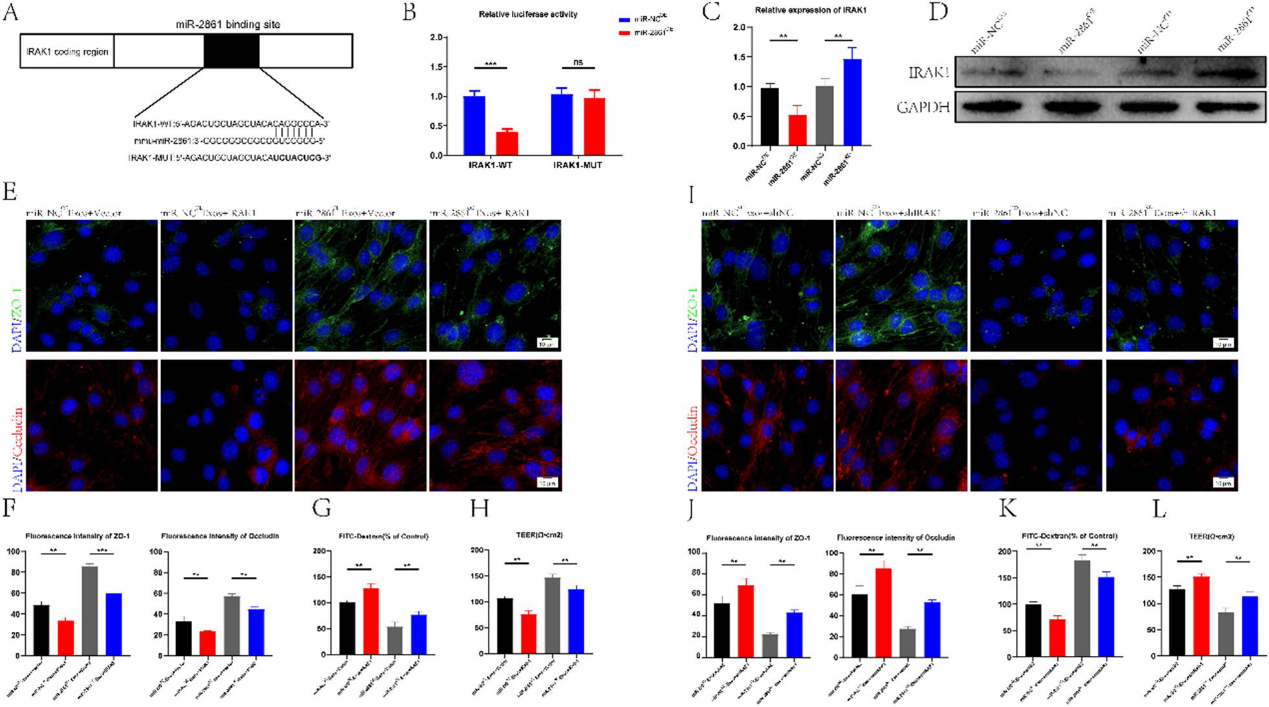
为了进一步探索miR-2861的具体机制,我们利用在线数据库对miR-2861的潜在靶基因进行了分析和预测。其中,IRAK1与炎症有关,其3 ' UTR可能被miR-2861识别并结合。为了验证我们的猜想,基于IRAK1潜在结合位点构建IRAK1野生型(WT)和突变型(MUT) 3 ' -UTR序列(图7A),并与miR-2861序列共转染到bEnd. 3细胞。荧光素酶报告基因分析显示,当WT-IRAK1-3'UTR和miR-2861OE组共转染时,荧光素酶活性显著低于WT-IRAK1-3'UTR和miR-NCOE组。然而,当MUT-IRAK1-3'UTR和miR-2861OE共转染时,荧光素酶活性与对照组没有显著差异(图7B),这表明IRAK1的3'UTR可以特异性结合miR-2861。我们进一步通过qRT-PCR和Western blot验证了miR-2861可以负调控IRAK1(图7C, 7D)。我们设计功能缺失和功能获得实验来进一步研究miR-2861与IRAK1之间的关系以及IRAK1对BSCB的影响。用miR-NCOE-Exos和miR-2861OE-Exos处理过表达IRAK1的bEnd. 3细胞,敲除IRAK1后,用miR-NCKD-Exos和miR-2861KD-Exos处理bEnd. 3细胞。结果表明,IRAK1过表达逆转了miR-NCOE-Exos和miR- 2861OE-Exos诱导的TJs蛋白高表达(图7E, 7F)。IRAK1过表达还逆转了外泌体诱导的FITC-葡聚糖通透性降低和TEER升高(图7G, 7H)。同样,我们发现,敲低IRAK1可消除miR-NCKD-Exos或miR-2861KD-Exos对TJs的有害作用(图7I,7 J)。FITC-葡聚糖通透性和TEER值产生相似的结果(图7K, 7L)。以上数据提示miR-2681可以靶向IRAK1影响BSCB完整性。
结论
本研究发现脊髓损伤后损伤部位有Treg细胞浸润。Treg细胞分泌的外泌体可促进BSCB的修复,降低其通透性,从而减轻浸润引起的兴奋损伤,促进运动功能的恢复。总之,我们的发现揭示了治疗脊髓损伤的新靶点。
实验方法
外泌体分离和鉴定,跨膜电阻测量,渗透率检测,体内渗透性测定,游泳测试,BMS行为学分析,电生理检测,WB,qRT-PCR,免疫荧光,荧光素酶报告试验。
参考文献
Kong G, Xiong W, Li C, Xiao C, Wang S, Li W, Chen X, Wang J, Chen S, Zhang Y, Gu J, Fan J, Jin Z. Treg cells-derived exosomes promote blood-spinal cord barrier repair and motor function recovery after spinal cord injury by delivering miR-2861. J Nanobiotechnology. 2023 Oct 4;21(1):364. doi: 10.1186/s12951-023-02089-6.















