- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
MicroRNA-195与阿兹海默病
发布时间:2020-09-15 08:54 | 点击次数:
ApoE蛋白是脑磷酸肌醇二磷酸(PIP2)稳态的关键因素,ApoE4亚型功能失调会导致AD的认知功能下降。synj1是PIP2降解酶,synj1的降低加速溶酶体降解途径的清除,改善轻度创伤性脑损伤(TBI)诱导的tau蛋白过度磷酸化,挽救ApoE4相关的认知障碍。大脑中synj1水平的增加部分是由于synj1 mRNA不能有效降解,miRNA主要通过结合mRNA 3'URT区域的miRNA结合元件来调节靶基因转录后水平。那接下来这篇文章主要研究miR-195是否调节ApoE4相关的脑PIP2稳态失衡,认知损伤和AD病理。
技术路线图:
研究结果:
1.MiR-195是参与ApoE调控synj1表达的最佳候选miRNA
首先比较了ROSMAP 数据库中ApoE4−/−和ApoE4+/-两种状态中人miRNA谱,鉴定了16个显著差异表达的miRNAs。ApoE3或ApoE4条件培养液(CM)处理的ApoE−/−海马神经元进行了miRNA阵列研究,30个差异表达的miRNAs。在这些miRNAs中,MiR-195是ApoE4+和ApoE4−条件下仅有表达差异的miRNA。数据库预测与synj1 mRNA结合的miRNAs,MiR-195被预测为先选候选miRNA。在所有受试者和女性受试者中,ApoE3+/+携带者MiR-195与synj1 mRNA水平呈负相关。ApoE4+/-携带者中也存在负相关趋势,但无统计学意义,表明ApoE4等位基因存在时MiR-195与synj1的网络调控可能减弱。与MiR-195负相关的靶基因和基因的最高富集功能包括神经元和突触功能的调节、神经发生和分化,而与MiR-195正相关的基因的功能在循环系统和血管发育中富集。总之,这些结果暗示MiR-195在调控ApoE-synj1-PIP2通路中是最佳候选miRNA。
2.大脑MiR-195水平降低与ApoE4基因型、疾病进展和认知能力下降有关
与ApoE4-/-的受试者相比,ApoE4+/-轻度认知障碍(MCI)和临床痴呆评分(CDR)在0.5到1之间的早期AD受试者的顶叶皮层组织中MiR-195水平降低,观察到MiR-195水平随着疾病从正常衰老到MCI和早期AD的进展而降低,女性受试者MiR-195显著低于男性受试者。在CDR(0.5-1)的ApoE4-/-携带者中,大脑MiR-195和PIP2水平呈正相关,在CDR(0-1)受试者中,无论ApoE基因型如何,均呈正相关趋势。脑MiR-195与其他磷脂种类和变量,如PI和磷酸肌醇(PIP),死后时间(PMI),Aβ水平和年龄之间没有相关性。ApoE4基因型MiR-195参与了早期疾病的发生和加速。
大脑和脑脊液MiR-195水平的降低与AD早期发展过程中的ApoE4基因型、认知能力下降和tau病理学相关。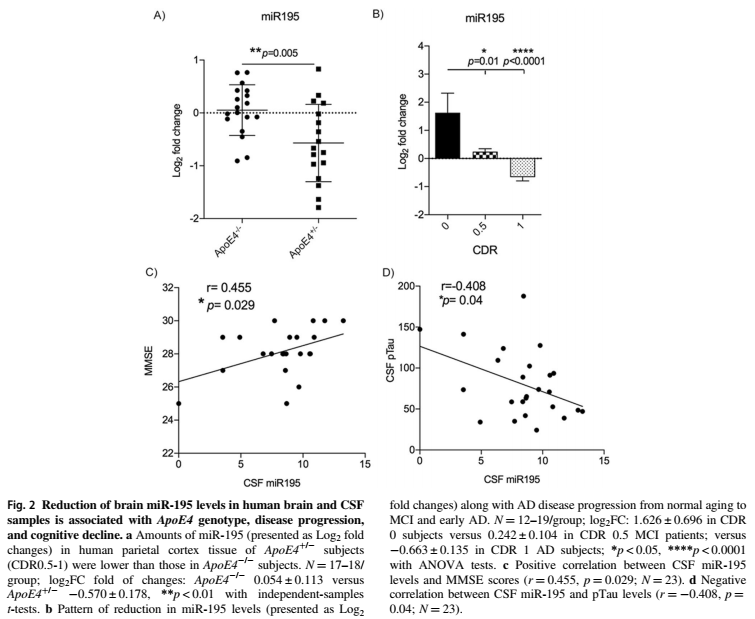
3. ApoE4小鼠脑和培养神经元中,MiR-195表达降低
在小鼠模型和原代神经元中验证。与ApoE3+/+小鼠相比,ApoE4+/+小鼠大脑中的MiR-195水平更低。ApoE-/-脑中MiR-195表达降低。在ApoE-/-海马神经元中,ApoE4条件培养基(CM,来源星形细胞)处理之后MiR-195水平始终低于ApoE3-CM处理。
在ApoE3-CM处理的条件下,RAP(ApoE受体相关蛋白,是ApoE受体的抑制剂)处理导致MiR-195水平降低。而在ApoE4-CM处理的条件下,MiR-195水平在基线时低得多,在RAP处理后呈上升趋势。这些结果表明,星形细胞来源的ApoE可能与神经元上的ApoE受体结合,导致神经元MiR-195的改变,而ApoE4对神经元MiR-195的表达表现出功能缺失的影响。然后我们确定MiR-195的上调是否调节预测靶基因synj1的表达水平。过表达MiR-195可显著降低ApoE4-CM处理的ApoE−/−神经元中synj1蛋白水平。提示MiR-195对synj1表达的特异性作用。同样,在ApoE3+/+或ApoE4+/+神经元中过表达MiR-195,导致synj1 mRNA和蛋白表达下降。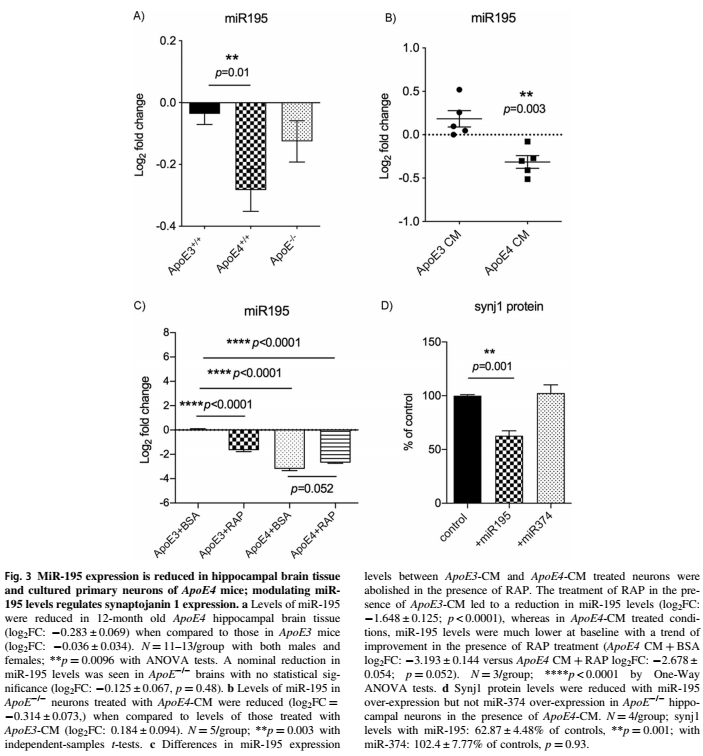
4.在ApoE4小鼠模型中,过表达MiR-195挽救了认知缺陷并改善AD相关的病理
在ApoE4+/+KI小鼠的双侧海马区转染携带MiR-195的慢病毒,ApoE4+/+KI小鼠的识别行为受损完全被MiR-195的过表达挽救。过表达MiR-195也降低了ApoE4小鼠大脑中的p-Tau水平,synj1 mRNA水平和蛋白水平均降低。在过表达MiR-195的ApoE4+/+FAD小鼠中观察到p-Tau,低聚物Aβ42和淀粉样斑块均降低。
GSEA研究表明被MiR-195过表达干扰的最佳通路是线粒体相关通路(研究表明线粒体动力学失衡介导的海马神经元损伤是AD的重要病理机制)。结果表明,在正常或者AD背景的ApoE4小鼠模型中,升高MiR-195水平可以挽救ApoE4和AD相关的认知缺陷和病理改变。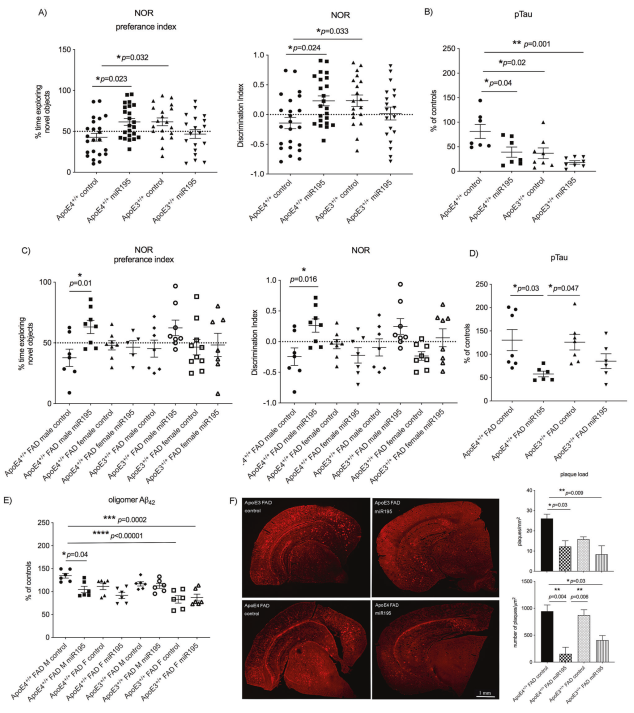

5.ApoE4 AD患者人诱导多能干细胞(hiPSCs)来源脑细胞中,升高MiR-195水平可以挽救溶酶体缺陷
ApoE4+/+神经元中MiR-195的过表达导致溶酶体大小显著减少,p-Tau蛋白水平降低。与ApoE3+/+正常衰老iPSC衍生星形胶质细胞相比,ApoE4+/+AD中培养的iPSC衍生星形胶质细胞中MiR-195水平也较低。在人类iPSC衍生的ApoE4+/+AD脑细胞中,升高MiR-195水平可以挽救溶酶体缺陷,而抑制MiR-195可能加剧这些表型。
过表达MiR-195后,synj1+/+神经元的溶酶体大小从101.5μm2减小到75.8μm2。这表明MiR-195通过靶基因synj1发挥作用,挽救了与受体相关的溶酶体缺陷。这些结果表明,在人类iPSC衍生的ApoE4+/+AD脑细胞中,升高MiR-195水平可以挽救溶酶体缺陷,而抑制MiR-195可能加剧这些表型。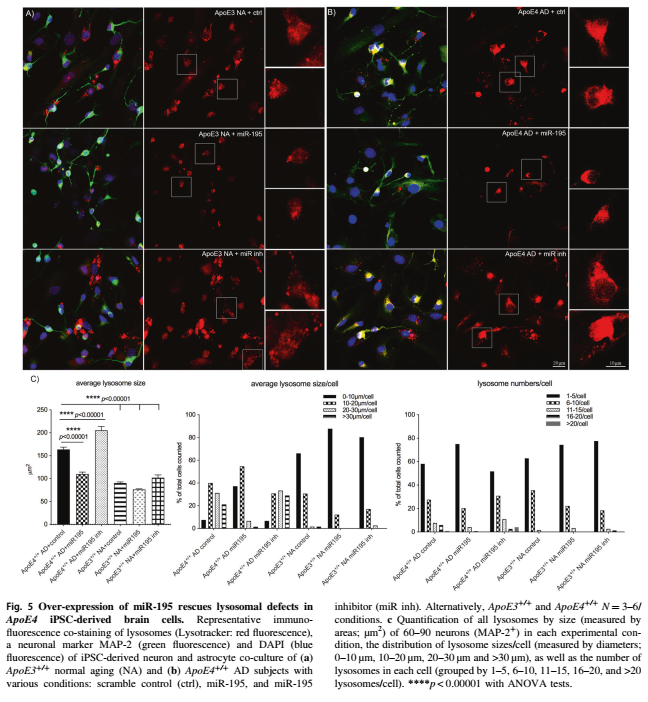
总结:
本研究提供了ApoE4基因型特异性的脑MiR-195表达改变与AD相关表型(包括脑磷脂失调、认知缺陷、溶酶体缺陷和tau病理学)之间的联系。这些研究可能揭示在AD中,针对特定miRNA MiR-195的新的治疗策略。















