应用分享 7—免疫治疗中 TCR 信号的单个分子开关——小分子信号转导开关控制器
导读:
自本世纪细胞免疫疗法出现以来,其在众多肿瘤临床治疗病例中已取得激动人心的成果,难能可贵的是不仅仅是血液瘤,在实体瘤如转移性黑色素瘤和结直肠癌等癌症病例中同样表现不俗。虽然治疗结果振奋人心,但 T 细胞过激反应导致的细胞因子释放风暴(CRS)等剧烈副作用,仍会使病人面临死亡的高风险,这些副作用依然是相关临床试验中一个不可忽视的难题。
为提升细胞疗法的安全性,科学家们目前已开发了多种的用于调控 T 细胞活性的 ON or OFF switch 控制结构,但均存在不同的弊端:可能在清除过激 T 细胞的同时也会清除正常 T 细胞;异常剪切导致自杀基因的表达丢失;或者产生自杀基因抗性。其次,许多控制开关被设计与嵌和抗原受体 CAR 共用,但实验结果显示其并未能协同 CAR 共同激活 T 细胞。此外,上述控制开关皆是单分子控制,无法实现一个开关可同时调控激活与抑制两种功能。
因 T 细胞表面 TCR 分子可识别肿瘤特异性抗原,故而可以用于肿瘤治疗,但 TCR 分子对肿瘤抗原的特异性识别需要配合相应的调控机制以防止如过反应等识别副作用的产生。
Zeta-chain-associated protein kinase 70(ZAP70)是在 T 细胞信号转导过程中具有关键作用的胞质酪氨酸蛋白激酶,当 T 细胞接触到激活信号时,CD3ζ ITAM 发生磷酸化并与 ZAP70 蛋白的 SH2 结构域结合,使得 ZAP70 蛋白发生磷酸化作用并激活下游级联反应。已有研究显示,ZAP70 缺陷型 T 细胞无法执行 TCR 介导的 T 细胞激活反应,表明 ZAP70 对 T 细胞胞内信号转导反应的广泛调控作用,使得其具有开发为相应的调控靶点的潜力。
本文作者设想以 ZAP70 蛋白为基础,开发控制 T 细胞信号激活通路的 ON or OFF switch 结构,并分别使用两种小分子物质来实现此结构的激活与抑制调控作用。
▲实验设计方案
研究者设计了一种全新的由小分子调控的 TCR 信号识别控制结构 ZAP70 signaling switch。为实现对 TCR 刺激信号的调控作用,研究者以天然 ZAP70 蛋白为基础,构造了一种对小分子 4-OHT 敏感的 ZAP70 工程蛋白。通过与雌激素受体 estrogen receptor 片段(ER2)融合,可使得 ZAP70 蛋白暂时性功能失活。此结构可被 4-OHT 分子调控用于 TCR 活化信号的协同控制,同时也可被 3-MB-PP1 分子调控用于关闭 TCR 分子的信号识别功能。通过改变小分子激活剂以及抑制剂的浓度条件,可实现对早期 T 细胞信号转导过程的信号强度快速调控。
通过 linker 将 mCherry 荧光蛋白与 ZAP70-ERT2 蛋白复合物相连,用于监控 ZAP70-ERT2 的胞内表达水平,同时用于 P116(ZAP70 缺陷型 Jurkat 细胞)工程细胞的成功表达群体的流式分选。
▲TCR 信号过激反应调控
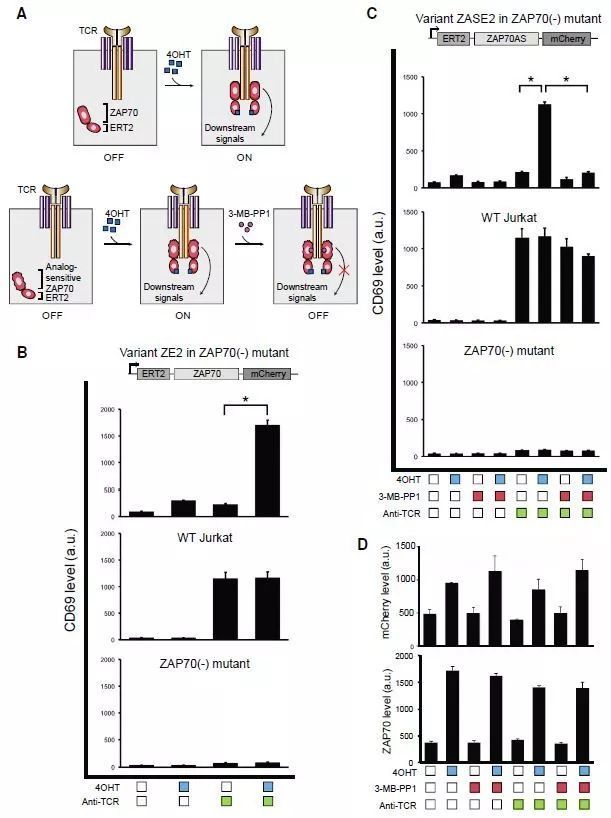
作者首先研究了两种小分子对上述设计的 ZAP70 复合蛋白是否具有调控作用。如上图结果显示,4-OHT 的添加可诱导 ZAP70 将 TCR 接受到的刺激信号,继续传导至下游,上调 CD69 marker 的表达水平;同时对照实验组显示 4-OHT 的添加,对于野生型 Jurkat 细胞以及 P116 细胞(ZAP70 缺陷型)没有显著的 CD69 表达上调作用,证实了 ZAP70-ERT2 蛋白结构对于 TCR 刺激信号的特异性调控功能。
ZAP70 蛋白的激酶结构域序列中,存在一个功能关键的保守 AA 序列 Met,将 Met 位点突变为 Ala 后,此突变株可被 ATP 结构类似物 3-MB-PP1 分子结合,抑制其激酶结构域活性,因此 3-MB-PP1 分子可作为 ZAP70 蛋白突变株 (ZAP70-AS) 的 TCR 激活功能抑制剂。
功能验证实验结果显示,ZAP70-ERT2 与 ZAP70-AS-ERT2 均有 TCR 激活信号的正向调控作用,但仅有 ZAP70-AS-ERT2 蛋白具有 TCR 激活信号的负向调节功能。有趣的是,当使用 ZAP70-AS 正向调控 TCR 激活信号后,可以检测到胞内钙流与 CD69 marker 表达上调,然而细胞因子 IL-2 表达量没有表现出明显差异,可能意味着 ZAP70-AS-ERT2 调控结构具有某些还未明确的细胞活动限制功能。
▲胞内钙流动力学监测
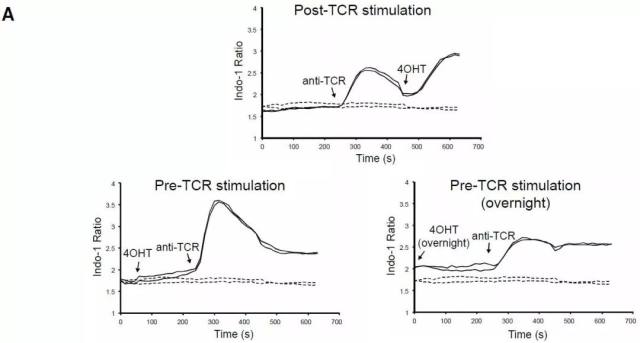
作为反映细胞内生理代谢变化的快速指标,胞内钙稳态是一项极其重要的参数指标。当细胞接受相应的信号刺激后,蛋白信号反馈至基因水平,再转化为相应效应作用的过程一般较为漫长,而胞内钙离子浓度则相对极为敏感,具有迅速有效的变化表现。
研究者使用 Jurkat 细胞转染 ZAP70-AS-ERT2 蛋白复合物,同时孵育 Indo-1 AM 钙流探针分子。通过设计不同时间点分别添加 4-OHT 与 3-MB-PP1 分子,当 TCR 接受到抗原刺激信号后,结果显示 4-OHT 分子可以在 2 min 内显著提升胞内钙流。
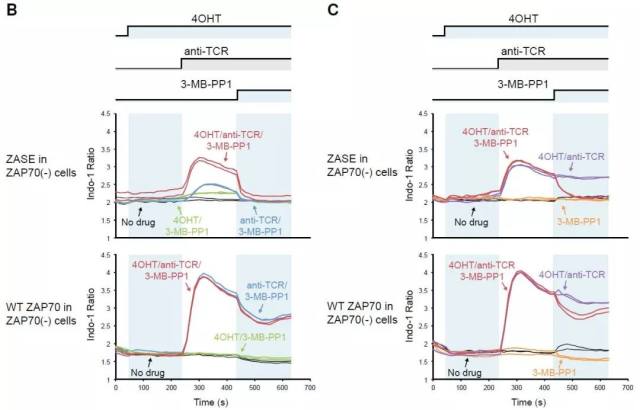
通过测试不同的 4-OHT 与 anti-TCR C305 抗体组合,当仅有 4-OHT 分子存在时,钙流未见变化,同时在仅有 C305 抗体的存在下,钙流仅见轻微提升,上述结果确认了 ZAP70-AS-ERT2 结构的 TCR 信号调控作用需要两个上述两种物质的同时参与。
早期研究显示 3-MB-PP1 分子具有快速抑制 ZAP70-AS 蛋白调控活性的功能,通过预孵育 4-OHT 和 C305 抗体,再添加 3-MB-PP1 分子后可见胞内钙流于 1 min 内迅速下降;仅添加 3-MB-PP1 分子的对照组结果显示胞内钙流未见明显变化。尽管未见完全抑制作用,但上述结果已可证实 3-MB-PP1 分子对 ZAP70-AS 蛋白的 TCR 信号调控具有快速的抑制作用。
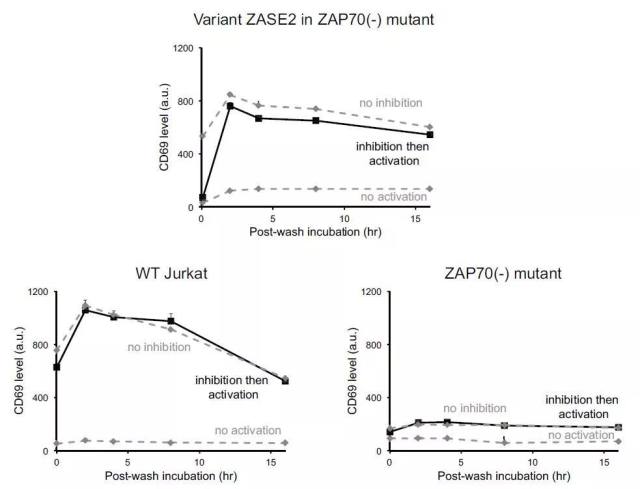
为确认 ZAP70-AS-ERT2 蛋白在被 3-MB-PP1 分子抑制功能活性后,是否仍可继续被 4-OHT 分子激活 TCR 信号调控功能,研究人员继续安排了相应的验证实验。实验结果显示,在抑制 ZAP-70 蛋白活性后,通过添加孵育 4-OHT 分子,CD69 marker 表达水平可见又恢复平稳提升,证实 3-MB-PP1 分子与 ZAP70 蛋白间为结合可逆的反应过程,ZAP70 蛋白可在激活剂与抑制剂间进行相应的功能自由切换。
▲TCR 活性调控
由于临床治疗中病人体内的 T 细胞活化水平呈现为动态变化的过程,为精确验证 ZAP70-AS-ERT2 复合体对于 TCR 活化信号的刺激与抑制功能,作者设计了 dose-response 实验,以 CD69 marker 表达水平为监测指标,监控 4-OHT 和 3-MB-PP1 分子的动态调控能力。
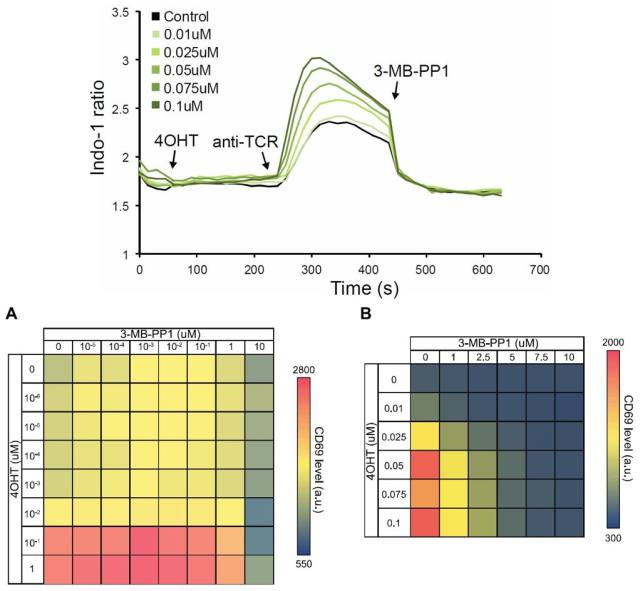
如上图图显示,对于 4-OHT 分子,0.01-0.1 μm 的浓度范围即可实现 ZAP70-蛋白对于 TCR 刺激信号的显著调控作用;同时在 0-10 μm 的抑制浓度范围内,7.5 μm 的 3-MB-PP1 分子浓度足以完全抑制 ZAP70 蛋白的信号活化作用。钙流实验结果同样支持 CD69 marker 表达水平提升的实验结论。
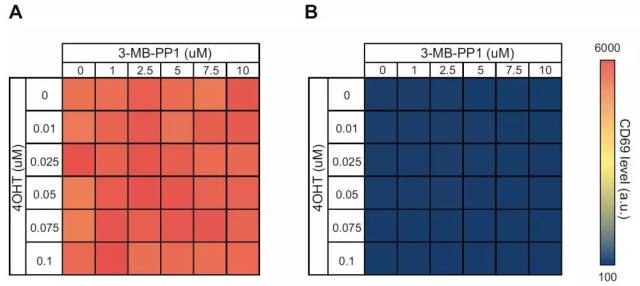
在对照组中,相同剂量的两种小分子对于野生型 Jurkat 细胞以及 P116 细胞均没有显著性地激活以及抑制作用。
▲结论和亮点
1. ZAP70-AS-ERT2蛋白复合体是目前第一种可由两种独立的小分子分别控制激活与抑制功能的TCR信号调控开关,实验已证实ZAP70-AS-ERT2蛋白复合体可参与调控早期的T细胞信号激活通路。
2. 目前4-OHT分子与ZAP70-AS-ERT2蛋白复合体结合作用的激活功能机制还不清楚,与CAR结构无法在同一个细胞中相容工作的原因也不明确。
3. 实验设计中Jurkat工程细胞以及缺陷型P116细胞的筛选工作,是在Sony智能型全自动流式分选仪SH800S上完成的,为重要的细胞模型的建立提供了坚实的基础。
4. ZAP70信号调控结构可调节CD69分子以及胞内钙稳态表达水平,但对下游IL-2细胞因子释放等细胞信号没有显著的调控能力,表明ZAP70 signal switch在用于适应性T细胞疗法前还需做进一步的机制探索。
Reference:
1. Nicole Wong et al., (2018) Engineering a dual small molecule gated ZAP70 switch in T cells for immunotherapy,ACS Synth. Biol., DOI: 10.1021/acssynbio.7b00394.
2. Levin S. E. et al., (2008) Inhibition of ZAP-70 kinase activity via an analog-sensitive allele blocks T cell receptor and CD28 superagonist signaling, J Biol Chem 283, 15419-15430.
图片来源:索尼生物
公司介绍

索尼公司生命科学业务部前身为 1995 年成立于美国伊利诺伊州立大学创新研发中心的 iCyt Mission Technology,迄今为止拥有 24 年的研发历史,iCyt Mission Technology 于 2010 年被索尼集团全资收购成为独立子公司。
联系我们
公司地址:上海浦东新区居里路 361 号
联系电话:021-61216282, 18521790856
传真::021-61216128
邮箱:Tony.Yu@sony.com
邮编:201203
