流式大牛在线畅谈高阶流式分选技巧——上篇
在 3 月 14 日 Sony Biotechnology 邀请两位流式领域的资深专家 Dr. Peter Lopez (Director, Cytometry and Cell Sorting Lab, NYU Langone) 和 Dr. Rui Gardner (Director, Cell Sorting Lab, MSKCC),举办了一场异常火爆的流式分选线上交流会。会上两位嘉宾呈现了令人沉醉的生动演讲,同时各位听众也踊跃提问,交流气氛十分热烈。
现在,我们将当天的 webinar 总结成下面的中文干货,按两位嘉宾的演讲内容译为上下两篇,以供当时未能参与的其他小伙伴们飨用,快来一起看看吧~
本次 webinar 主题是「在分选实验中分选速度,回收率和纯度如何影响最终的分选结果;进行分选实验条件优化时需要考虑哪些因素;以及不同仪器的性能参数对分选结果有何影响」,此外,大家也可以了解到如何设置孔板分选并获得理想的单细胞分选结果。
Lopez 博士:本次交流会,我将按照 outline 所列内容,依此与各位讨论 cell sorting 的三个基本概念(分选仪类型,分选模式的选择,和分选过程中的细胞应激反应),和分选实验需要仔细考虑的一些实验细节(细胞种类,数量与分选模式;样本处理条件优化;仪器分选参数设置)。
▊ 流式分选技术发展史
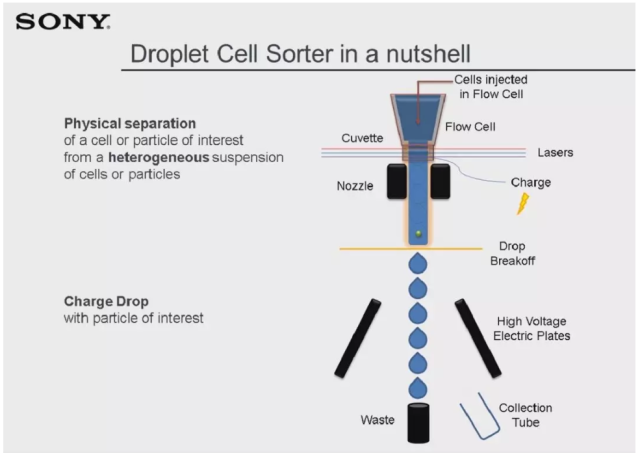
经过半个世纪的不断发展进步,如今的商品化流式分选仪已经发展出不同的工作原理和使用方式。目前市场上最常见的流式分选仪是基于加电式液滴分选原理,系统通过喷嘴产生高频震荡,将连续液流断裂为独立液滴,含有目的细胞的液滴将被系统加电,并随后被分选到相应的收集管中。这其中通过区分荧光激发方式,又可以将 sorter 分为三类:70 年代最初发展的空气激发式(jet-in-air)和 90 年代的石英杯激发式(cuvette),以及最新的基于微流控芯片的立体激发式分选,分别以 Beckman Moflo、BD FACSAria 和 Sony SH800S 系列为代表。

与此同时,在流式领域中也有一些特殊应用的分选仪,如微流控分选仪和大颗粒分选仪。对于微流控分选仪而言,液流系统更加温和,因此对细胞损伤也更小,与此同时其分选速度会随着液流压力的减小而降低;对于大颗粒分选仪来说,使用空气驱使细胞样本流动,当检测到目的细胞时系统切断压力供应,可使目的细胞顺利进入收集管内,并实现 100 um – 1 mm 直径的细胞分选。
对于加电式液流分选,其液流工作由流体动力学的基本原则驱动,这一现象最早由 19 世纪的 John William Strutt Rayleigh 发现。样本细胞在流动室中与鞘液汇合并被其包裹,逐个细胞稳定通过激光光斑照射并被软件收集荧光信号与散射光信号。经过液流断裂为独立液滴后,包裹有目的细胞的液滴经过系统加电后通过电极板发生偏转,最终进入到收集管中。其中,喷嘴的直径大小和液流通过喷嘴的流速决定了形成液滴的频率;在特定频率下喷嘴振幅的大小又决定了液滴断点的位置。以上条件决定了一台分选仪最终可以达到多大的分选速度以及能分选多大尺径的细胞样本。
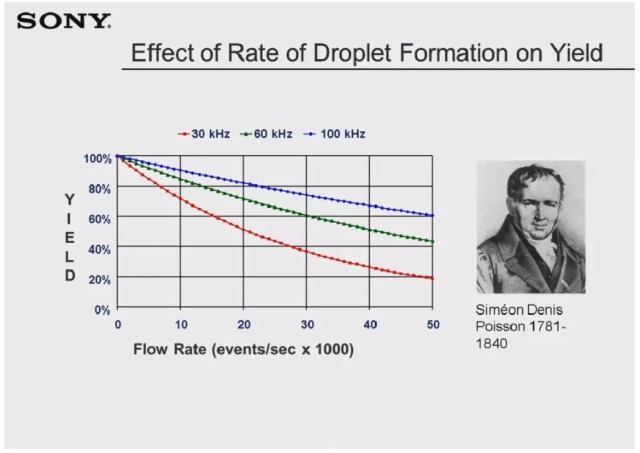
另一个影响分选结果的重要因素是冲突事件的发生几率。从仪器硬件方面来说,当两个细胞接触极近,在通过激光照射时可能会被仪器误认为一个细胞;从分选软件方面来说,选择不同的分选模式,可获得不同的分选结果。当一个液滴中含有多个细胞时,有极大的可能导致目的细胞不符合分选条件从而被丢弃。提高每秒的液滴形成数目,可有助于解决上述问题,如 slide 中图片显示,Poisson 于 19 世纪提出泊松分布规律,此规律后被发现可用于描述流式分选实验中流速、频率和分选回收率三者之间的相互关系。从中可以看出,当我们提高液滴震荡频率,可有助于提高样本回收率。
▊ 分选模式的选择
每台分选仪都会为操作者提供不同的分选模式,以满足相应的实验需求。一般地,流式分选模式可分为三类:富集模式、纯度模式和单细胞模式。富集模式目标是捕获所有的目的细胞,即使分选液滴中存在有非目的细胞,因此 yield/enrich mode 可用于此类实验;纯度模式要求分选液滴中只含有目的细胞(单个或多个细胞均可),当液滴中出现其他非目的细胞时,此液滴将被丢弃,故而我们需要选择 purity mode;单细胞模式要求分选液滴中有且仅有一个目的细胞,single cell mode 即可提供上述功能需求,一般用于单细胞克隆建系实验。实际分选实验中,速度、纯度和得率三者之间无法同时满足,需要操作者权衡一下上述分选模式,挑选合适的分选条件。
在分选结束后,我们需要对获得的细胞重新上样分析,确定真正的目的细胞纯度,以此来评估分选结果的纯度高低。纯度回测可在同一台仪器进行(仪器管路需要在回测前进行充分地清洗以去除残留细胞的干扰),也可另选一台仪器进行回测。回测过程中,我们可能会碰到以下两种情形:sorted population 中有多少 event 属于非目的群体?在 sorted population gate 之外又有多少 event 出现?需要留意的是,某些荧光素可能会因为荧光淬灭现象,在回测过程中表现出荧光强度降低的结果。

▊ 分选实例讲解
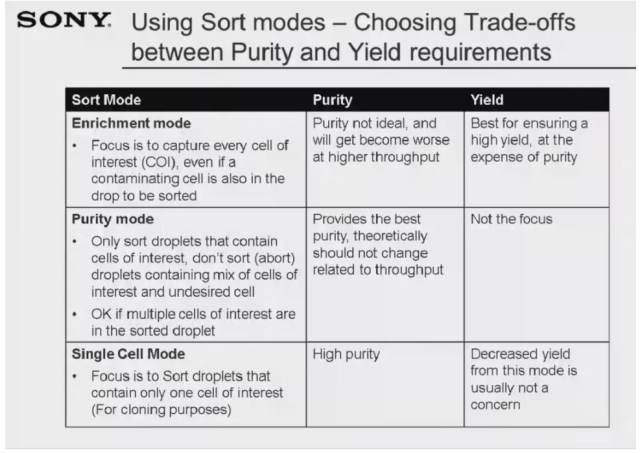
下面我们来看一组分选实验案例,通过这组分选数据详细介绍分选过程中的设门策略,目的细胞的圈定和分选后的纯度验证。大家可以从 slide 中看到,本组数据共展示了五张图片,plot A 是散射光数据图,我们可以根据 FSC 和 SSC 两个参数,将目的细胞群体从碎片和死细胞群体中区分出来,即 gate R1 为目标群体。Plot B 用于去除黏粘细胞,使用 SSC-W 和 SSC-A 两个参数,可显示单细胞群体(gate R2)和黏粘细胞群体。Plot C 用于辨别细胞活性,通过使用细胞死活染料 PacBlue 来标记样本,在荧光图中可看到死细胞因为被标记上荧光染料从而显示出强的荧光信号,这一部分绝对不是我们想要的群体,因此可设门 R3 来选定活细胞。Plot D 用于显示荧光染料 PE 的表达强度,选定高表达区域后可设门 R4 来圈定细胞。最后,Histogram E 用于圈定最终的目的细胞,我们分别选定低强度区域和高强度区域,设定目标分选群体为 R5 和 R8 并开始分选。
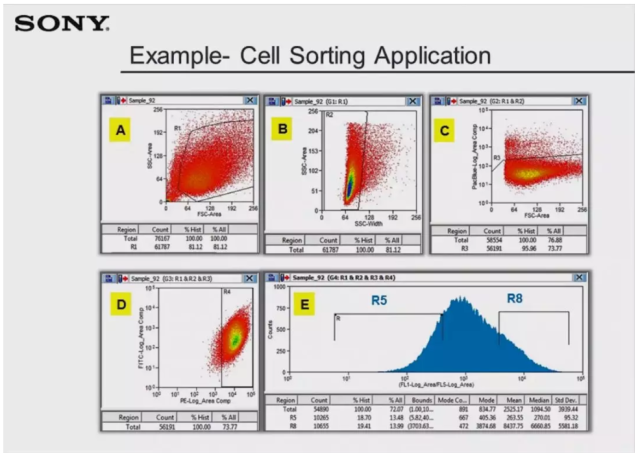
分选完成后,让我们来看一下两个群体的分选结果。首先是 R5 群体,从 Histogram E 中可看到,R5 群体比例为 80%,有部分细胞漂移到 gate R5 右侧,这可能是由分选样本中存在非 R5 群体细胞导致的。Plot C 显示样本中几乎没有死细胞存在,但是此份回测样本没有重新经过死活染料染色,所以若想分析真实严格的活性比例,可在回测前再添加一些死活染料进行染色。同时在 Plot A 中,也可以看到在仍会有一些细胞出现在 gate R1 门外,这部分细胞可能是分选后因为损伤导致的,也有可能是管路清洗不彻底而残留下来的。
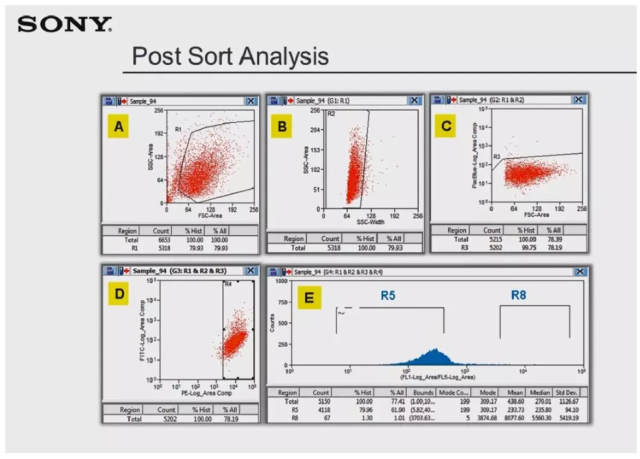
接下来是 R8 群体的回测,数据显示回测结果与 R5 回测结果极为相似,由于没有继续添加死活染料染色,故而无法判断 Plot C 中是否还有死细胞未显示出来。Plot A 显示仍有部分细胞出现于 gate R1 之外,可能是因为样本残留导致。最关键的数据是 gate R8,其比例为 80%,约有 3% 的 events 出现在 gate R5 中,预计是因残留出现的;余下 events 处于 R5 和 R8 之间,这部分细胞则是因为流式数据统计过程中的信号漂移以及荧光淬灭现象产生的。
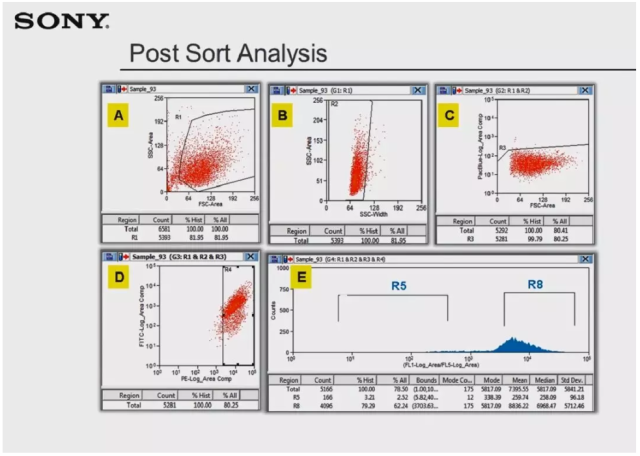
以上便是分选实验的一般纯度回测过程。
▊ 衡量分选效果的指标
根据上述分选数据我们可以得知,评估分选结果是否成功,可以参考以下三个参数:目的细胞纯度,预期目标可以设为 99.9%,当然实现这一目标,需要考虑具体的分选操作、仔细设定圈门策略、添加死活染料去除死细胞干扰等众多因素;目的细胞回收率,由分选得到的 events 数量除以所有目标细胞数量得到,可在分选仪的操作软件中实时观察到这一参数,回收率的高低一般取决于分选模式的选择和分选条件的设定;分选速度,一般有两种表述形式,一是每秒通过激光束检测的 events 数量,二是每秒分选到的 events 数量,当使用分选速度描述实验时需要清楚是哪种形式的分选速度.
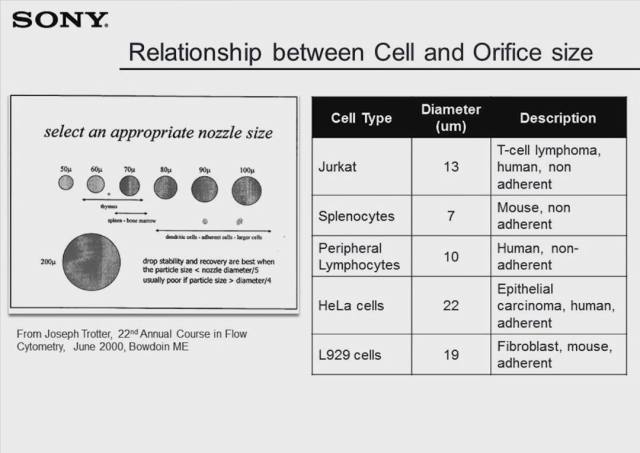
在分选实验中还有一个关键的因素是待分选细胞的直径,这直接关系到机器使用的喷嘴的直径大小。Slide 中列出了常见的一些细胞系的直径大小,左图则直观地展示了多数细胞类型和分选喷嘴的对应关系。一般地,待分选细胞的直径要小于喷嘴直径的 1/5。如果喷嘴直径过小,震荡产生的液滴也将随之变小,即可能导致细胞受应激反应,或者液滴飞溅至电极板上,稍后 Gardner 博士会详细讨论这一现象。
▊ 分选优化策略
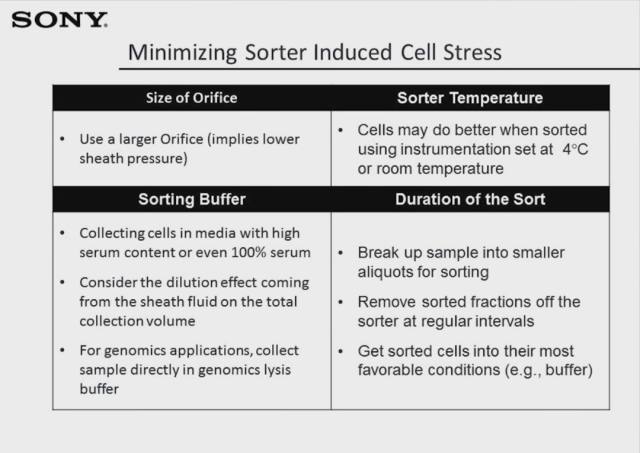
SICS 也叫 sorter induced cell stress,即因分选过程而引起的细胞应激反应,导致细胞在分选过后细胞功能发生变化,甚至引起细胞死亡。这一现象偶尔会在分选实验中发生,并非一直存在,其主要原因一般是选用了错误直径大小的喷嘴,这可能会在分选过程中直接对细胞群体造成损伤。引起细胞应激的因素有很多,当我们将所有的因素全部排除之后,若这一情况仍然存在,此时我们该考虑使用其他的分选技术来分离目的细胞了。
下表是常见的导致 SICS 现象的排除因素:使用更大直径的喷嘴,来产生更大直径的液滴;摸索分选过程中的环境温度,4℃ 或者室温可能对细胞状态有重要影响;更换分选收集 buffer,提高 buffer 中 serum 比例,或者直接使用 lysis buffer 作为收集液(当需要测序时);如果分选时间很长,可以将样本分为几个小份,每次分完一份后迅速将细胞转移至培养环境中以及时恢复细胞状态。
◂ Q&A 环节 ▸
Q1:我们该怎么使用 FMO 对照来设置 gate?
Gardner 博士:FMO 对照的使用和补偿分析是完全一样的,在一个多色样本中,FMO 对照是用于排除其他几个荧光素对于某一特定通道的信号干扰,可以精确地区分阳性群体和阴性群体的界限。那么同样地,在分选实验中,如果存在多个 population,我们想避免多个 population 间的相互干扰,也可以使用 FMO 对照来精确界定目的细胞群体的 gate 区域,保证分选设门的准确性。
Q2:R8 gate 是依据什么条件设置的?
Lopez 博士:R8 和 R5 gate 的选择仅仅是用于演示在同一个 marker 荧光素的表达参数下,如何回测并且判断仪器的分选性能。在这个特定 case 中,我们需要同时分选高表达区域和低表达区域,这两部分群体是之前的实验中早已验证过的结果,所以设门很迅速。对于一个全新的实验,我们还是依据实际的染色情况选定目的群体。这其中由许多方式来选择,例如 marker 表达很连续(像 CD25),建议还是参考 FMO 对照确定阴性界限,以此来设定准确的 gate 区域。
Q3:您推荐在回测前对样本管路做彻底的清洗,受污染的管路看起来是什么样的呢?
Lopez 博士:我们可以在分选完成后,跑上一管 DI water,如果散点图中出现类似于分选样本的 events,那么可以判断这是管路残余导致的。在这种情况下,我们可以直接在另外一台流式仪器上进行回测,或者也可以选择使用 bleach buffer 以及 DI water 清洗原来的仪器管路,然后仍在同样的仪器上回测样本,虽然这可能会耗费一点时间。
▊ 多功能自动化分选平台 MA900
Soni 博士:我要对 Lopez 博士的精彩演讲表示感谢,同时也要为各位听众介绍我们 Sony 最新款的智能型多功能自动化分选平台 MA900,具有基于微流控芯片技术的高度自动化校准功能,可以实现 12 色检测和 4 路分选,以及 96/384 孔板分选等强大功能,让分选实验更加简单。若各位想继续了解我们的产品,请访问 www.sonybiotechnology.com 网站查看更多产品信息。

图片来源:索尼生物
公司介绍

索尼公司生命科学业务部前身为 1995 年成立于美国伊利诺伊州立大学创新研发中心的 iCyt Mission Technology,迄今为止拥有 24 年的研发历史,iCyt Mission Technology 于 2010 年被索尼集团全资收购成为独立子公司。
联系我们
公司地址:上海浦东新区居里路 361 号
联系电话:021-61216282, 18521790856
传真::021-61216128
邮箱:Tony.Yu@sony.com
邮编:201203
