中国结构生物学家发力:揭示新冠病毒侵染人体细胞瞬间
药物研发和基础研究都是漫长的过程,也许直到新冠疫情结束,我们都无缘看到特效药问世。但是新冠病毒表面蛋白与人体细胞受体复合物结构的解析,毫无疑问为后续一系列工作打下了一个坚实的基础。人类面临着来自病原微生物愈发严重的挑战,只有居安思危,持之以恒的努力,基础研发的强大,才能让我们少一些措手不及。
来源 | 西湖大学、清华大学
ACE2 与 S 蛋白的前世今生
新型冠状病毒引发的肺炎疫情,让冠状病毒、S 蛋白、ACE2 这些冷僻的生物学名词再次进入公众视野。研究发现,新型冠状病毒感染人体细胞的关键在于冠状病毒的 S 蛋白与人体 ACE2 蛋白的结合。准确地说,是 S 蛋白「劫持」了原本用于控制血压的 ACE2,通过与它的结合入侵人体。
S 蛋白全称为 spike glycoprotein (刺突糖蛋白),位于新冠病毒最外层,像一个个突起的「皇冠」。根据美国德克萨斯大学奥斯汀分校研究团队的最新解析结果,新冠病毒 S 蛋白以三聚体形态存在,每一个单体中约有 1300 多个氨基酸,其中 300 多个氨基酸构成了「受体结合结构域」(receptor-binding domain, RBD),即 S 蛋白与 ACE2 相联结的地方。
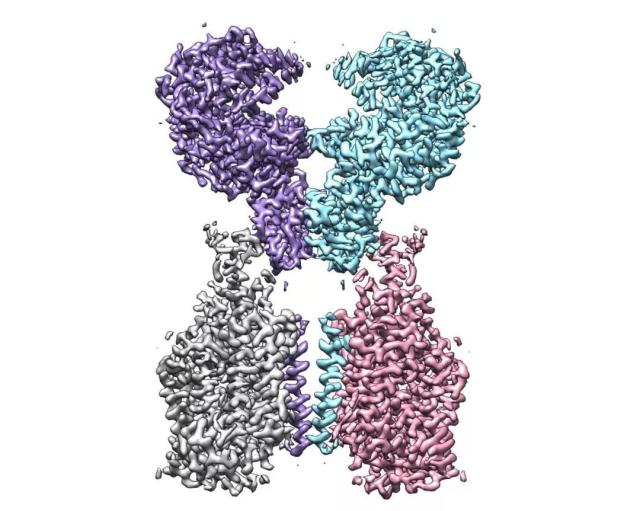
ACE2-B0AT1 复合物的冷冻电镜密度图
ACE2 全称为「血管紧张素转化酶 2」,是人体内一种参与血压调节的蛋白,广泛存在于肺、心脏、肾脏和肠道等部位。一个人体细胞的蛋白,怎么会与病毒发生联系?西湖大学特聘研究员陶亮用了一个形象的比喻:「如果把人体想象成一间房屋,把新冠病毒想象成强盗,那么,ACE2 就是这间房屋的『门把手』;S 蛋白抓住了它,病毒从而长驱直入闯进人体细胞。」
S 蛋白如何抓住「门把手」ACE2
虽然 S 蛋白和 ACE2 是敌我双方接触的最前线,但在此次疫情暴发前,科学家们从未看清 ACE2 的全貌及 ACE2 与新冠病毒 S 蛋白的相互作用。
两天前,西湖大学周强实验室在世界范围内率先报道了 ACE2 全长蛋白的高分辨三维空间结构(西湖大学团队成功解析新冠病毒细胞受体的空间结构),随后,他们进一步解析出 ACE2 全长蛋白与新冠病毒 S 蛋白受体结合结构域的复合物结构,整体分辨率 2.9 埃,其中 S 蛋白受体结合结构域(RBD)部分的分辨率为 3.5 埃。这一研究成果揭开了新冠病毒入侵人体细胞的神秘面纱,已于北京时间 2 月 21 日凌晨发表于论文预印本网站 BioRxiv (https://www.biorxiv.org/content/10.1101/2020.02.19.956946v1)。
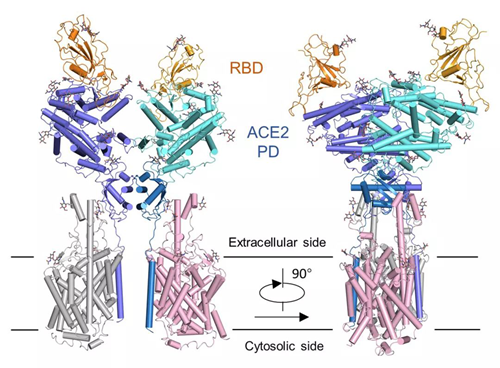
RBD-ACE2-B0AT1 复合物结构图
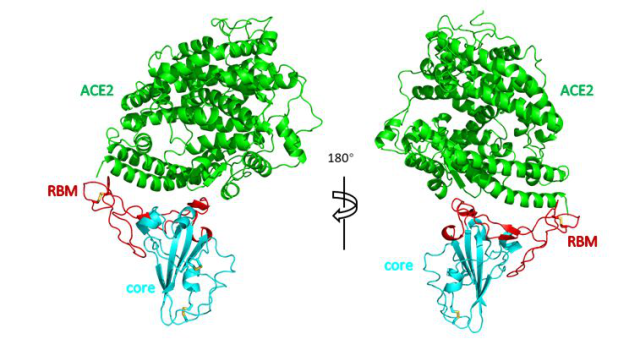
周强实验组发现,在形态上,新冠病毒的 S 蛋白像一座桥横跨在 ACE2 表面,又像病毒的一只手,紧紧抓住 ACE2,这一点与 SARS 病毒很相似。新冠病毒 S 蛋白的受体结合结构域与 SARS 病毒的序列也非常像,相似性达到 82%。
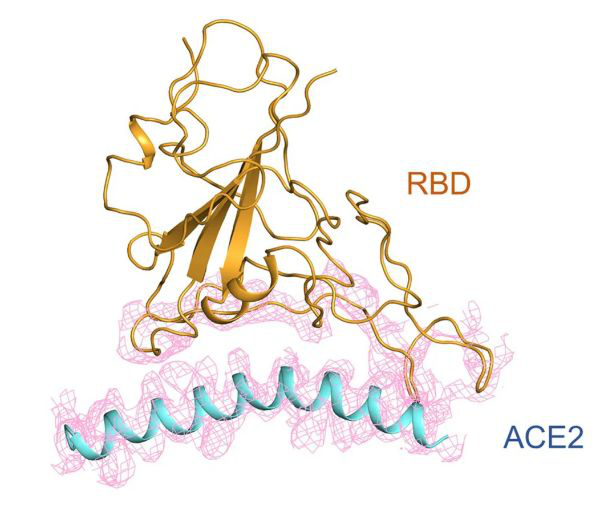
RBD 和 ACE2 的相互作用示意图。
进一步分析,研究人员可以看到新冠病毒表面的 S 蛋白到底是由哪些氨基酸与 ACE2 相互作用。对比此前已经解析出来的 SARS 病毒与 ACE2 的相互作用,新冠病毒 S 蛋白有一部分氨基酸残基发生了较大改变。这也许可以解释为什么新冠病毒和 SARS 与 ACE2 的结合能力不一样,这种结合能力可能影响了病毒的传染力。最近有报道,新冠病毒与受体的结合能力强于 SARS,但仅利用了单一的测量手段,并且对照实验并不严谨,所以究竟是增强还是减弱,还需要通过其他实验手段验证。
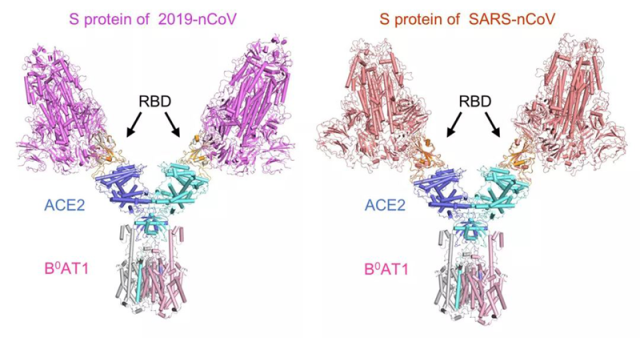
在周强团队利用冷冻电镜研究 RBD 与全长受体结构的同时,晶体学家们也在紧锣密鼓地攻坚同一问题,力求获得更高的分辨率。清华大学王新泉和张林琦课题组利用昆虫细胞体系表达和纯化了新冠病毒 RBD 和人 ACE2 胞外结构域,成功生长出新冠病毒 RBD-ACE2 复合物的晶体,并利用上海光源 BL17U 线站收集了分辨率为 2.45 埃的衍射数据,解析其三维空间结构。这一研究成果刚刚也已经在 bioRxiv 发出 (https://www.biorxiv.org/content/10.1101/2020.02.19.956235v1)。
就在昨晚,中国科学院微生物研究所齐建勋研究团队也将 2.5 埃的类似晶体结构发布在国家微生物科学数据中心。这一系列成果互相验证、互为补充,在原子水平揭示了新冠病毒入侵人体细胞的第一步。
正如张林琦教授所说:「病毒进入细胞,再到复制,最后产生它的子孙万代——从整个病毒的生命周期来看,『病毒如何进入细胞』这一步非常关键。」病毒表面蛋白是病毒进入细胞的关键「钥匙」,可以打开细胞受体蛋白的「锁」,从而进入细胞并启动其复制过程。机体的保护性抗体反应,就是在识别和阻断这把「钥匙」与「锁」的结合,从而阻断病毒进入细胞。现在疫苗研发的关键靶点就是针对新冠病毒的这把「钥匙」展开的。「因此,在原子分辨率水平极其清晰地看新冠病毒与受体复合物作用界面的信息,对了解新冠病毒进入细胞或者感染细胞的机制,具有重要的指导意义」。
基于结构设计,筛选能够阻止 RBD 与 ACE2 结合的抗体或者小分子药物。这是一个相对漫长的过程,因为迄今为止能够有效抑制新冠病毒的特异性抗体和药物都还在筛选和验证过程中,这需要更多科学家不断的努力。甚至在疫情结束之前,都不会有特效药问世。但是复合物结构的解析,毫无疑问为后续一系列工作打下了一个坚实的基础。以史为鉴,我们期待着,即使在新冠疫情结束之后,相关研究也不要停滞。人类面临着来自病原微生物愈发严重的挑战,只有居安思危,持之以恒的努力,基础研发的强大,才能让我们少一些措手不及。
文章来源:微信公众号「西湖大学 Westlake University」
* 本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(邮箱:wj.hbd@dxy.cn),我们将立即进行删除处理;同时转载内容不代表本站立场。
联系我们
为更好地保障疫情防治需要,丁香通诚邀您提供相关信息,不限于:可供应产品信息、捐赠意向、技术资料等内容,请通过邮件 biomart@dxy.cn 联系我们!
直击抗疫科研前线,丁香通与你同在!
