肠道类器官在精准医学中的应用
摘要 类器官 3D 培养是一种新兴的用来研究组织成体干细胞生长、分化、器官形成的体外研究系统。肠道类器官的 3D 培养是将分离的肠道隐窝或干细胞植入含有多种生长因子的基质胶中,在基质 3D 支撑下生成具有肠道上皮样结构的微型空心球体,这些球体被称为肠道类器官。该类器官包含有所有种类的肠道功能上皮细胞,能较大程度模拟肠道组织,故也称之为「迷你肠 」。结直肠肿瘤细胞也可以利用该 3D 体系培养得到肿瘤类器官。这些肠道类器官可被广泛应用于炎症性肠病、肠道损伤再生、肠癌等多种肠道疾病的研究。本综述讨论了关于肠道干细胞的研究新进展,正常类器官和肿瘤类器官的培养,同时还将探讨类器官在疾病建模和组织再生、基因修复、肿瘤个性化治疗等精准医学方面的应用。
关键词 肠道干细胞,类器官,肿瘤类器官,3D 培养
近年来,肠道干细胞成为肠道损伤再生、肠癌等多种肠道疾病研究的焦点。目前 Lgr5(leucine-richrepeat-containingG-proteincoupledreceptor5)是公认的肠道干细胞标志物 Lgr5+ 干细胞对维持正常肠道上皮结构起着至关重要的作用。研究表明 , 离体的肠道干细胞(intestinalstemcells)和隐窝(crypts)可以在加入适当的生长因子作用下 , 在基质胶(matrigel)中经由 3D 培养模式形成肠道类器官(organoid),也称为「迷你肠」(mini-gut)。这些类器官是空心小球,内部具有完整的肠道上皮样结构[1]。肠道类器官现在被广泛用于研究人类疾病,相比较之前的肠道疾病模型(细胞系培养或动物活体实验),类器官培养优势明显,如培养成功率高、培养周期短、与原发组织差异小、易于建立低恶性肿瘤模型等。类器官可以从手术、活检等样品培养得到,可用于建立患者独特的疾病模型进行个体化的精准医疗。类器官医学应用前景广阔,多种类器官的研究都正在蓬勃发展,是一项新兴的「朝阳研究 」。
1 肠道干细胞的研究进展
肠道上皮的更新速度在成体哺乳动物的各器官中是最快的[2],小鼠(Musmusculus)的肠道上皮平均完全更新一次只需要 4~5 天[3,4]。如图 1 所示,绒毛-隐窝结构是小肠上皮的基本构成单元[5,6],每个绒毛的基底侧有多个隐窝,结肠上皮没有绒毛。肠道干细胞位于隐窝的基底部分,分裂增殖产生过渡扩增(transiatmplifying,TA)细胞[7,8]。这些细胞沿着隐窝纵轴向上迁移至隐窝上部,同时继续进行增殖分化,组成隐窝结构;从隐窝继续向绒毛迁移并分化后,形成成熟的完全分化的肠功能细胞,构成小肠绒毛或大肠隐窝顶部。这些成熟细胞可分为肠上皮吸收细胞、潘氏细胞、杯状细胞、肠内分泌细胞和 Tuft 细胞[5]。潘氏细胞成熟后下移至隐窝底部,其他各细胞则沿隐窝-绒毛轴上移至绒毛顶部,并死亡脱落入肠腔中。大肠上皮不具有潘氏细胞,但具有行使同样功能的 c-Kit 阳性分泌细胞,其余细胞组成与小肠基本相同,死亡的细胞从隐窝顶部脱落[9,10]。
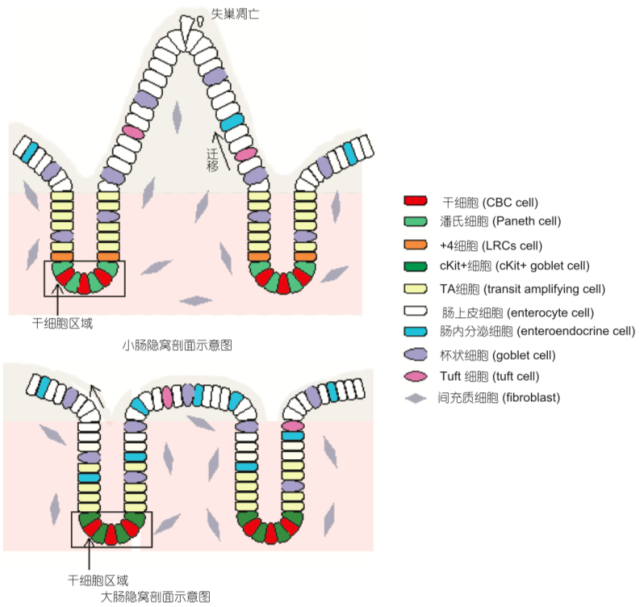
图 1 大小肠隐窝剖面示意图
小肠上皮具有绒毛和隐窝结构小肠干细胞(CBC)位于隐窝底部,与潘氏细胞间隔排列,+4 位干细胞位于潘氏细胞之上。潘氏细胞、间充质细胞和周边的基底膜共同构成小肠干细胞的微环境。CBC 细胞分裂增殖产生 TA 细胞,TA 细胞边增殖边分化,生成潘氏细胞、杯状细胞、肠内分泌细胞和肠上皮细胞等各种成熟细胞。大肠上皮没有绒毛 CBC 系与 ckit+ 细胞间隔排列。
对于隐窝中肠道干细胞的具体位置,之前有两种观点:(i) 肠道干细胞(隐窝基部柱状细胞(crypt base columnarcell, CBC))位于隐窝底部的干细胞区域,与潘氏细胞间隔排列。这一区域的局部微环境是特殊的,细胞迁移离开这一区域时即发生分化[11,12]。(ii) 认为小肠干细胞的位置是 +4 位(隐窝基底部之上的第 4 层细胞, 即最后一个潘氏细胞的上面)[13]。这两种说法一直没有明确的证据,直到小肠干细胞标记物 Lgr5 被发现后,前一种说法才得到了研究确认。经荷兰 Clevers 研究组[14]使用转基因小鼠研究发现,CBC 细胞特异性表达 Lgr5 基因,并通过体内谱系追踪技术,发现整个隐窝的各种成熟细胞均来源于 Lgr5+ 细胞,包括潘氏细胞、杯状细胞和肠内分泌细胞。从而证明 Lgr5+ 的上皮细胞就是真正意义上的肠道干细胞。这些肠道干细胞主要位于隐窝基底部 1~3 位的位置,即上文所述的 CBC 细胞位置。另外,对前述的「+4 位干细胞 」,Sangiorgi 和 Capecchi[15] 报道 Bmi1+(Bmi1polycombring fingeroncogene)细胞主要处于隐窝「+4」位置,而且该群细胞也可以分化成各种不同类型的特化细胞[16]。除此之外,mTert(telomerasereversetranscriptase)[17],Hopx(Hophomeobox)[18] 和 Lrig1(leucine-richrepeatsandim-munoglobulin-likedomains 1)[19] 也被报道可以标记「+4 位的干细胞 」,但是这些标志物表达不特异,如有些 Bmi1 阳性细胞在 +4 位置,有些在隐窝上半部分,还有的在绒毛上面。另外,根据新的研究表明,处于隐窝 +4 位置的 Lgr5+ 的肠道干细胞也会大量表达上述几种标记物,表达有部分重合,并且在肠道受损应激的条件下能够相互转化。目前认为,CBC 细胞和「+4 位干细胞」在隐窝内是同时存在的。前者分裂速度快,是正常生理条件下隐窝内各种细胞的来源[6]。后者属于一种潘氏细胞前体,静止不分裂,并在健康隐窝中经几周后分化成潘氏细胞[20]。这些研究在很大程度上统一了肠道干细胞的理论,证明 Lgr5 是肠道干细胞特异的表面分子。
2 肠道类器官
继 2007 年 Clevers 研究组[14] 在小鼠体内实验证明 Lgr5+ 上皮细胞是真正的肠道上皮干细胞后,肠道干细胞研究领域在随后的几年内取得了长足的进展。其中对该领域影响较大的突破是肠道干细胞体外 3D 培养体系的建立。2009 年 Sato 等人[1] 在 Nature 上报道,他们成功分离了单个 Lgr5+ 肠道干细胞 , 并将其与基质胶(matrigel,起到 3D 骨架支撑作用)混合,同时添加几种必需生长因子 EGFN,oggin(BMP 通路抑制剂),Wnts 和 R-spondin1(Wnt 信号激活),Jagged1(Notch 配体),发现 Lgr5+ 干细胞能够长成球状 3D 肠道类器官结构(organoid)。研究发现,这些类器官是空心小球,内部具有完整的肠道上皮结构,而且含有所有种类的肠上皮功能细胞,包括肠上皮细胞、肠内分泌细胞、杯状细胞、潘氏细胞和 Lgr5+ 干细胞[1]。类器官的结构如图 2 所示,肠道类器官含有多个隐窝结构,并相互连接形成中间有肠腔的迷你肠。每个类器官的隐窝含有与体内隐窝相似的 Lgr5+ 干细胞数量。干细胞分化出所有种类的细胞,这些细胞沿隐窝底部向绒毛部分迁移,并最终脱落进入腔[1]。类器官长大成熟后,可通过出芽的方式形成更多的类器官,并可持续传代培养并保持基因组稳定。

图 2 正常肠道类器官
肠道类器官具有与体内隐窝类似的结构,底部干细胞与潘氏细胞间隔排列,其上是 TA 细胞和成熟细胞。这些隐窝结构由单层的类似绒毛细胞的结构相连接,同样有沿隐窝底部向绒毛部分的细胞迁移,死亡细胞从绒毛部分脱落进入腔。
相比较培养小鼠的肠道类器官,人的肠道类器官培养相对更加复杂。如果仅加入和培养鼠隐窝相同的生长因子,人的隐窝不能长期培养,通常会在一周内死亡。长期培养人肠道类器官需要在鼠类器官培养基的基础上再加入胃泌素(gastrin)、烟酰胺 (nicotinamide),A83-01(ALK 抑制剂)和 SB202190(p38 抑制剂)。这样培养的隐窝将能正常地出芽繁殖,形成完整的类器官[21]。
肠道类器官可以在培养皿内连续传代培养 8 个月以上[1],而不失去原本体内隐窝的特性,始终具有正常的染色体数。表达谱分析也表明,培养的类器官和刚分离的新鲜隐窝的表达谱非常类似,且与隐窝的来源保持一致。例如,仅有人源类器官表达乳糖酶基因,只有从回肠末端培养出的类器官表达胆汁酸转运基因[22,23]。
3 肠道肿瘤类器官
不仅正常肠道上皮干细胞能够在该 3D 培养体系中长成肠道类器官,同样大肠癌细胞也可以利用该 3D 体系培养获得肠道肿瘤类器官。目前,肠道肿瘤类器官的培养已经受到了多方面的关注,而且各种不同器官肿瘤类器官的培养方式和应用模式都在研究开发中。肿瘤类器官目前的培养方法和正常的肠道类器官类似,将肿瘤组织消化得到肿瘤细胞,并加入基质胶培养。不同的类器官的培养要求不同,正常的肠道类器官如上所述,需要多种生长因子,而大肠腺癌的类器官由于绝大多数都存在各种癌基因持续激活突变(如 Wnt 通路),所以可以在缺乏 Wnt 或 R-spondin1 的培养基里生存,因此可以用选择性给生长因子的方法筛选出腺癌类器官[21]。肠道肿瘤类器官的形态通常如图 3 所示,异质性高,形态不一,但这些肿瘤类器官中的遗传突变与对应肿瘤活组织标本中的突变高度匹配,并与以往大规模的大肠癌突变分析结果相一致。

图 3 肿瘤类器官
肿瘤类器官具有异质性,形态大小不一,大部分呈球状,没有正常肠道类器官出芽结构,分化差。
由肿瘤衍生出的 3D 类器官,接近复制出了原发肿瘤的一些关键特性,提供了更接近生理条件的模型来测试新的和现有的药物,为个体化治疗改善癌症患者的临床研究铺平了道路。传统的肿瘤药物筛选主要依赖于 2D 的细胞系培养和人源性肿瘤异种移植 (patient-derivedtumorxenograftsP, DTX)。细胞系培养简便易于操作,并且容易进行大规模高通量药物筛选,但其表达谱和肿瘤差异较大[24];PDTX 的优势是保留了肿瘤和组织的交互性,来源多重,可以更好地代表肿瘤本身的性质,但耗时长、花费大、存在伦理问题[25];并且两者都只容易培养恶性程度高的肿瘤,对低恶性的肿瘤很难培养成功[26,27]。肿瘤类器官的培养,是一种介于细胞系培养和 PDTX 之间的培养方法,兼具两者的部分优势。 (i) 长期培养依然具有很好的基因稳定性,能够长时间维持初始的肿瘤基因表达谱,可以更真实地反映肿瘤对各种疗法的反应。(ii) 肿瘤类器官的培养过程不受实验动物的限制,可以一次性大规模培养并进行高通量药物筛选,节约时间,且不存在伦理问题。(iii) 再次,肿瘤类器官是由许多细胞培养而成的,来源多样复杂,能够反映肿瘤的异质性。最后,低恶性肿瘤也能培养得到肿瘤类器官,很好地填补了传统肿瘤建模方式在低恶性肿瘤方面的制约[28]。三者的优劣见表 1:
表 1 肿瘤培养方法优势对比
| 培养简便,大规模 | 来源多重性 | 肿瘤组织交互 | 表达谱差异小 | 无伦理问题 | 长期培养基因稳定 | 可培养低恶性肿瘤 | |
| 细胞系 | √ | × | × | × | √ | × | × |
| PDT | × | √ | √ | √ | × | √ | × |
| 类器官 | √ | √ | × | √ | √ | √ | √ |
4 类器官与精准医学
肠类器官培养体系的成功建立,为研究肠道疾病,如囊性纤维化病(cysticfibrosis, CF)、炎症性肠病、肠道损伤再生和肠癌等,带来极大的方便,将会成为个体化医疗(personalizedmedicine)的有力工具。
(1) 基因治疗:干细胞 3D 培养体系与传统的肠道细胞培养不同,几乎所有个体来源的隐窝或干细胞都能培养,成功率高。这一特点使得可以培养特定病人体内提取的干细胞和隐窝,复制出该病人独特的肠道上皮,对个体病人的治疗方式进行精准个性化的测试研究。首先,可在类器官上对疾病进行研究,构建罕见病模型。例如,CF 患者编码氯离子通道蛋白的基因(囊性纤维化跨膜传导调节因子(cysticfibrosistransmembraneconductanceregulator, CFTR))失活,从而造成了细胞分泌功能障碍[29]。将患者体内提取的肠道干细胞培养成类器官,这些类器官同样存在分泌障碍,且与患者的基因型保持一致。这样,就可以用这些类器官进行囊性纤维化的研究,如药物筛选等,避免了传统研究只能直接研究患者的缺点,省时省力且无伦理问题[30,31]。另外,Clevers 研究组[32] 实验证实,可以从 CF 患者体内取出少量肠道干细胞,使用 CRISPR/Cas9 技术修改这些干细胞的基因,插入正常的 CFTR 基因,使其发育成类器官。这些类器官的形态功能和基因表达与正常类器官一致,能完成正常肠道上皮的功能。类器官可以重新引入体内并发育成肠道上皮,这些修复后的类器官如果重新引入来源患者的体内,就可能部分治愈 CF 病。这给基因治疗开辟了一条新的道路[33]。
(2) 肠道再生修复:肠道上皮容易受损,经常会被各种疾病和药物等因素损伤,失去完整的结构。以往肠道上皮损伤后无有效治疗措施,只能待其缓慢自然恢复。肠道类器官培养体系的建立使得离体的肠道干细胞可以发育分裂形成大量的类器官,并且可以长时间的培养保持其功能不变,这些类器官给肠道损伤再生修复打开了「大门」Y. ui 等人[34] 在 2012 年报道,小鼠实验证实了体外培养的肠道类器官能够通过肛门灌肠修复由葡聚糖硫酸钠(dextransulfatesodium,DSS)诱发的结肠炎,这些培养的类器官能准确地到达损伤的上皮位置,并修复受损的肠道上皮[35,36]。这项实验若在人体内得到发展,将来可能提取病人剩余的少量肠道干细胞,将这些干细胞培养扩增后重新引入病人体内,令肠道上皮再生,治愈肠道疾病。肠道类器官体内移植的研究主要集中在结直肠,而小肠因其生理结构复杂及肠腔内恶劣环境很难进行灌肠移植,目前仅有少量文献报道可以利用手术进行相关移植。Avansino 等人[37] 在 2006 年报道,在保留血液循环完整的前提下通过手术分离部分小鼠肠道,并利用乙二胺四乙酸(ethylenediaminetetraaceticacidE, DTA)等试剂部分去除该部分肠道的隐窝和绒毛上皮,随后将供体的肠类器官与其孵育,最后通过上下切口吻合将其接回小鼠肠道。3 周后,取样病理组化发现,供体肠类器官能在受体肠黏膜内存活并修复部分受损肠黏膜。另外,当前大部分小肠类器官的研究主要聚焦在体外小肠类器官为基础的高通量药物筛选,如抗辐射药物的筛选。
(3) 个性化治疗:由患者自身细胞衍生出的 3D 类器官,能够非常好地复制原发组织的一些关键特性。所以,相比较其他体系,类器官对药物和疗法的反应更接近体内实际反应。正因为具有这些优势,肿瘤类器官现在有着各种各样的应用。首先可以用其进行高通量的药物筛选,培养某一特定病人的肿瘤类器官,并对其进行药物筛查。由此可以得到适合该病人的药物,精准地对个体病人进行治疗。肿瘤类器官还可以用来进行简便快速的肿瘤类型筛查,建立各种不同分型的肿瘤类器官库,之后只要培养个体病人的肿瘤类器官,并且检查其形态、基因表达谱和药物反应, 便可快速对病人的肿瘤分型,判断病人的预后。另外,肠道上皮细胞对各种药物和放疗射线非常敏感,经常是各种药物副作用的靶点。由此,在临床研究前有必要提前预知各种药物和疗法对肠道上皮细胞的影响[38],但是由于患者个体差异巨大,同样的剂量用于不同的患者,产生的副作用完全不能预期。有了个体化的类器官之后,就可以通过类器官对药物和疗法的反应来推断出某个病人对该治疗手段的反应和可能发生的副作用。另外 C,levers 研究组[39,40] 利用二代测序等大数据分析手段验证了肿瘤类器官与原发癌在基因突变和表达水平上存在着非常好的吻合,为建立结直肠癌肿瘤类器官活体样本库提供了基础理论支持。
综上所述,3D 培养的类器官因为其来源的广泛性和独特性,是对个体患者进行精准医疗的好帮手。目前已经存在的用途包括对罕见病人的样本进行扩增;对病人的类器官进行药物和疗法的单独筛查;判断药物和疗法在病人体内将产生的副作用等多个方面 这一切只需要病人体内活检得到的一小块含有干细胞的组织就可以完成[41],对患者的损伤也是极小的。
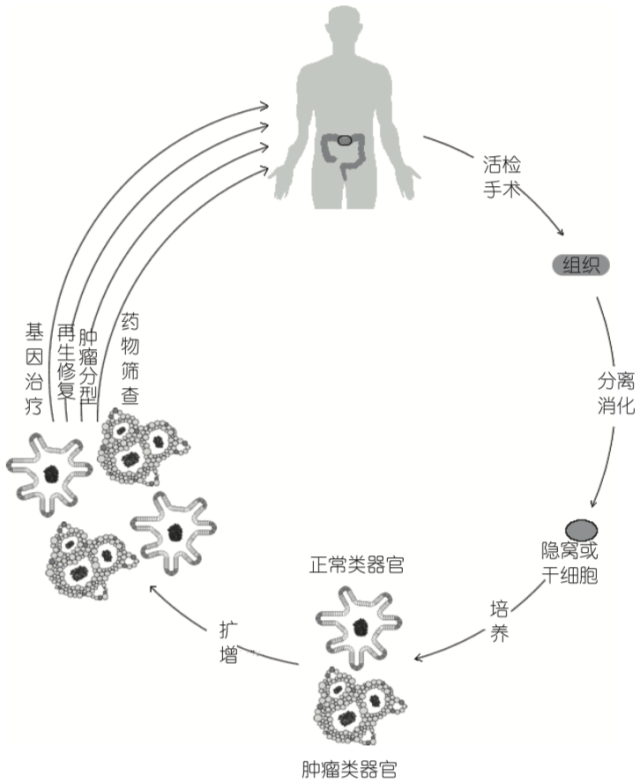
图 4 类器官在精确医学中的应用
对病人进行活检或手术 , 获得少量组织干细胞 , 培养得到正常或肿瘤类器官,扩增可进行药物筛查,肿瘤分型,基因治疗等相关精准治疗。
5 总结与展望
5.1 类器官研究存在的问题
近年来,类器官的研究取得了长足的进展,但是该培养体系也存在着一些自身的问题和技术瓶颈,使得该技术与许多临床应用仍有一定差距。例如,(i) 目前类器官的 3D 培养主要依赖动物来源的基质胶,或基质胶的主要成分胶原蛋白 I,而这些动物来源的基质胶成分复杂,而且在质控上很难把控,除此以外还有免疫及外来病原体的潜在危险。这些因素在很大程度上阻止了类器官在临床上的应用,所以研究开发人工化学合成的基质胶成为研究的热点。2016 年,Lutolf 研究组[42] 报道可以利用聚乙二醇(polyethyleneglycol, PEG)加上纤维连接蛋白结合位点短肽(arg-gly-asp, RGD)可以在一定程度上替代动物来源的基质胶培养肠道干细胞,但是由于类器官的培养在不同阶段对细胞外基质软硬度要求较高,可操作窗口较小,使得人工合成的聚合水凝胶在实验操作和培养效果来讲不如动物来源的基质胶。尽管 PEG 水凝胶在类器官培养效果上不如动物来源的基质胶,但该报道给人工合成 3D 水凝胶的研究指出了一个前进的方向;(ii) 目前类器官的培养主要是指上皮细胞类器官,如消化道上皮细胞、 乳腺上皮细胞、皮肤上皮细胞、肺泡上皮细胞等,大部分的类器官中只有上皮细胞,不含有成纤维细胞、 免疫细胞、血管细胞等周围基质细胞。这在很大程度上限制其在其他领域的应用,如免疫防御的研究、干细胞微环境、肿瘤微环境调控方面的研究。今后的研究如能把血管内皮干细胞、成纤维干细胞、上皮干细胞等共培养,将能够较大程度地模拟体内组织微环境;(iii) 类器官的均一性较差。由于类器官培养于 3D 的基质胶中,所以其生长存在一定的边缘效应,即处于基质胶外围的类器官一般尺寸较大,而处于基质胶中间的尺寸偏小。该异质性给高通量类器官细胞数定量及尺寸统计分析带来一定的困难。
5.2 类器官研究发展与应用前景
类器官培养是当下的焦点课题,相关研究正在蓬勃发展。除肠道类器官之外,肝、肺、乳腺和前列腺等都有许多文献报道,提出了各种相关培养方法及研究应用。例如,肝脏类器官和肠道类器官类似,是使用 Lgr5+ 肝脏祖细胞培养得到的三维的「肝芽」结构。这些肝芽除可以用作疾病代谢模型之外,还可以修复肝损伤。这些肝芽注入肝脏损伤的小鼠体内后,可以在小鼠体内自动发展并与血管连接,使得肝脏得以修复,可以进行代谢,并部分治愈肝衰竭[43]。在小鼠工作的基础上,Clevers 研究组[44] 建立了长期培养人肝脏类器官的体外培养体系 , 并进一步验证在该培养条件下能够维持人肝脏细胞的基因组稳定 , 为建立临床肝脏疾病模型打下了技术基础。肠道类器官的发展也推动了乳腺类器官的研究,培养出的乳腺类器官形态与乳腺十分相似,拥有分泌腔等结构,并能对激素做出反应,雌激素刺激可使其分泌管腔的部分扩张[45]。肺的类器官也是目前研究的热点,如培养肺气管内的 P63+ 基底细胞,可得到球形的支气管类器官,外侧与培养物接触的一层为基底细胞,内侧覆盖一层纤毛细胞;培养肺泡中的 SFTPC+ 分泌细胞(typeIIalveolarepitheliaclells, AEC2s),则能生成包含完整的气体交换细胞和分泌细胞的 3D 结构,这是肺泡类器官。提取细支气管和肺泡交界处的干细胞(bronchioalveolarstemcellsB, ASCs),则产生了完整的包含肺泡细胞与气管细胞的肺类器官[46,47]。前列腺的类器官可由两种细胞生成,CK5+ 的基底细胞和 CK8+ 的腔上皮细胞。前者生成类器官的几率更高(70%),后者只有 1%,但后者生成的类器官形态更完整,尺寸更大,和正常的前列腺更相似[48]。
随着类器官培养技术的进一步优化,来源于不同组织的类器官将在医学疾病的治疗研究中扮演非常重要的作用。例如,建立罕见疾病的体外模型[49]、生物 3D 打印[50]、病人个体类器官药物和疗法的筛查、类器官水平毒副作用的初筛、类器官为基础的高通量药物筛选、类器官体内移植、类器官在组织再生研究中的应用。类器官的应用前景是广泛而多样的,有理由相信,类器官的发展是未来精准医学不可或缺的基石。
参考文献
1. Sato T, Vries R G, Snippert H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 2009, 262–265
2. Heath J P. Epithelial cell migration in the intestine. Cell Biol Int, 1996, 20: 139–146
3. Potten C S. Kinetics and possible regulation of crypt cell populations under normal and stress conditions. Bull Cancer, 1975, 62: 419–430
4. Clevers H. The intestinal crypt, a prototype stem cell compartment. Cell, 2013, 154: 274–284
5. Barker N, van de Wetering M, Clevers H. The intestinal stem cell. Genes Dev, 2008, 22: 1856–1864
6. Barker N. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nat Rev Mol Cell Biol, 2013, 15: 19–33
7. Hermiston M L, Gordon J I. Organization of the crypt-villus axis and evolution of its stem cell hierarchy during intestinal development. Am J Physiol, 1995, 268: G813–G822
8. Qi Z, Chen Y G. Regulation of intestinal stem cell fate specification. Sci China Life Sci, 2015, 58: 570–578
9. Hall P A, Coates P J, Ansari B, et al. Regulation of cell number in the mammalian gastrointestinal tract: the importance of apoptosis. J Cell Sci, 1994, 107: 3569–3577
10. van der Flier L G, Clevers H. Stem cells, self-renewal, and differentiation in the intestinal epithelium. Annu Rev Physiol, 2009, 71: 241–260
11. Bjerknes M, Cheng H. The stem-cell zone of the small intestinal epithelium. I. Evidence from paneth cells in the adult mouse. Am J Anat, 1981, 51–63
12. Bjerknes M, Cheng H. The stem-cell zone of the small intestinal epithelium. III. Evidence from columnar, enteroendocrine, and mucous cells in the adult mouse. Am J Anat, 1981, 160: 77–91
13. Potten C S, Booth C, Pritchard D M. The intestinal epithelial stem cell: the mucosal governor. Int J Exp Pathol, 2003, 78: 219–243
14. Barker N, van Es J H, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 2007, 449: 1003–1007
15. Sangiorgi E, Capecchi M R. Bmi1 is expressed in vivo in intestinal stem cells. Nat Genet, 2008, 40: 915–920
16. Tian H, Biehs B, Warming S, et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature, 2011, 478: 255–259
17. Montgomery R K, Carlone D L, Richmond C A, et al. Mouse telomerase reverse transcriptase (mTert) expression marks slowly cycling intestinal stem cells. Proc Natl Acad Sci USA, 2011, 108: 179–184
18. Takeda N, Jain R, LeBoeuf M R, et al. Interconversion between intestinal stem cell populations in distinct niches. Science, 2011, 334: 1420–1424
19. Powell A E, Wang Y, Li Y, et al. The Pan-ErbB negative regulator Lrig1 is an intestinal stem cell marker that functions as a tumor suppressor. Cell, 2012, 149: 146–158
20. Buczacki S J A, Zecchini H I, Nicholson A M, et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5. Nature, 2013, 495: 65–69
21. Sato T, Stange D E, Ferrante M, et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and barrett’s epithelium. Gastroenterology, 2011, 141: 1762–1772
22. Middendorp S, Schneeberger K, Wiegerinck C L, et al. Adult stem cells in the small intestine are intrinsically programmed with their location-specific function. Stem Cells, 2014, 32: 1083–1091
23. Zachos N C, Kovbasnjuk O, Foulke-Abel J, et al. Human enteroids/colonoids and intestinal organoids functionally recapitulate normal intestinal physiology and pathophysiology. J Biol Chem, 2016, 291: 3759–3766
24. van Staveren W C G, Solís D Y W, Hébrant A, et al. Human cancer cell lines: experimental models for cancer cells in situ? For cancer stem cells? Biochim Biophys Acta, 2009, 1795: 92–103
25. Tentler J J, Tan A C, Weekes C D, et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol, 2012, 338–350
26. van Kempen L C L T, Ruiter D J, van Muijen G N P, et al. The tumor microenvironment: a critical determinant of neoplastic evolution. Eur J Cell Biol, 2003, 82: 539–548
27. Masters J R W. Human cancer cell lines: fact and fantasy. Nat Rev Mol Cell Biol, 2000, 1: 233–236
28. Sachs N, Clevers H. Organoid cultures for the analysis of cancer phenotypes. Curr Opin Genet Dev, 2014, 24: 68–73
29. Kerem B S, Rommens J M, Buchanan J A, et al. Identification of the cystic fibrosis gene: genetic analysis. Science, 1989, 245: 1073–1080
30. Noordhoek J, Gulmans V, van der Ent K, et al. Intestinal organoids and personalized medicine in cystic fibrosis. Curr Opin Pulm Med, 2016, 22: 610–616
31. Dekkers J F, van der Ent C K, Beekman J M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Dis, 2013, 1: e27112
32. Schwank G, Koo B K, Sasselli V, et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell, 2013, 13: 653–658
33. Ikpa P T, Bijvelds M J C, de Jonge H R. Cystic fibrosis: toward personalized therapies. Int J Biochem Cell Biol, 2014, 52: 192–200
34. Yui S, Nakamura T, Sato T, et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5+ stem cell. Nat Med, 2012, 18: 618–623
35. Wirtz S, Neufert C, Weigmann B, et al. Chemically induced mouse models of intestinal inflammation. Nat Protoc, 2007, 2: 541–546
36. Fordham R P, Yui S, Hannan N R F, et al. Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell, 2013, 13: 734–744
37. Avansino J R, Chen D C, Hoagland V D, et al. Orthotopic transplantation of intestinal mucosal organoids in rodents. Surgery, 2006, 140: 423–434
38. Bouvier d’Yvoire M, Bremer S, et al. Ecvam and new technologies for toxicity testing. Adv Exp Med Biol, 2012, 745: 154–180
39. van de Wetering M, Francies H E, Francis J M, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell, 2015, 933–945
40. Clevers H. Modeling development and disease with organoids. Cell, 2016, 165: 1586–1597
41. Weeber F, van de Wetering M, Hoogstraat M, et al. Preserved genetic diversity in organoids cultured from biopsies of human colorectal cancer metastases. Proc Natl Acad Sci USA, 2015, 112: 13308–13311
42. Gjorevski N, Sachs N, Manfrin A, et al. Designer matrices for intestinal stem cell and organoid culture. Nature, 2016, 539: 560–564
43. Huch M, Dorrell C, Boj S F, et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature, 2013, 494: 247–250
44. Huch M, Gehart H, van Boxtel R, et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell, 2015, 160: 299–312
45. Zhang L, Adileh M, Martin M L, et al. Establishing estrogen-responsive mouse mammary organoids from single Lgr5+ cells. Cell Signal, 2017, 41–51
46. Nadkarni R R, Abed S, Draper J S. Organoids as a model system for studying human lung development and disease. Biochem Biophys Res Commun, 2016, 473: 675–682
47. Donne M L, Lechner A J, Rock J R. Evidence for lung epithelial stem cell niches. BMC Dev Biol, 2015, 15: 32
48. Karthaus W R, Iaquinta P J, Drost J, et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell, 2014, 163–175
49. 顾奇, 郝捷, 陆阳杰, 等. 生物三维打印的研究进展. 中国科学: 生命科学, 2015, 45: 439–449
50. 王加强, 周琪. 干细胞与再生医学. 中国科学: 生命科学, 2016, 46: 791–798
Research applications of intestinal organoids in precision medicine
WANG Chu, GAO JianJun & HUA GuoQiang
Institute of Radiation Medicine, Shanghai Medical College, Fudan Univeristy, Shanghai 200032, China
The three-dimensional organoid culture system has been widely used for studying adult stem cell self-renewal, differentiation and organ development. Recently, intestinal stem cells and crypts can be cultured and grow into crypt-villus organoid structures in matrigel supplemented with defined growth factors. These 3D multicellular intestinal organoids called “mini-gut” can recapitulate the key physiological features of an intestine: the crypt and villus domains, a functional lumen and all of the major cell types present in the adult intestinal epithelium. The 3D intestinal organoid culture system has also been successfully applied to human colorectal cancers (CRCs), and the majority of the CRCs successfully grow into CRC organoid. These organoids can be widely used to study many kinds of human intestinal diseases, including inflammatory bowel disease (IBD), intestine regeneration and CRCs. Therefore, here we discussed the latest research of intestinal stem cells, organoid culture and tumor organoids. We also highlighted practical applications of organoids in various aspects, ranging from modeling human diseases to precision medicine such as tissue regeneration, gene therapy and personalized medicine.
intestinal stem cell, organoid, tumor organoid, 3D culture
doi: 10.1360/N052016-00342
相关文献:
2. 肠类器官的研究与应用
