北京百奥益康医药科技有限公司
1 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
公司新闻/正文
文献解读 | 非模式物种猪的单细胞免疫组库测序揭示了流感病毒感染下的T/B细胞受体多样性及克隆扩增特征
551 人阅读发布时间:2025-12-04 13:58
鉴于猪与人类在生理、解剖等多个维度具有高度相似性,其在生物医学研究中已逐渐成为非人灵长类动物模型的重要替代选择。然而,制约猪模型充分发挥应用价值的关键瓶颈在于,我们对猪免疫系统的认知仍不够全面系统,这主要归因于猪源免疫分析试剂的匮乏。
今天和大家分享一篇发表在《Communications biology》上的题为“Single-cell antigen receptor sequencing in pigs with influenza”的文章。本研究开发了猪特异性 T 细胞受体(TCR)和 B 细胞受体(BCR)富集引物。将 scRNA-seq 与免疫受体分析相结合,利用这些检测方法,分析了表达 CD1D 和缺失 CD1D 的猪在经甲型流感病毒(IAV)一次或两次感染后,冷冻保存的肺细胞的免疫组库,以探究自然杀伤 T(NKT)细胞是否影响肺组织中 TCR 和 BCR 受体库。还对经 IAV 疫苗免疫和感染的猪的肺液中纵向采集的 T 细胞进行分析,以追踪克隆扩增情况。尽管所有猪均表现出高度多样的受体库,但再次暴露于 IAV 的猪拥有更多具有活化表型的扩增 T 细胞克隆型,提示这些可能是针对 IAV 的反应性克隆。本研究结果证实了高通量单细胞 TCR 和 BCR 测序在猪研究中的应用价值。
目前,百奥益康凭借自主研发的CelCode®高通量单细胞转录组+V(D)J测序平台,除了成功攻克了猪免疫组库测序这一难题,更是同时实现五大物种全覆盖(人、小鼠、猴子、猪、兔子),打破了传统免疫组库研究的物种壁垒,为非模式动物模型研究提供了一站式、高精度的解决方案。

研究结果
1. 感染流感病毒的基因编辑猪的单细胞RNA测序分析
从携带失活型 CD1D 基因(CD1D−/−)的杂种猪和携带一个失活拷贝(CD1D−/+)的同窝猪的酶消化肺组织中分离出冷冻保存的细胞,利用我们定制的引物进行 scRNA-seq 和 scTCR/BCR-seq 联合检测。一组猪在单次感染(1X)H1N1 A/Missouri/CS20N08/2020(MO20)毒株 5 天后进行剖检,另一组猪在初次感染 H1N1 A/California/04/2009(pdmH1N1)毒株两周后,再次感染 MO20 毒株,并在 5 天后剖检(2X)(图1A)。对 12 头猪(每组 3 头)进行单细胞测序,共获得 45,850 个细胞。通过UMAP降维分析鉴定出 28 个细胞簇,并根据已确定的谱系标记物进行注释(图1B)。Cluster 1和2具有初始 T 细胞特征(SELL、CCR7、LEF1 和 TCF7),同时表达与记忆相关的组织驻留标志物 CD69,提示其可能具有组织驻留特性。2X CD1D−/+ 猪的 CD8+ 组织驻留记忆 T 细胞(TRM,cluster 4)和循环 T 细胞(cluster 16)频率显著高于 1X CD1D−/+ 猪(图1C);细胞毒性 CD8+ T 细胞(cluster 5)频率在 2X CD1D−/+ 猪中也更高,但差异无统计学意义。2X CD1D−/−猪中上述细胞类型数量相较于 1X CD1D−/−猪也有所增加,但增幅小于 CD1D−/+ 猪且无统计学意义。
接下来,我们按基因型对比了 2X 和 1X 组猪各免疫细胞类型中的差异表达基因(DEGs)(图1D),和按感染次数对比了 CD1D−/+ 和 CD1D−/−猪的 DEGs(图1E)。总体而言,CD1D−/+ 组中 2X 相较于 1X 猪上调的基因数量(3241个)远多于 CD1D−/−组(1162个),尤其是在细胞毒性 T 细胞(cluster 5)、CD2- γδ T 细胞(cluster 9)、NK 细胞(cluster 11 和 12)和 B 细胞(cluster 14)中。这表明初次感染期间来自 NKT 细胞的刺激可启动多种肺免疫细胞类型,使其在再次感染时产生更强的应答。例如,对 NK 细胞(cluster 11)DEGs 的IPA分析显示,与 2X CD1D−/− NK 细胞相比,2X CD1D−/+ NK 细胞上调了与C型血凝素受体相关的途径、PTEN调节、白细胞素-1家族信号传递和核因子-κB(NF-κB)途径信号传递(图1F)。在相同基因型(CD1D−/+ vs CD1D−/−)下,无论是 1X(558个 DEGs)还是 2X(282个 DEGs)感染条件,cluster 17 中的单核细胞和巨噬细胞在 CD1D−/+ 猪中 DEGs 数量显著高于 CD1D−/−猪。对cluster 17 DEGs 的 IPA 分析显示,与 1X CD1D−/−猪相比,1X CD1D−/+猪的单核细胞和巨噬细胞上调了多种生物学通路,包括α/β干扰素信号传导、白介素 - 1 家族信号传导、NF-κB 通路信号传导以及 I 类MHC介导的抗原加工和呈递通路(图1G)。这与先前关于活化的 NKT 细胞可诱导抗原呈递细胞下游成熟的报道一致。
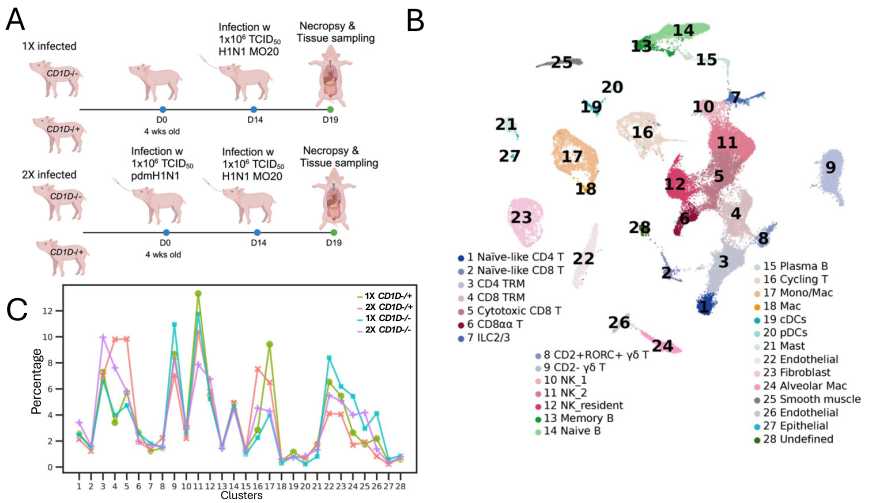
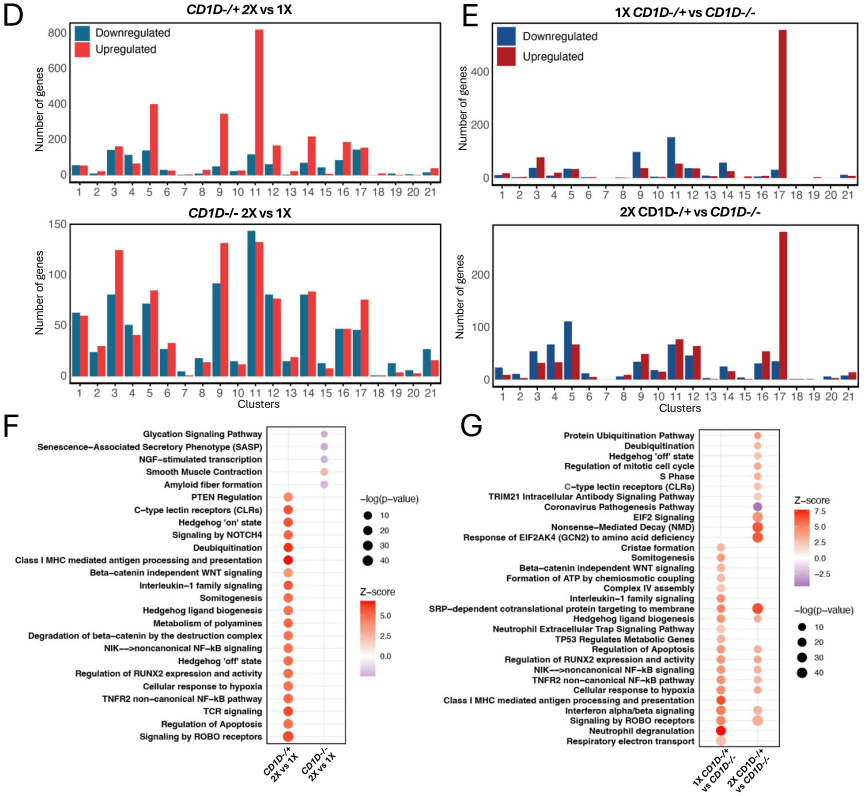
图1. IAV感染的CD1D−/−和CD1D−/+猪肺的单细胞转录组学分析
2. 肺T淋巴细胞TCR库
使用我们的猪特异性V(D)J序列引物分析了猪肺组织细胞。在12个样本中,共获得 927,503,456 条测序读段,每个文库平均 77,291,955 条读段。对原始测序读段进行从头组装,得到未注释的猪 V (D) J 重叠群,利用测序引物识别后,与图1中的基因表达簇中的细胞进行了比对。在所有样本中,大约60%的TRA和70%的TRB的重叠群分别与单个细胞对齐(图2A)。选择具有与功能性TRA配对的IMGT注释的TRB基因的细胞用于进一步分析(图2B),这些细胞占样本中αβ T细胞群(cluster1-6)的23%至38%。
分析Vβ /Jβ和Vα/Jα组合的表达,以确定偏好性的重排是否与CD1D基因型或IAV感染数量相关(图2C)。总体而言,TRBJ1 -1*01、TRBJ1 -2*01、TRBJ3 -3*01、TRBJ2 -3*01和TRBJ2 -6* 01用于许多重排,而与TRBJ1 -5*01、TRBJ2 -5* 01、TRBJ3 -7*01、TRBJ1 -6*01和TRBJ2 -1* 01的配对相对较少(图2C)。这与我们之前使用批量RNA测序方法对猪外周血T细胞的分析结果类似。尽管非常罕见,但只有表达CD1D的CD1D-/+猪体内存在携带由pTRAV10和TRAJ18 *01组成的不变NKT细胞TCRα链。我们观察到2X CD1D-/+猪的Vβ /Jβ 重组模式彼此之间比与其他猪更相似(图2D)。来自同一窝的s303、s305、s307和s308也是如此。由于结构重排的TCR受MHC分子选择的,因此我们通过将跨簇的scRNA-seq转录本与IPD-MHC数据库进行比对来分析猪白细胞抗原(SLA)I类和II类表达。为了可视化SLA的使用情况,对每头猪中10个表达量最高的I类(图2 E)和II类(图2 F)基因进行了行标准化均值分析。综合两种SLA类分子的表达情况,可以将猪分为6种不同的MHC单倍型遗传模式(命名为A-F),如下:A-s403、s406、s408; B-s305、s307、s308、s407、s412; C-s303; D - s402; E-s411; F-s404。五只“B”型遗传模式的猪的Vβ /Jβ 配对聚集在一起(图2D),表明MHC遗传和VDJ选择之间存在联系。
此外,由于TRB基因片段在IMGT中得到了完全注释,而TRAV片段则没有,因此我们使用相同的CDR3 β区域序列来分析样本中的扩增克隆型。发现部分克隆型存在于多头猪中,其中2X感染猪中共享克隆数量最多(图2G)。此外,2X组(尤其是CD1D-/+组)比1X组具有更多的扩增克隆数量(图2 H)。克隆扩增的的T细胞主要集中在CD4+和CD8+ TRM、细胞毒性CD8+ T细胞和循环T细胞中,而cluster 1和2中的类初始T细胞中存在相对较少的扩增克隆(图2 I)。与未扩增的克隆相比,扩增的克隆富集免疫活化/效应相关的基因(图2 J)。2X CD1D −/+猪贡献了五种扩增最多的克隆型中的四种,且每种克隆型均包含超过12个细胞(图2K、L)。这些克隆型中的一个源自CD4+ TRM,而其余四个来自CD8+ TRM(图2 M)。
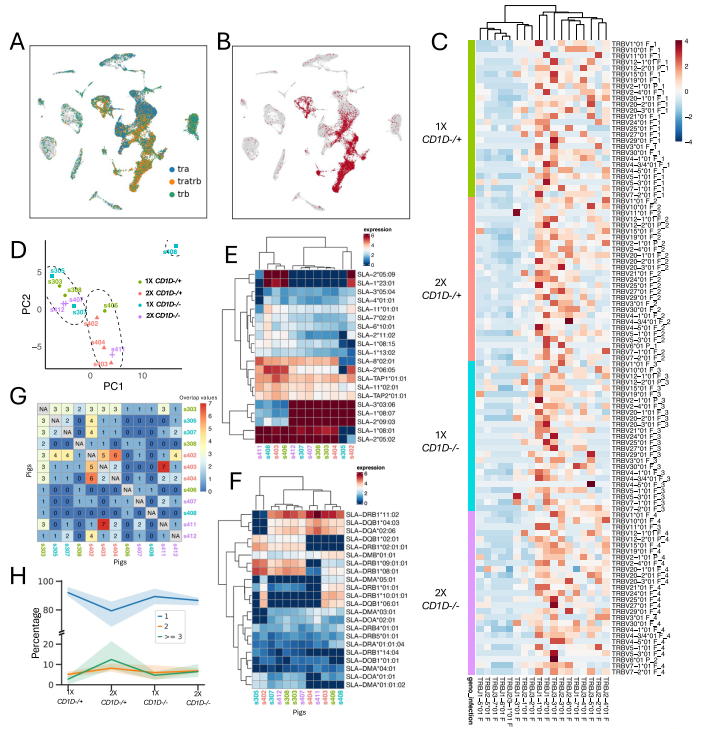
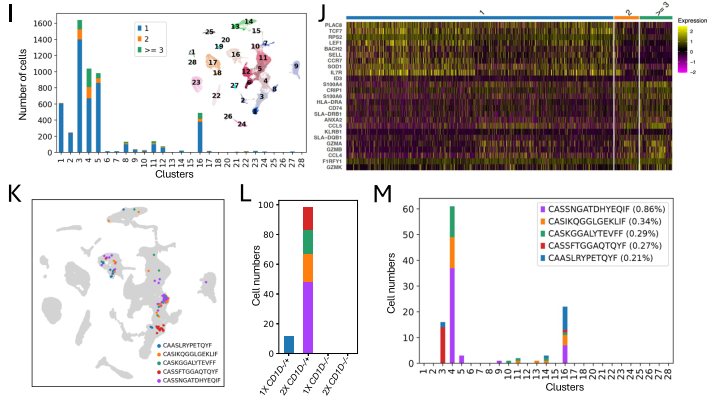
图2. 肺组织T细胞克隆型的特征
3. 肺B淋巴细胞BCR库
采用与 TCR 分析相似的方法,利用针对 IGK、IGL、IGHM/IGHD、IGHA 和 IGHG 基因的猪特异性引物分析肺组织细胞(图3A)。在 12 个样本中,共获得 1,395,728,419 条测序读段,每个文库平均 116,310,701 条读段。将组装的 V (D) J 序列与 IMGT 种系 IGL、IGK 和 IGH 数据库进行 blast 比对。仅将具有 IMGT 注释的 IGH 基因且与功能性 IGL 或 IGK 链配对的细胞用于后续分析。表达不同轻链和重链重叠群的 B 细胞比例如下:IGK 占 21%、IGL 占 40%、IGHM 占 45%、IGHD 占 7%、IGHG 占 5%、IGHA 占 3%。这些细胞占 12 个样本中 B 细胞总数的 53% 至 70%。IGL 与 IGK 的使用比例为 1.8:1(图3B)。浆细胞(cluster 15)中 IGHG+ 和 IGHA+ 细胞比例最高,这与为黏膜抗体分泌而发生多样化的 B 细胞特征相符(图3C)。由于我们的 IGHG 引物靶向 IMGT 中收录的 8 个基因组 IgG 恒定区基因序列的保守恒定区,因此将 IGHG 序列映射到 IMGT 数据库。IGHG1 在所有三个亚群中均占主导地位,IGHG5-2 也在所有 B 细胞亚群中被检测到;但仅cluster 14 和 15 中经历抗原刺激的记忆 B 细胞和浆细胞可检测到 IGHG2、IGHG3 和 IGHG5-1 亚类,IGHG4 和 IGHG6 无法与其他亚类区分(图3D)。
随后,我们分析了 V (D) J 基因片段的使用情况(图3E)。与人类或实验室啮齿动物不同,猪在 VDJ 重链中仅使用有限数量的 V、D 和 J 基因构成其大部分 BCR 库,超过 90% 的 VDJ 库由 7 个 V 片段、2 个 D 片段和 1 个 J 片段组成。与这些研究结果一致,我们发现 6 个 V 片段(V1-15、V1S2、V1-4、V1-8、V1S5 和 V1-6)占 V 片段使用总量的约 70%(图3E),而 D 和 J 片段的使用主要局限于 D1 或 D2 以及 J5。我们分析了样本中由相同的 IG 轻链和重链 CDR3 序列重组定义的扩增克隆型,结果显示 B 细胞的扩增克隆数量远少于 T 细胞,且单个克隆型最多包含 4 个细胞。几乎所有扩增克隆型均存在于少量分泌 IgG 或 IgA 的浆细胞(cluster 15)中(图3F、G)。四个处理组间在 IGH 使用(图3H)和克隆型扩增方面(图3I)未观察到显著差异,但 2X 组猪的 IGHG5-2/IGHG1 比值高于 1X 组(图3J),而 1X 组猪的重链 CDR3 长度往往长于 2X 组(图3K),这与我们观察到的两组间 TCR CDR3β 长度差异相呼应。
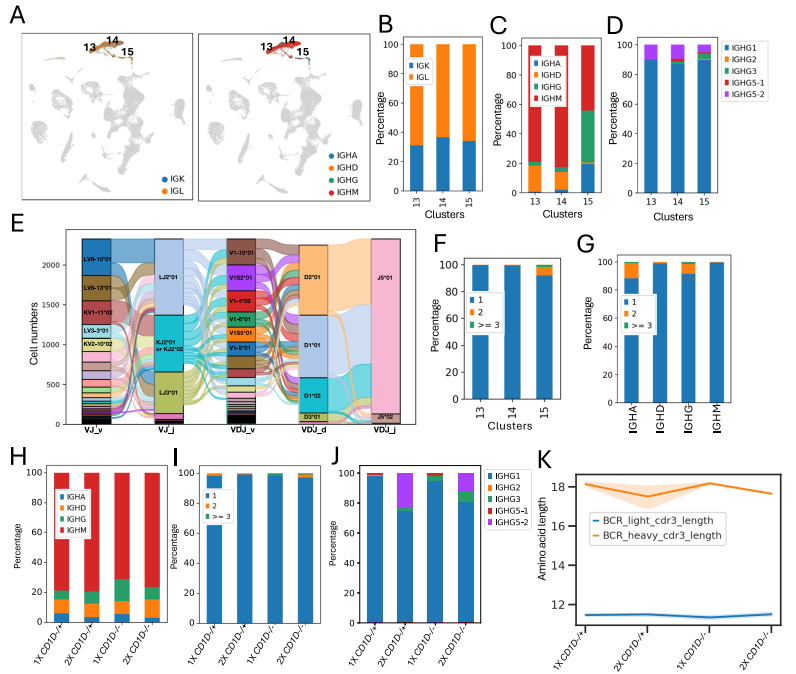
图3. 肺组织B细胞的B细胞受体库分析
4. 肺灌洗液中T细胞的纵向评估
克隆型追踪是监测癌症和疫苗免疫学中单个宿主内目标克隆型频率变化的有效方法。利用猪 TCR α和β链引物,我们分析了三头无特定病原体仔猪肺中 T 细胞的 V (D) J 克隆型及TCR α和β链基因使用情况(图4A)。其中两头猪(FLU1 和 FLU2)在 28 日龄时接种灭活 pdmH1N1 病毒与佐剂的联合疫苗,并在 15 天后加强免疫;加强免疫两周后,两头猪均感染活 pdmH1N1 病毒。分别在感染前 3 天(T1)和感染后 7 天(T2)收集肺液;第三头未免疫猪(NAIVE)分别在 28 日龄(T1)和 33 日龄(T2)进行肺灌洗。从每份肺液样本中分选 942 至 4205 个CD3D + 细胞(图4B),并进行单细胞 RNA 和 TCR 联合测序。合并数据集共分为 15个cluster(图4C、D)。Cluster 10 和 11 为 γδ T 细胞,该细胞群在猪体内相对丰富;cluster 1、2、3、4、5、6、7、11、12、13 和 14 上调组织驻留标志物,而cluster 8、9 和 10 表达循环 T 细胞标志物(图4E)。基于 CCR7、SELL 和 CXCR3 的上调表达,cluster 8 细胞可能为 CD8 + 中央记忆(TCM)T 细胞,而cluster 9 细胞可能为循环幼稚 T 细胞。组织驻留记忆 T 细胞包括 CD4+(cluster 1)和 CD8+ 细胞(cluster 2、4、5、6 和 12),以及包含 CD4+ 和 CD8+ TRM 混合群体的增殖细胞(cluster 13 和 14)。作为对IAV感染的反应,FLU1 和 FLU2 猪的增殖性 CD4+ 和 CD8+ TRM、CD2- γδ T 细胞、CD4+ TRM、类初始 CD4+ T 细胞、CD8αα T 细胞(cluster 6 和 7)以及 CD8+ 组织效应记忆(TEM)簇频率均升高,而 CD8+ TRM 频率降低(图4F)。我们鉴定出 10 个跨细胞类型的共调控基因及调控网络模块(图4G、H),其中cluster 7、8、9 和 10 中的模块 5 包含循环 T 细胞基因,cluster 2、3、4、5、6 和 11 中的模块 6 包含组织驻留和细胞毒性相关基因,cluster 1、2 和 11 中的模块 10 包含干扰素刺激基因(ISG)。
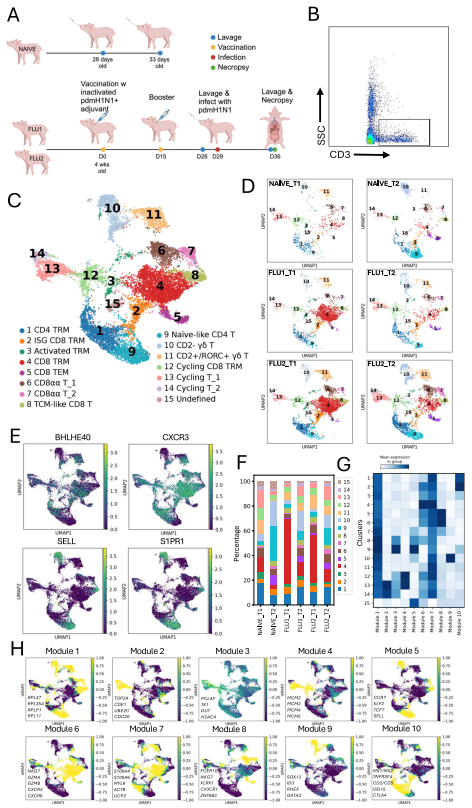
图4. 从肺灌洗液中分离的T细胞的单细胞转录组学分析
约 60% 回收的 αβ T 细胞具有配对的 TCRα和 TCRβ链(图5A)。利用序列同源性绘制单个样本中 TCRα 和 TCRβ 链的系统发育相关性图谱(图5B)。发现许多通过 CDR3β 序列鉴定的克隆在同一头猪的 T1 和 T2 时间点均存在,尤其是 FLU2 猪(图5C)。扩增克隆中 CD8+ TRM 占比很高(图5D)。两头经疫苗免疫和感染的猪出现了 5 个扩增最显著的克隆型,其中FLU2 猪尤为明显(图5E、F);NAIVE 猪样本中扩增克隆型数量少,部分原因是该猪的细胞收集量较少。接下来,我们分析了 FLU1 和 FLU2 猪感染前后大量扩增克隆型,以筛选潜在的流感反应性 T 细胞(图5G)。尽管部分克隆的频率从 T1 到 T2 下降,但也有部分克隆频率升高,包括 CSAGERSNYEQIF、CASSVRSYPLNDLHF、CASSFGGVHTGQLYF、CAWSTTGTVTGQLYF 和 CSAGEGGFGDTCFF。我们还利用 immunarch 软件分析 CDR3β 库中的特异性群组,该软件可聚类因 CDR3 序列保守基序而更可能共享抗原特异性的 TCR。发现 FLU1 和 FLU2 猪样本中富集两种 CDR3β 4-mer 基序模式(ASSL 和 SSLV)(图5H)。有趣的是,扩增克隆中的部分 CDR3β 序列与经整理的识别 IAV M1、NP、PB1 和 PB2 表位的人类 TCR CDR3β 序列完全相同或仅相差一个氨基酸。例如,所有猪中扩增程度排名第七的 CDR3β 序列 ASSPGQGYEQ,与识别由人类 HLA-A*0201 提呈的 IAV 基质蛋白 1 免疫优势表位 GILGFVFTL 的人类 CDR3β 序列一致(图5I)。
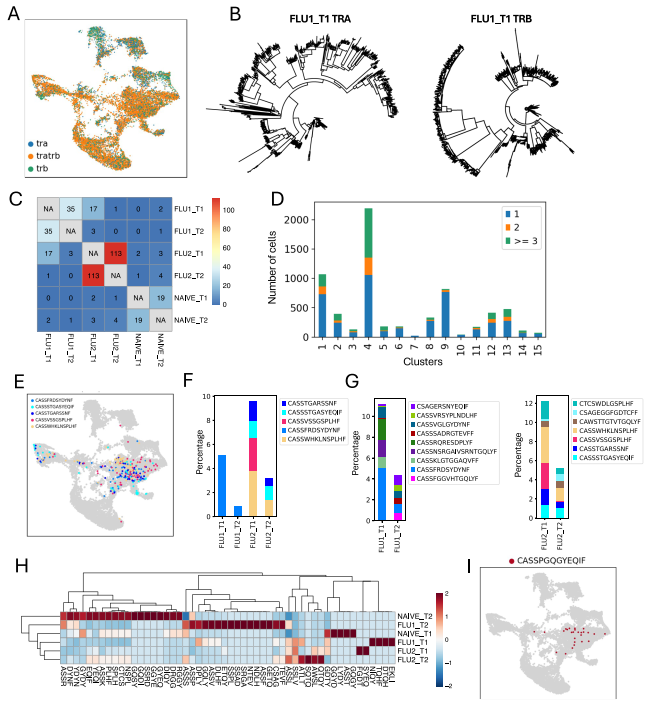
图5. 使用TRB基因座的VDJ重组进行T细胞克隆型追踪
总结
本研究提出的检测方法可轻松应用于基于 10× Genomics 5' 方案的猪相关研究。我们的方案能够在同一样本中同时分析 TCR 和 BCR,提升了方法的实用性 —— 因为大多数适应性免疫应答均涉及细胞和体液应答。因此,该联合方案有助于阐明生产用猪经疫苗免疫和感染后获得性免疫的发生机制,也可为日益增多的用于生物医学研究的免疫相关猪模型提供参考。
百奥益康CelCode®免疫组库测序平台介绍
在生命科学领域,免疫系统的复杂性始终是探索的核心命题。从肿瘤免疫治疗到疫苗研发,从自身免疫疾病机制解析到跨物种比较免疫学研究,科学家们迫切需要一种能够精准捕捉免疫系统动态变化的技术。
CelCode®高通量单细胞免疫组库测序技术凭借其多物种兼容性、突破常规的单细胞分辨率和全面的全维度数据整合能力,已成为当前免疫研究领域当之无愧的"破局者"和"领军者"。其同时实现五大物种全覆盖(人、小鼠、猴子、猪、兔子),打破了传统免疫组库研究的物种壁垒,开创了跨物种免疫研究的新纪元。
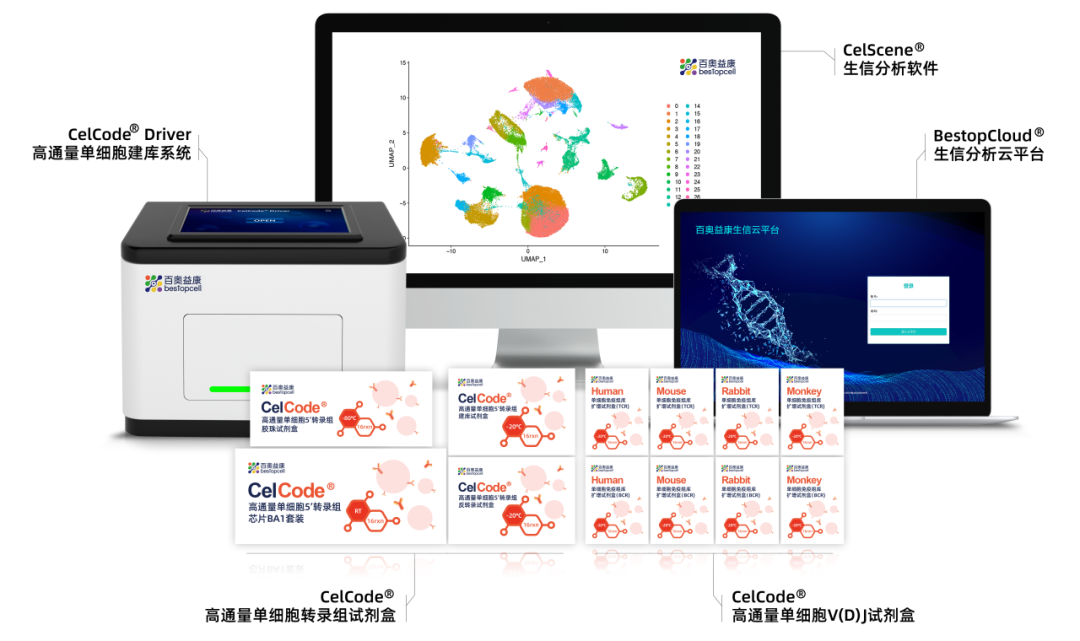
传统单细胞免疫组库测序技术长期面临两大瓶颈:一是物种特异性引物缺失,导致非模式物种(如猴子、猪)的免疫组库数据难以获取;二是单细胞信息获取不足,使得γδTCR等关键受体序列信息无法得到。CelCode®技术通过三大创新突破,重新定义了免疫组库研究的边界。
-
跨物种引物优化设计
针对人、小鼠、猴子、猪、兔子等物种的TCR(αβ/γδ)和BCR(重链/轻链)基因序列,开发了高度适配的引物库。例如,在非人灵长类(如食蟹猴)研究中,通过优化引物结合位点,将TCR配对率提升至84.6%(TRA/TRB),BCR轻重链配对率达83.0%,远超行业平均水平。

2. 单细胞四维信息整合
基于微流控芯片技术,可在单个细胞水平同步捕获转录组、αβTCR、γδTCR和BCR全序列信息。这一能力解决了传统方法中γδT细胞检测的空白——该细胞亚群虽仅占T细胞总数的0.5%-5%,却在肿瘤免疫监视和抗感染中发挥关键作用。

3. 自主可控“全链条”
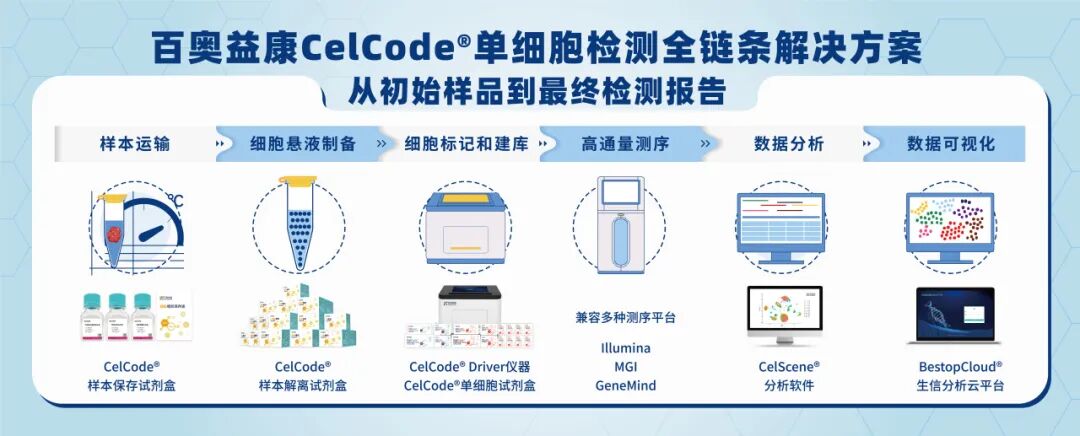
从样本保存解离试剂盒、CelCode® Driver建库仪、全系列试剂芯片,到BestopCloud®生信云平台,Celcode®平台提供从样本到报告的完整解决方案,真正实现一站式服务,技术安全自主可控。
参考文献:
Gu W, Madrid DMC, Clements S, et al. Single-Cell Antigen Receptor Sequencing in Pigs with Influenza. Commun Biol. 2025 Jul 26;8(1):1108. doi: 10.1038/s42003-025-08507-9.





