北京百奥益康医药科技有限公司
1 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
公司新闻/正文
项目文章 | 单细胞+单细胞核测序揭示了表型可塑性与遗传进化的关系以及低氧适应的细胞调控机制
78 人阅读发布时间:2025-11-05 16:28
2025年10月27日,中国农业大学动物科学技术学院李孟华教授团队在SCIENCE CHINA Life Sciences(IF:9.5)上发表题为“Cell-specific gene expression plasticity in response to hypoxia promotes high-altitude adaptive evolution”的研究论文,本研究以绵羊为模型,开展了平原到高原的动物迁移实验,首次构建了低氧条件下重要器官的细胞转录组图谱,为理解低氧适应机制以及低氧相关疾病提供了新的视角。
本文的单细胞转录组和单细胞核转录组测序技术服务由北京百奥益康提供。

摘要
在不断变化的环境中,表型可塑性与遗传适应之间复杂且动态的关系,一直是进化生物学领域长期存在且颇具争议的研究课题。尤其是二者相互作用的分子和细胞机制,尚未得到充分探索。本研究以绵羊为研究对象,开展了平原到高原的迁移实验。共获取了 81 个肺、心、脑组织样本,并构建了单细胞和单核 RNA 测序(scRNA-seq 和 snRNA-seq)数据集。通过对这些绵羊的表型、基因组和细胞转录组数据进行多模态整合分析,从细胞水平上揭示了细胞特异性的基因表达可塑性。此外,还发现,在这三种器官中,存在一个共同的调控网络[激活蛋白 1 家族(AP-1)→低氧诱导因子(HIF)→BHLHE41 网络]以及细胞可塑性,二者共同构成了低氧习服过程中细胞表达可塑性的相关模式。本研究首次构建了低氧习服条件下重要器官的细胞转录组图谱,为理解低氧适应机制以及低氧相关疾病提供了新的视角。
研究结果
1. 单细胞和单核转录组图谱
为探究高海拔低氧环境下主要器官的细胞组成及细胞特异性转录谱,研究为 27 只绵羊的肺、心、脑三种组织构建了 27 个 scRNA-seq 数据集和 54 个 snRNA-seq 数据集。这些绵羊包括:常氧平原环境下的湖羊母羊和羔羊、在低氧习服过程中不同时间点(迁移后 1 周、2 周、3 周和 8 个月)从平原迁移到高原的湖羊,以及已完全适应低氧高原环境的藏羊(图 1A)。经数据整合评估后,利用典型的marker基因,在肺中鉴定出 4 种细胞类型和 21 种细胞亚型,在心脏中鉴定出 8 种细胞类型和 21 种细胞亚型,在脑中鉴定出 8 种细胞类型和 17 种细胞亚型(图 1B)。随后,为每种组织类型构建了细胞图谱(图 1B)。其中,肺中的2型肺泡细胞(占比 52.75%)、心脏中的心肌细胞(占比 61.10%)以及脑中的神经元(占比 53.70%)是各组织中数量最多的细胞类型。同时,在三种组织中也检测到了一些稀有细胞群:肺中表达 MUC5AC 的杯状细胞(占比 0.08%)、心脏中表达 CSF3R 的中性粒细胞(占比 0.07%)以及脑中表达 CFAP54 的室管膜细胞(占比 0.06%)(表S4)。除了已报道的不同细胞类型和亚型的典型marker基因外,研究还鉴定出了一组新的细胞类型和亚型标记基因,且这些marker基因在其对应细胞类型中均有高表达(图 S2)。
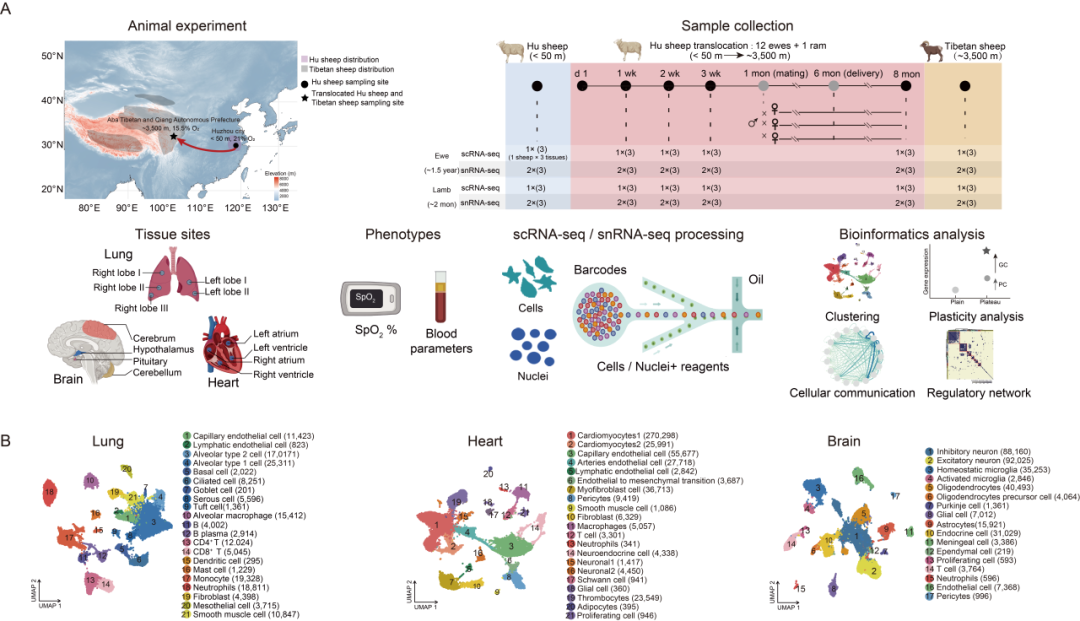
图1. 高海拔适应与适应过程中的单细胞/单核转录组图谱
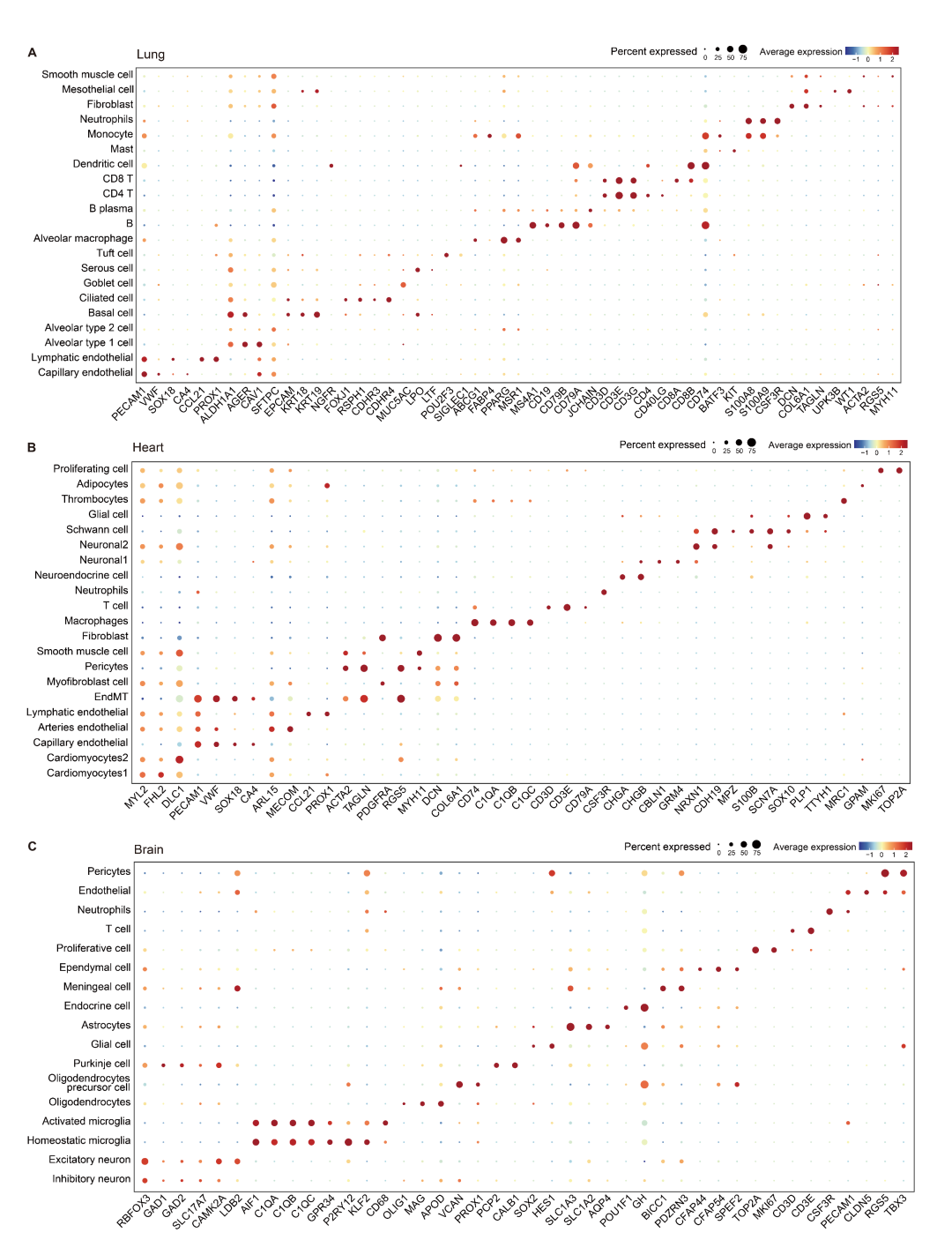
图S2. 肺(A)、心脏(B)、脑(C)中典型基因标志物的表达情况
研究观察到,随着习服时间的推移,细胞比例发生了明显变化。例如,肺中的 1 型肺泡细胞(AT1)、2 型肺泡细胞(AT2)和单核细胞,心脏中的心肌细胞 1、心肌细胞 2 和动脉内皮细胞,脑中的抑制性神经元等主要细胞类型,以及肺中的杯状细胞、心脏中的中性粒细胞、脑中的室管膜细胞等稀有细胞群(图 S3A)。其中,肺中的免疫细胞(如 T 细胞和 B 细胞)、心脏中的内皮细胞(如毛细血管内皮细胞)以及脑中的神经元(如兴奋性神经元)在不同习服时间点的比例变化具有统计学意义(P<0.05)(图 S3B)。
2. 低氧习服过程中的表型可塑性
为探究高海拔(低氧)习服过程中的生理可塑性,分析了 20 项血液指标的表型数据。这些数据均在绵羊空腹状态下测定,并分析了这些指标在四个习服时间点的变化情况(图 S3C)。结果显示,平原湖羊与迁移 1 周后的湖羊相比,SpO₂平均值显著下降,而在后续时间点,迁移湖羊的 SpO₂则持续上升,这表明绵羊对低氧环境具有一定的适应能力。除 SpO₂外,其他几项与无氧代谢和抗氧化防御相关的指标在习服过程中也发生了明显变化(图 S3C),这体现了绵羊在应对低氧时无氧代谢的调节能力。这些结果表明,在低氧习服过程中,血氧水平(SpO₂)调节、代谢途径(GLU 和 LDH)以及抗氧化能力(SOD、CAT 和 GSH-Px)等表型可塑性发挥着重要作用,可能是绵羊低氧适应机制的重要组成部分。
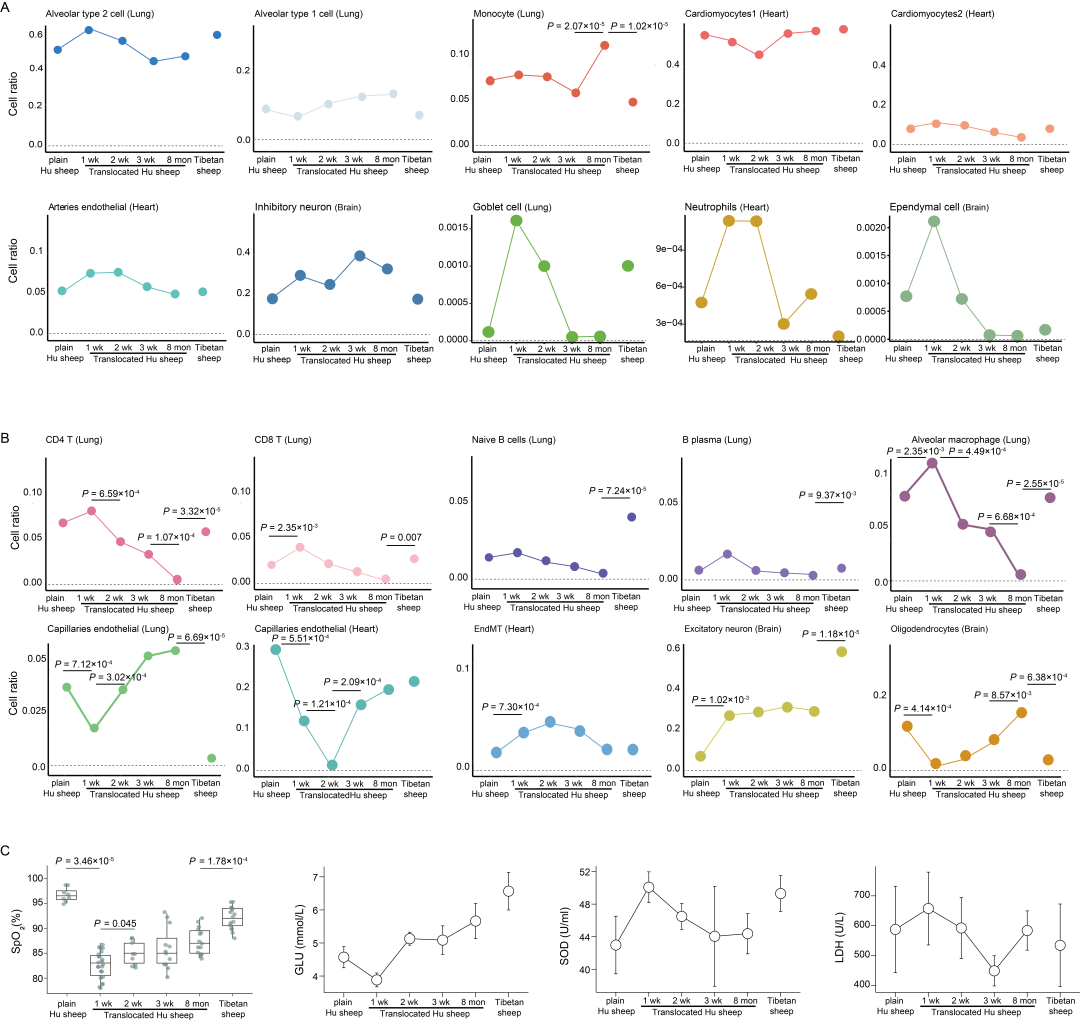
图S3. 湖羊和藏羊体内各细胞比例及表型数据变化情况
3. 细胞特异性表达可塑性在适应过程中普遍逆转
研究分别鉴定了三种组织中每种细胞类型在低氧习服(即平原湖羊与迁移湖羊对比)和适应(即迁移湖羊与藏羊对比)过程中的差异表达基因(DEGs)。其中,习服过程中检测到的差异表达基因定义为可塑性基因,适应过程中检测到的差异表达基因定义为分化表达基因,以四个习服时间点可塑性基因的并集占所有表达基因并集的比例作为衡量标准。研究发现不同细胞类型的基因表达可塑性程度存在明显差异。例如,肺中的单核细胞、浆细胞、1 型肺泡细胞,心脏中的毛细血管内皮细胞、心肌细胞 1、周细胞,以及脑中的内分泌细胞、兴奋性神经元、稳态小胶质细胞,在各自组织中均表现出最高的可塑性程度(图 2A),这些细胞类型被视为高可塑性细胞类型。
为阐明表达可塑性与遗传适应之间的关系,研究分析了每种细胞类型中重叠的可塑性基因和分化表达基因在习服和适应过程中的转录变化方向(上调或下调)。将表达变化方向相同的基因定义为增强基因,方向相反的基因定义为逆转基因(图 2B)。值得注意的是,在几乎所有细胞类型中(除脑内中性粒细胞外),四个习服时间点的逆转基因平均数量显著多于增强基因(补充信息)。其中,肺中的单核细胞、心脏中的毛细血管内皮细胞以及脑中的稳态小胶质细胞,分别是各自组织中逆转基因平均数量最多的细胞类型(图 2C)。这些结果表明,逆转基因和增强基因之间存在真实差异,且在细胞水平上,遗传适应新环境的过程通常会逆转基因表达可塑性。随后,研究分析了习服和适应过程中增强基因和逆转基因转录变化的幅度。结果发现,在大多数细胞类型中(习服过程中 41 种细胞类型中的 33 种,适应过程中 41 种细胞类型中的 30 种),四个习服时间点的逆转基因平均转录变化幅度显著大于增强基因,特别是高可塑性细胞类型(图 2D)。这些结果表明,在细胞水平上,逆转基因和高可塑性细胞类型在促进低氧环境习服和适应过程中发挥着主要作用。
研究进一步评估了逆转基因/增强基因在低氧习服和适应过程中的进化意义。将四个习服时间点的逆转基因/增强基因并集与先前报道的低氧适应基因进行交集分析,以鉴定细胞类型特异性的适应性逆转基因/增强基因。结果发现,高可塑性细胞类型含有大量的适应性逆转基因和增强基因(图 2E)。这表明这些细胞类型中的逆转基因/增强基因更容易受到选择压力,在适应性进化中发挥重要作用。值得注意的是,肺中的单核细胞、浆细胞和 1 型肺泡细胞,心脏中的心肌细胞 1 以及脑中的兴奋性神经元,在四个习服时间点以及至少两个习服时间点,其适应性逆转基因和适应性增强基因的 FST 值均呈现出相同的差异模式(图 2F)。这些结果表明,在低氧习服和适应过程中,逆转基因比增强基因承受更强的选择压力,对进化的贡献更大,尤其是在高可塑性细胞类型中。
为探究后代对高海拔低氧的习服和适应情况,研究通过对三组羔羊(即平原湖羊羔羊、高原湖羊羔羊和藏羊羔羊)进行两两比较,鉴定了三种组织中每种细胞类型的DEGs。结果显示,在三种组织中,高原湖羊羔羊与藏羊羔羊之间的差异表达基因数量平均少于平原湖羊羔羊与藏羊羔羊之间的差异表达基因数量。此外,平原湖羊羔羊与高原湖羊羔羊之间的差异表达基因与逆转基因的交集比例(肺为 37.10%,脑为 38.73%)显著高于其与增强基因的交集比例(肺为 22.40%,脑为 32.1%)(补充信息)。这些结果表明,成年绵羊中逆转基因比例高于增强基因的模式,在羔羊的低氧习服和适应过程中同样存在。
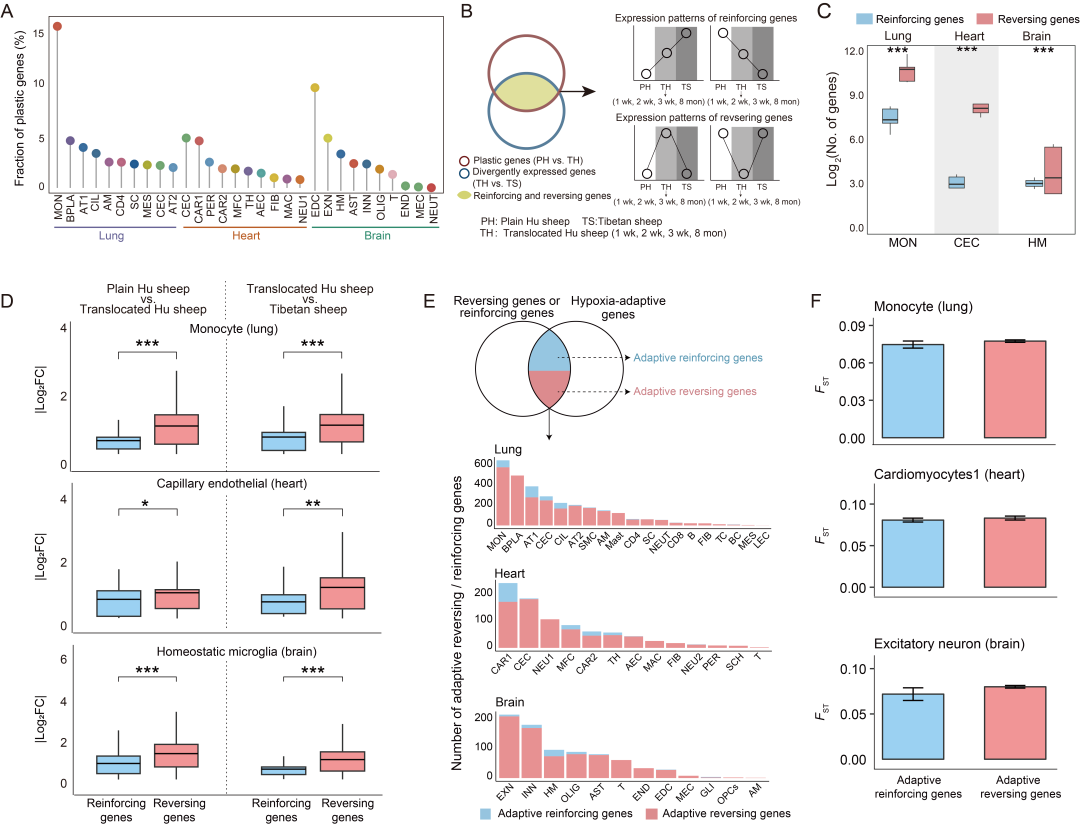
图2. 在适应与适应过程中细胞特异性表达的可塑性
4. 细胞水平上逆转基因和增强基因的功能意义
研究进一步探究了逆转基因和增强基因的功能。通过功能富集分析发现,每种细胞类型在四个习服时间点的逆转基因/增强基因并集中的基因,均富集于低氧相关的GO和KEGG通路。对于每个相关的通路,逆转基因富集的细胞类型数量更多,且每个细胞类型中富集的平均基因数量也更多(图 3A)。这表明,与增强基因相比,逆转基因与低氧适应的关联性更强,且在更广泛的细胞类型中富集。在细胞类型水平上,对于多种细胞类型(如肺中的单核细胞和中性粒细胞、心脏中的毛细血管内皮细胞和巨噬细胞、脑中的稳态小胶质细胞和内分泌细胞),逆转基因富集的低氧相关通路数量多于增强基因(图 3B),这凸显了这些细胞类型中的逆转基因在低氧适应中的关键作用。
研究还对四种与低氧适应相关的基因类别[逆转基因、增强基因、低氧适应基因(即选择基因)和其他可塑性基因(即除逆转基因和增强基因外的可塑性基因)] 在四个习服时间点每种细胞类型中的细胞特异性转录变化幅度进行了拟合和比较。结果显示,在肺的 8 种细胞类型以及心、脑各 2 种细胞类型中,逆转基因的转录变化幅度在这四类基因中最大(图 3C),其中包括高可塑性细胞类型。这表明高可塑性细胞类型中的逆转基因在低氧习服中发挥着主要作用。具体而言,肺中单核细胞的部分逆转基因(如 NCOA3、GNAQ 和 CSRNP2)在四个习服时间点的表达持续下降(图 3D),这可能对低氧习服产生持久影响。
鉴于经典 HIF-1 通路在调控低氧适应中的核心作用,随后重点关注了 HIF-1 通路相关基因的潜在表达可塑性。对于每种组织,将 HIF-1 通路相关基因与四个习服时间点的细胞特异性逆转基因或增强基因进行交集分析,并考察了重叠的 HIF-1 通路相关基因在不同细胞类型中的分布情况。结果发现,在习服过程中,肺的多种细胞类型中存在两个属于逆转基因的 HIF-1 通路基因——RPS6 和 CAMK2D。免疫细胞中 RPS6 的平均表达水平较高,而与形态相关的细胞类型中 CAMK2D 的平均表达水平较高(图 3E、F)。这一结果与 RPS6 和CAMK2D 在疾病中调控mRNA翻译以及调节组织重塑的已知功能相符。值得注意的是,在特定细胞类型中,还鉴定出了多个重要的 HIF-1 通路相关逆转基因,例如肺中单核细胞的 IL6R、1 型肺泡细胞的 NFKB1、2 型肺泡细胞的 EPAS1 和平滑肌细胞的 ANGPT1,心脏中毛细血管内皮细胞的 EPAS1 和巨噬细胞的 HIF1A,以及脑中兴奋性神经元和抑制性神经元的 ALDOC(图 3G),这些基因的功能均与低氧适应密切相关。综上,本研究鉴定出了在低氧习服和适应过程中具有重要功能的特定逆转基因和细胞类型。
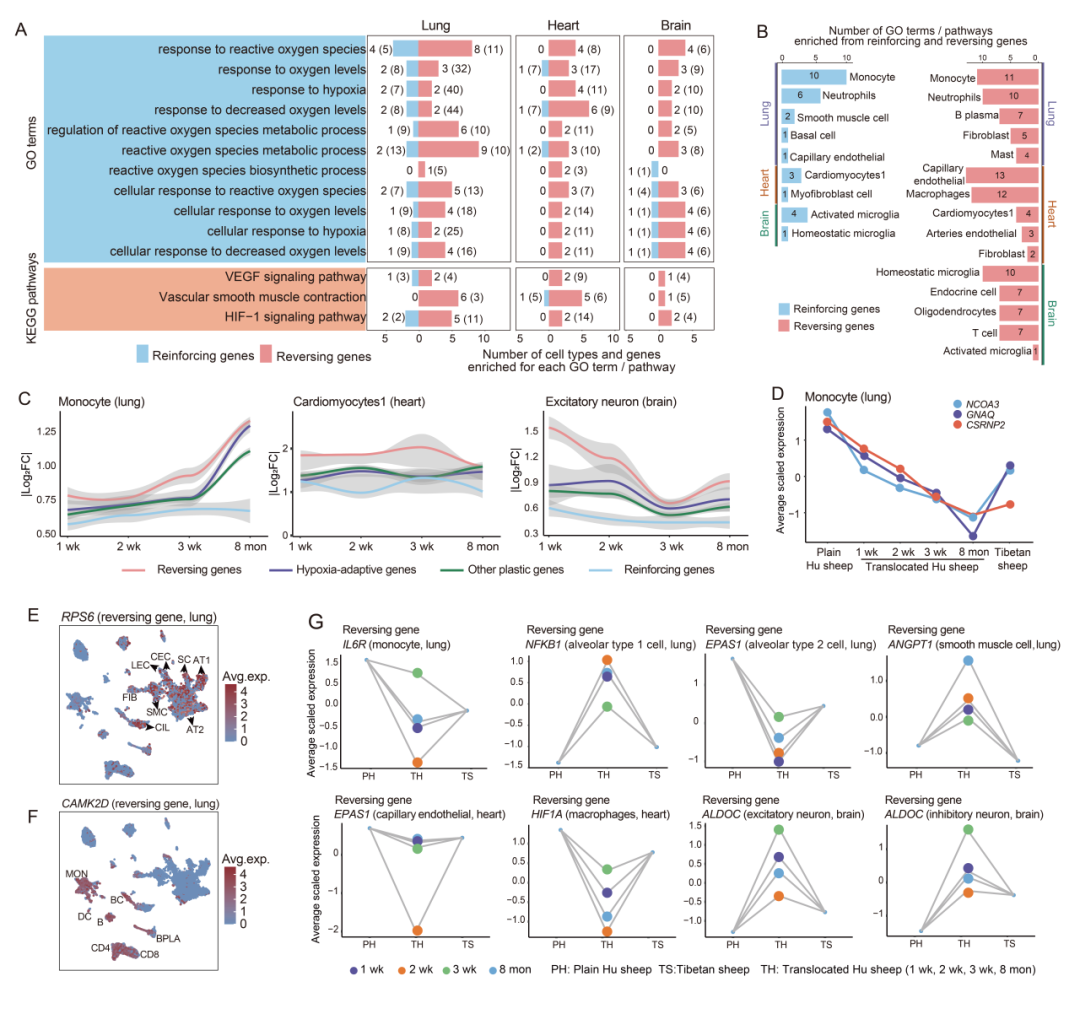
图3. 在细胞层面逆转和增强基因所产生的功能影响
5. 高海拔低氧环境下细胞特异性转录调控网络与互作网络
为解析高海拔低氧环境下的转录调控网络,研究首先预测了平原湖羊、不同习服时间点的迁移湖羊以及藏羊三种组织中的核心转录因子(TFs)。结果显示,肺、心、脑中分别有 99、111 和 77 个调控单元,这些调控单元又分别组成了 7、8 和 8 个主要模块(图 4A)。对于每个模块,研究通过平均活性评分确定了代表性调控因子和相关细胞类型。值得注意的是,多个重要模块与低氧适应和免疫细胞相关(图 4A)。例如,肺和心脏的模块 1(M1)包含与多种免疫细胞相关的调控因子,且功能上富集于低氧相关转录因子(如肺中的 HIF1A、FOS、CEBPD 和 BHLHE41;心脏中的 FOS、FOSB 和 BHLHE41)。此外,脑的模块 2(M2)包含数量最多的转录因子和靶基因(11 个转录因子和 867 个靶基因),该模块具有逆转表达可塑性,与低氧适应相关,且与稳态小胶质细胞、活化小胶质细胞和中性粒细胞相关(图 4A)。M2中的多个代表性转录因子属于激活蛋白 1(AP-1)家族,该家族能与 HIF-1 通路的核心成分 HIF1A 相互作用。研究进一步构建了M2的转录因子-基因调控网络,发现其靶基因与低氧相关基因存在显著重叠(图 4B)。在这些靶基因中,只有逆转基因在与低氧适应相关的关键通路中得到了富集(例如,HIF-1 通路和血管内皮生长因子(VEGF)通路),这表明 M2 可通过具有逆转可塑性的关键基因响应低氧环境来调节这些核心通路(图 4B)。
关于高海拔低氧环境下心、肺、脑之间的细胞水平互作,研究探究了它们潜在的细胞间通讯网络(图 4C)。结果显示,在不同时间点,三种组织间细胞类型的互作密度存在差异,其中在迁移 1 周时,脑内不同细胞类型间的互作最为广泛(图 4C)。利用 DIISCO 软件预测了习服过程中随时间变化的动态细胞间互作,发现小胶质细胞和中性粒细胞在脑内细胞间互作中发挥关键作用(图 4D)。具体而言,在迁移后 1 周、2 周和 3 周,分别是稳态小胶质细胞、活化小胶质细胞和中性粒细胞参与的互作最强(图 4D)。随后通过对配体-受体和表达可塑性的整合分析来探究细胞间通讯。结果显示,在所有绵羊群体的三种组织中,被鉴定为逆转基因的配体-受体对的细胞间通讯强度显著高于被鉴定为增强基因的配体-受体对,尤其是在迁移 1 周的湖羊脑组织中(图 4E)。这些结果强调了逆转基因在调控低氧环境下细胞间通讯中的重要作用。
为解析习服和适应过程中不同类型配体-受体对的作用,将仅在藏羊中发现的配体-受体对定义为高原配体-受体对(PLRs),在不同时间点迁移湖羊中均存在的配体 - 受体对定义为习服配体-受体对(ALRs),而 PLRs 与 ALRs 的交集则定义为共同配体-受体对(CLRs)(图 4F)。在肺、心、脑中分别鉴定出 10、7 和 75 个 CLRs,其中三种组织中分别有 9、2 和 10 个 CLRs 由逆转基因介导(图 4F)。此外,重点关注了脑中 10 个由逆转基因介导的 CLRs,发现这些 CLRs 主要与稳态小胶质细胞、活化小胶质细胞和中性粒细胞中的受体相关(图 4G)。值得注意的是,CLRs 中 IGF2_IGF1R 的受体和配体基因是 HIF-1 通路的关键基因,且在迁移后 3 周和 8 个月时高表达(图 4G),这表明它们在低氧习服过程中对脑内通讯具有持久影响。综上,研究结果表明,免疫细胞(如脑内的稳态小胶质细胞、活化小胶质细胞和中性粒细胞)中具有逆转表达可塑性的特定转录因子、转录模块和共同配体-受体对,在低氧短期习服和长期适应过程中的转录调控和细胞间通讯中发挥重要作用。
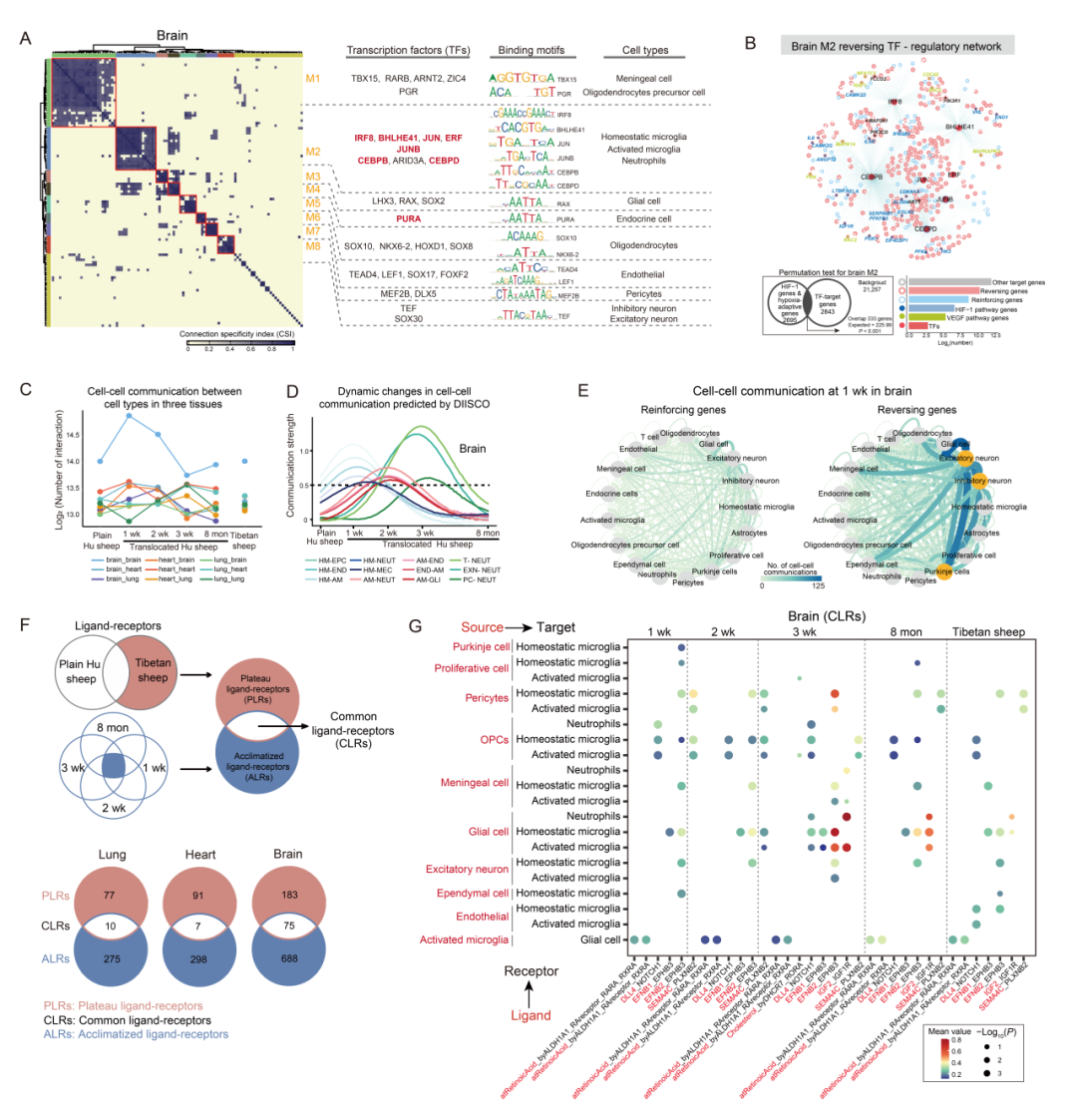
图4. 缺氧环境下的转录网络和相互作用网络
6. 高海拔低氧环境下内皮细胞和小胶质细胞的可塑性
对细胞比例变化和基因表达可塑性的分析表明,心脏中的毛细血管内皮细胞和脑中的稳态小胶质细胞可能是低氧习服过程中参与细胞可塑性的关键细胞类型。有研究发现,在低氧条件下,人类心脏疾病中存在内皮细胞向内皮间质转化(EndMT)细胞的转变。因此,研究通过拟时序轨迹分析,探究了这些细胞的谱系关系,以解析高海拔低氧环境习服过程中的细胞可塑性机制。结果显示,推断的细胞谱系起始于毛细血管内皮细胞,最终分化为 EndMT 细胞(图 5A)。根据拟时序轨迹分析中基因的动态变化,将其分为 5 个集群,并发现这些基因与内皮细胞发育、心脏发育以及氧响应过程相关(图 5B)。在早期阶段,集群 1 中的基因与细胞外基质形成(如 ADAMTS1、AEBP1 和 BMP2)和内皮发育(如 CLDN5、CLIC4 和 GJA5)相关;在中期阶段,集群 2(如 EFNB2、SMAD7 和 TGFB2)和集群 3(如 PTPPR、CCL16 和 EPHB1)中的基因分别与心肌组织发育和心脏间隔形态发生相关;在晚期阶段,集群 4(如 THBS1、ADM 和 FOS)和集群 5(如 FLNA、MYH9 和 SDC4)中的基因参与氧水平响应和伤口愈合过程。值得注意的是,沿拟时序轨迹,内皮细胞特异性基因(如 CLDN5、VEGFA、TGFB2 和 PECAM1)的表达整体呈下降趋势,而间充质细胞特异性基因(如 ACTA2、TAGLN、DCN 和 RGS5)的表达整体呈上升趋势(图 5C)。其中,TGF-β 通路中的核心基因TGFB2可介导多种人类疾病中的 EndMT 过程,是一种关键诱导因子,其表达下降可能推动低氧习服过程中与 EndMT 相关的细胞可塑性。
为评估脑内的细胞可塑性,研究对小胶质细胞进行了注释,并分析了其活化轨迹。研究鉴定出三种稳态小胶质细胞亚型(即 HM_CD83、HM_P2RY12 和 HM_PRL)和三种活化小胶质细胞亚型(即 AM_S100A4、AM_PDGFC、AM_CXCL8)(图 5D)。轨迹推断发现小胶质细胞谱系活化轨迹从 HM_CD83 出发,经过 HM_PRL 和 AM_S100A4,最终到达 AM_CXCL8,这一结果得到了基于 Palantir 工具的拟时序分析的支持(图 5D)。根据拟时序轨迹中基因的动态变化,将其分为 5 个集群,并探究了不同阶段基因的功能(图 5E)。在早期阶段,集群 1 中的 107 个基因高表达,这些基因在功能上与免疫细胞分化和活化(如 CD83、CEBPB 和 CFLAR)以及低氧响应(如 CFLAR、EGR1 和 HSP90B1)相关(图 5E),这表明低氧可在早期启动小胶质细胞的活化。在中期阶段,集群 2 中的 29 个基因(如 HSPB1、CCND1 和 HSPA1A)和集群 3 中的 50 个基因(如 PSMB9、IFI6 和 CTSD)高表达,这些基因与细胞分解代谢相关。在晚期阶段,集群 4 中与免疫相关的基因(如小胶质细胞标记基因 C1QA、C1QB 和 C1QC)的表达沿轨迹逐渐增加,这表明在此期间免疫细胞活化的正调控作用逐渐增强(补充信息中的表 S31)。此外,集群 5 中与凋亡信号通路调控(如 SOD2、ICAM1 和 MCL1)和低氧响应(如 SOD2、UCP2 和 PLAU)相关的基因高表达(图 5E)。多维加权基因共表达网络分析(hdWGCNA)显示,在拟时序中期之后,部分模块(如蓝色、棕色、青绿色、粉色和红色模块)中经典稳态小胶质细胞标记基因(如 P2RY12、GPR34 和 CX3CR1)的表达下降,而绿色模块中活化小胶质细胞标记基因(即 CD86)的表达在中期之后逐渐上升(补充信息)。这些模式与相应标记基因沿拟时序轨迹的表达模式一致(图 5E、F)。综上,本研究首次解析了内皮细胞向 EndMT 细胞以及稳态小胶质细胞向活化小胶质细胞转变的细胞可塑性轨迹,以及低氧习服不同阶段相关基因的功能,为心脏和脑应对高海拔低氧的细胞响应机制提供了重要的实证依据。
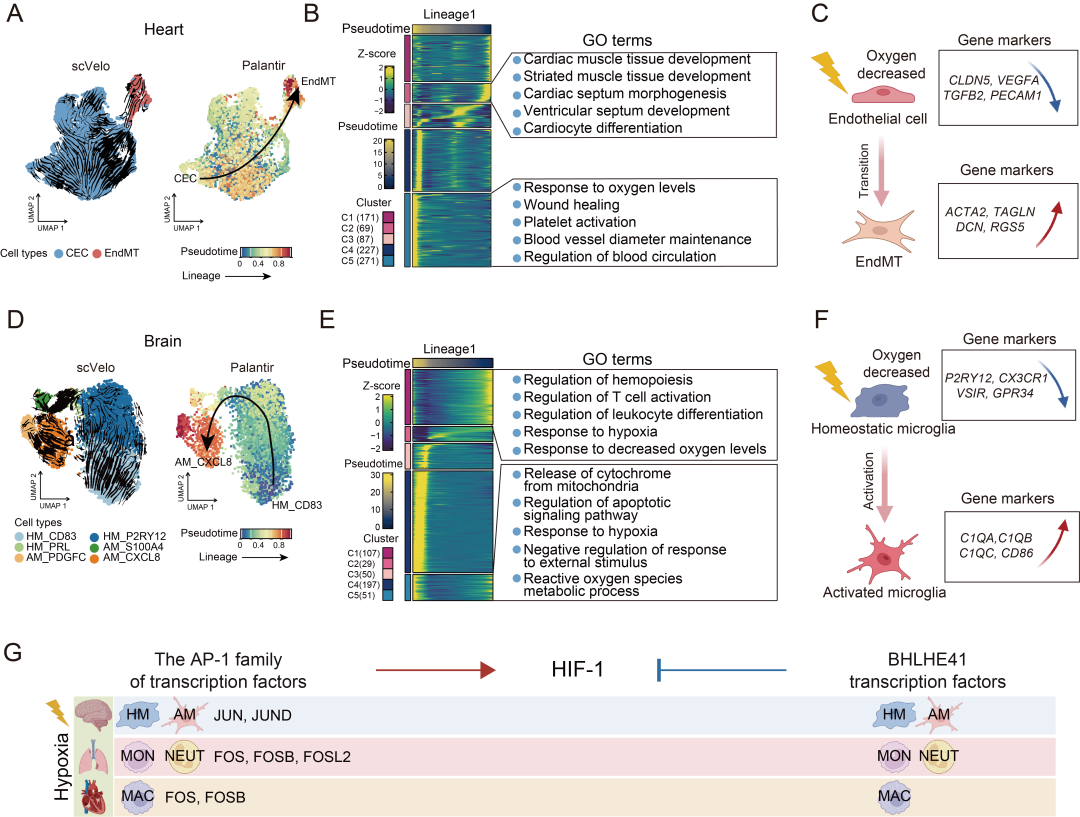
图5. 细胞对高海拔低氧环境的适应性变化
7. 与低氧适应相关的细胞可塑性模式及其对低氧相关疾病的启示
关于基因表达可塑性、转录调控与互作网络以及细胞可塑性的主要研究结果(图 3-5),揭示了低氧习服和适应过程中基因转录丰度的相关模式(图 5G)。这些模式的核心是一个由 HIF-1 通路关键成分和免疫细胞(如肺中的单核细胞、心脏中的巨噬细胞和脑中小胶质细胞)中的转录因子 AP-1、BHLHE41 组成的核心调控网络(图 5G)。AP-1 主要由 JUN、FOS 和 ATF 家族的转录因子组成,在低氧条件下可与 HIF 发生正向相互作用;而 BHLHE41 则被证实可促进 HIF 的降解。该核心调控网络可能通过动态调节 HIF 水平来应对氧浓度的变化。
为揭示细胞可塑性对低氧相关疾病的潜在意义,研究收集了与人类几种主要低氧相关疾病相关的候选功能基因(补充信息中的表 S33),并基于绵羊中的基因表达模式,量化了每种细胞类型与这些疾病相关的疾病评分。结果表明,高评分细胞类型(如肺中的 1 型肺泡细胞、心脏中的心肌细胞和脑中的兴奋性神经元)和可塑性疾病基因(即本研究中与可塑性基因重叠的疾病基因)对低氧相关疾病的发生发展具有更大的影响(补充信息中的图 S21)。
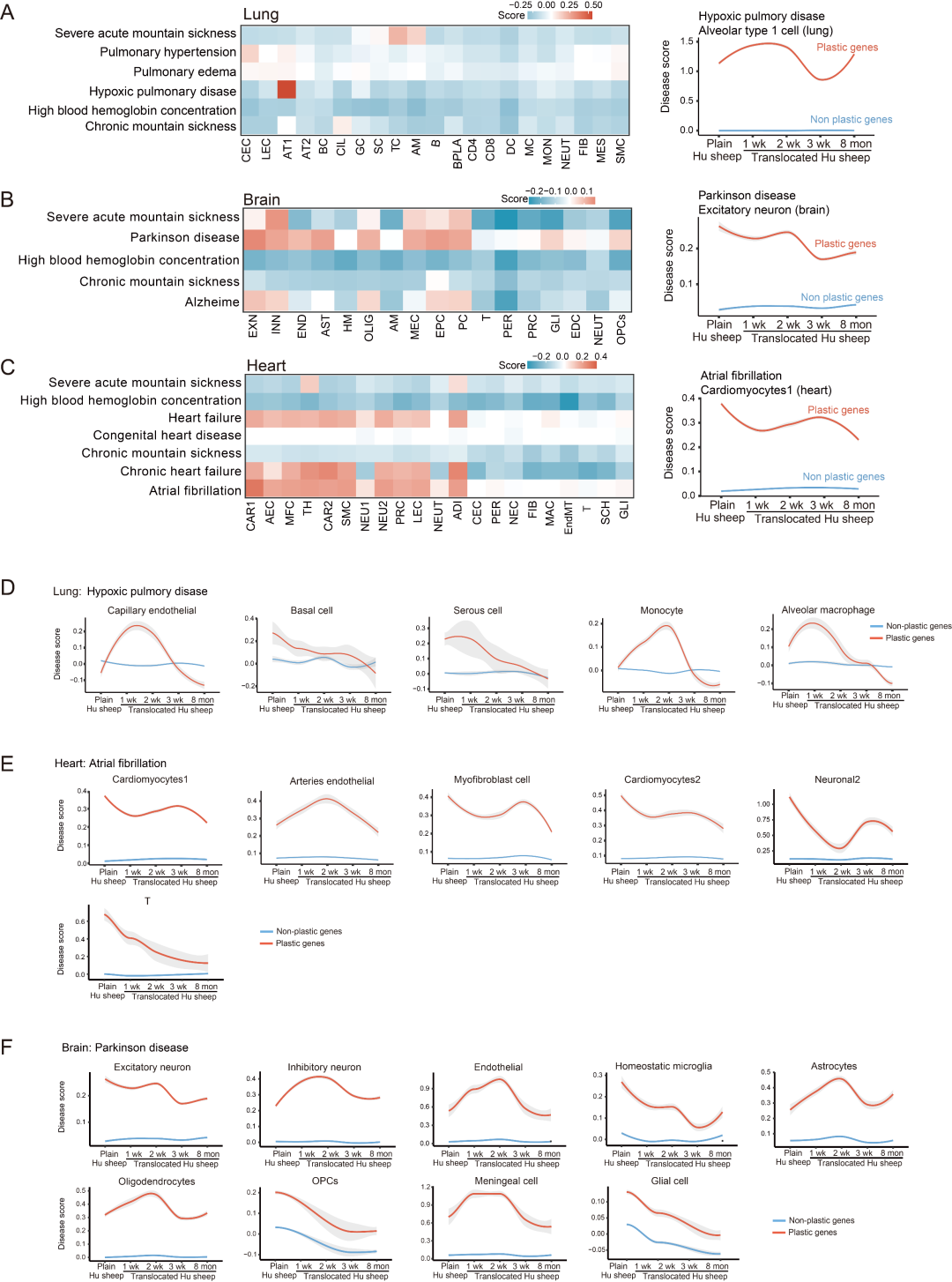
图S21. 在三种组织的特定细胞类型适应过程中,塑性基因和非塑性基因的疾病评分情况
总结
综上所述,本研究以绵羊为模型,首次构建了常氧和低氧环境下重要器官的细胞转录组图谱。关于细胞特异性可塑性如何影响适应的研究结果,对于预测环境变化(如全球气候变化导致的低氧)对人类和其他哺乳动物的短期和长期影响至关重要。以 HIF 为核心的细胞和基因表达可塑性模式,为理解低氧习服和适应的关键细胞类型及调控网络提供了新视角,为解析低氧适应和低氧相关疾病的分子和细胞机制提供了重要资源。
参考文献: