Olink Proteomics品牌商
1 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
HIV病毒抑制后的并发症机制解析:多组学揭示“炎症风暴”与“衰老加速”之谜
77 人阅读发布时间:2025-09-15 09:16

德国亥姆霍兹感染研究中心领衔的国际团队在《Nature Medicine》发表的题为" Genetic and molecular landscape of comorbidities in people living with HIV "的研究,通过多组学整合分析揭示了PLHIV共病风险和个体易感性差异的分子基础,为HIV感染者精准医疗提供了新的方向。
研究方法
基于荷兰2000HIV项目,纳入了1,342例病毒抑制的PLHIV(89%为男性,中位年龄54岁,中位感染时长10年),并将其分为发现队列(N=1,075)和验证队列(N=267)。
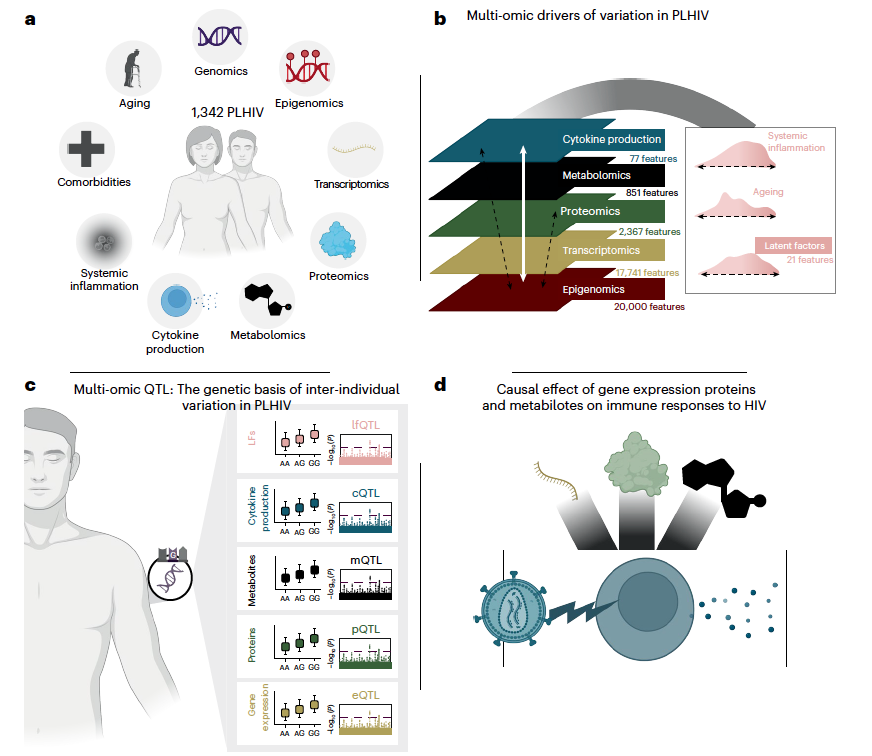
通过五维多组学数据(基因组学,表观基因组学,转录组学,蛋白质组学和代谢组学)进行了系统性研究,并评估了外周血单个核细胞(PBMCs)的体外细胞因子产生能力。其中,Olink Explore平台提供了2,367种蛋白质的准确定量数据,覆盖了全面的主要生物学通路,为生物学机制的关键发现奠定了基础。
核心突破
● 多组学模型揭示疾病相关分子特征
此外,研究发现多个LFs与特定临床并发症存在显著关联:
• LF6:在合并颈动脉斑块的PLHIV人群中显著升高,其组成以血浆蛋白质为主,其显著富集于先天免疫激活和NF-κB信号通路;
• LF8:与心血管疾病(CVD)和内分泌失调呈负相关,主要由蛋白质和代谢物构成,在合并心肌梗死或高血压的感染者中水平显著降低;
• LF11:与COPD风险正相关,特征为CD8⁺ T细胞功能增强,提示了细胞免疫功能失调在肺部疾病中的作用;
• LF20:与疾病快速进展(HIV感染后CD4⁺ T细胞急剧下降)显著相关,其特征是DNA甲基化主导和 dSKAPI基因表达的降低。
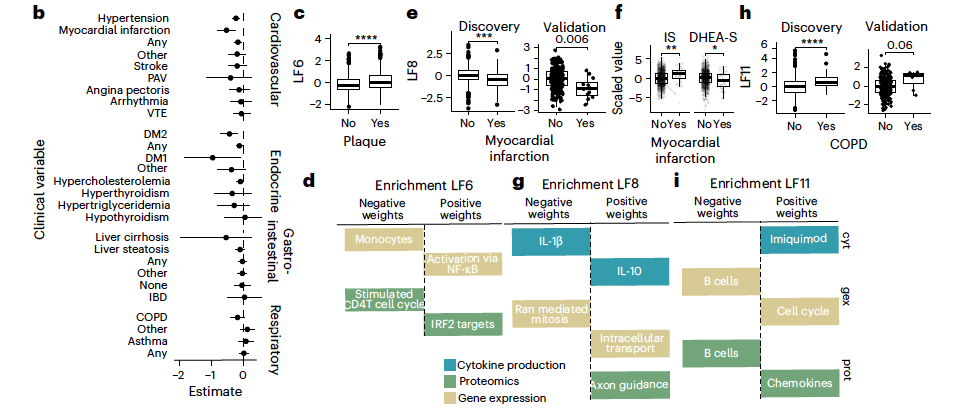
● QTL描绘“基因调控网络图”
研究发现,PLHIV中的eQTL、pQTL和mQTL与健康人群中的效应高度一致(>98%方向一致),在蛋白质水平(pQTL)上,与英国生物样本库(UK Biobank)数据的效应方向一致性高达99.94%。这表明HIV感染和ART并未普遍改变基础的遗传调控架构。
此外,研究鉴定出42个cis-eQTL 在PLHIV中表现出与健康人群相反的调控效应,提示存在HIV感染特异性的遗传调控机制。这一发现为理解HIV感染导致的分子水平改变提供了新的视角。研究还发现了13个新的cQTL(细胞因子QTL),揭示了两个已知的免疫反应相关多态性区域,发现了两个位于基因上游的调控位点,它们能够调节 CCL2(MCP-1)和 CCL3(MIP-1α)的细胞因子表达水平以和蛋白质浓度。
● 逆转炎症反应的“钥匙”
研究还发现了与多种细胞因子刺激组合存在关联的蛋白质,其中IL-17D的高表达能够因果性地降低免疫细胞在接触到HIV病毒包膜蛋白后产生的两种关键促炎细胞因子——CCL3和IL-1β。这表明,提升IL-17D水平或活性,可能有助于打破导致持续炎症的恶性循环。
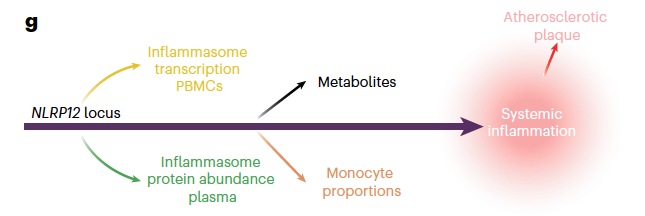
变异位点rs34436714与292种蛋白水平显著相关,表明了它在调控蛋白质网络中的作用;与2种代谢物(AMP和牛磺酸) 的水平相关,这两种代谢物均与细胞能量代谢和炎症调节有关。在转录组层面,rs34436714的G等位基因与 NLRP3 炎症小体蛋白的浓度呈正相关,同时与该基因的转录呈负相关,揭示了一种复杂的反馈调节机制。此外,对免疫细胞比例的检测表明,该位点还与外周血中单核细胞亚群的比例相关,而单核细胞也是动脉粥样硬化斑块形成的关键参与者。
综上表明,NLRP12 位点通过不同分子层面对炎性小体途径进行了全身性调节,从而在 PLHIV 中引发全身性炎症,并促进了颈动脉斑块的形成。
这项里程碑工作为理解PLHIV并发症机制和开发精准治疗奠定了坚实基础,标志着HIV研究进入多组学数据整合的新时代。但研究队列主要集中于欧洲裔男性,缺乏其他种族和女性群体的数据。基于已发现的分子特征与机制,未来的研究具有多个方向,包括:利用多组学特征构建非艾滋病相关共病的个体化风险预测模型,开发针对关键通路的靶向治疗策略,建立基于遗传背景与分子表型的HIV患者分层等。我们期待这些方向能取得更多突破性进展,为HIV感染者带来更精准、更有效的医疗干预措施。
参考资料: