江苏瀚江生物科技有限公司
1 年
手机商铺
- NaN
- 0.20000000000000018
- 1.2000000000000002
- 0.20000000000000018
- 3.2
公司新闻/正文
实操前必看|一文区别PCR和RT-qPCR,你的实验应该选哪种?
630 人阅读发布时间:2025-08-12 13:18
在分子生物学研究中,PCR技术已成为不可或缺的工具。然而,传统PCR与RT-qPCR在原理和应用上存在显著差异。本文将系统剖析这两种技术的核心原理、详细实验步骤,并从多个维度进行全面对比,帮助科研小伙伴们准确选择适合的实验方法~
01 PCR技术详解
基本原理
聚合酶链式反应(Polymerase Chain Reaction,PCR)由Kary Mullis于1983年发明,其核心原理是通过温度循环系统实现DNA片段的指数级扩增,该过程模拟了体内DNA复制的基本过程,但全部在体外完成。
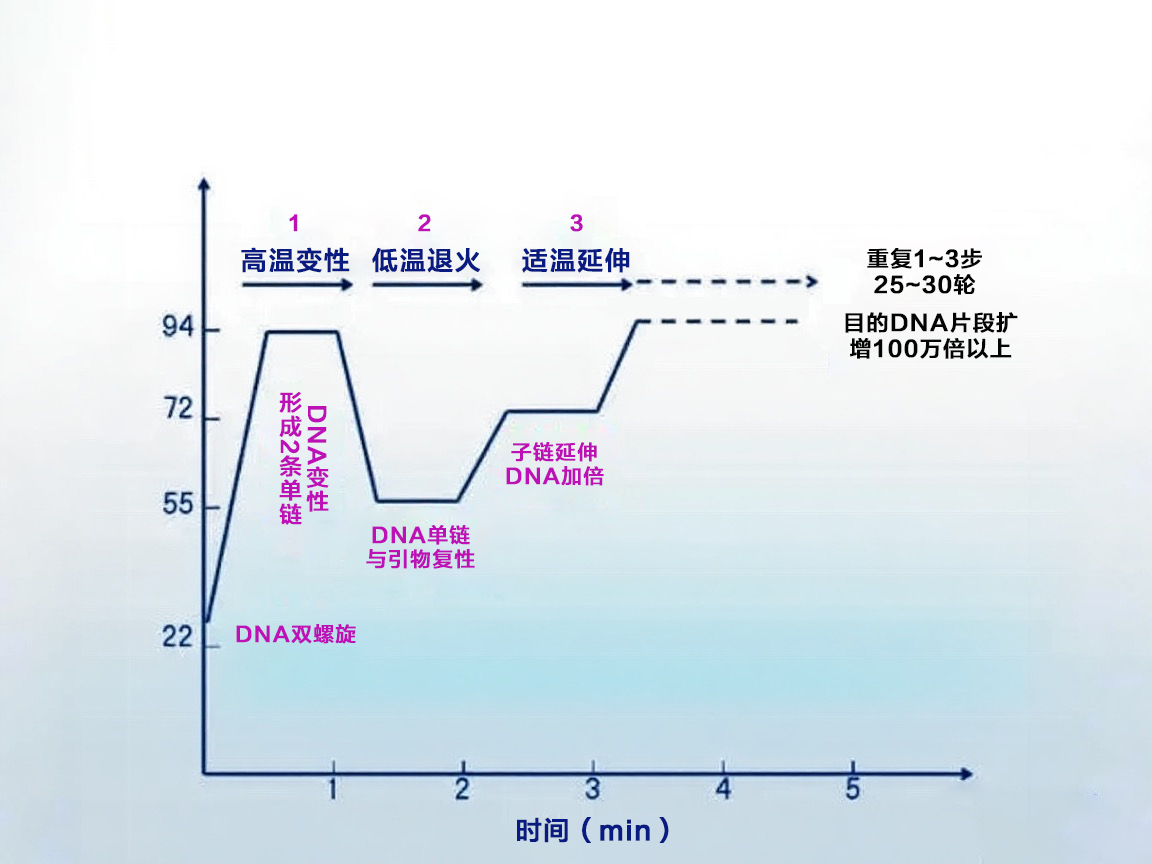
pcr实验原理图
三步骤循环:
1.变性(Denaturation):94-95℃下双链DNA解离为单链
2.退火(Annealing):50-65℃时引物与模板特异性结合
3.延伸(Extension):72℃左右DNA聚合酶沿模板合成新链
原理总结:在经历一次变性→退火→延伸的流程之后,原本只有1条的DNA双链变成了2条;2次之后是4条;以此类推,经过变性、退火和延伸重复若干个循环后,就能将待扩目的基因扩增放大几百万倍,但扩增完成后,单纯的过程无法进行检测鉴定,想要检测,还需要借助凝胶电泳分析。
应用场景
1.分子克隆:TA克隆/限制性酶切位点添加
2.基因分型:突变检测(需结合酶切/测序)
3.病原检测:细菌/病毒保守序列扩增
4.教学实验:DNA指纹分析等基础训练
技术优势与局限
| 忧势 | 局限 |
| 操作简单、成本低廉 | 无法精确定量 |
| 可扩增长片段(达40kb) | 电泳环节增加污染风险 |
| 对模板质量要求较低 | 灵敏度较低(103拷贝) |
02 实时荧光定量PCR技术详解
基本原理
实时荧光定量PCR(Real-time PCR,Quantitative Real-time PCR,qPCR),即第二代PCR技术,是指在整个扩增的过程中,引入了荧光染料或者荧光基团,随着DNA数量的成倍增加,反应体系中的荧光信号也会增强。 在整个PCR反应过程中,借助对荧光信号的强弱进行检测实时监测每一个循环中扩增产物量的变化,最后通过标准曲线和CT值对待测检测样品进行定量分析。
qPCR常用的有两种方法:SYBR Green法和TaqMan探针法。
1.荧光染料法——SYBR Green法
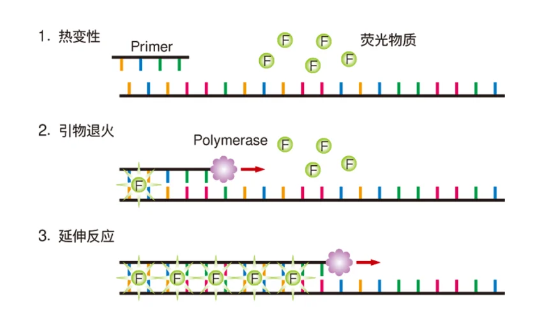
SYBR Green法实验原理图
SYBR GreenⅠ是荧光定量PCR常用染料,与双链DNA结合产生荧光信号,信号强度与DNA量成正比。但非特异性结合可能导致假阳性。
优势:成本低、使用方便、灵敏度高;
缺点:特异性低,不能用于多重PCR检测。
2.荧光探针法——TaqMan技术
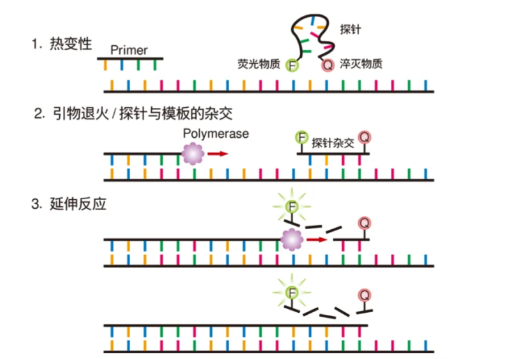
TaqMan法实验原理图
依据目标基因序列,构建一种特异性结合的荧光探针,该探针由两个功能基团构成,即荧光基团与淬灭基团。在无反应状态下,由于淬灭基团的作用,荧光基团的发光能力被抑制,在DNA扩增反应中,探针与模板DNA特异性结合,并在扩增至探针位点时,两个基团被酶切分离,导致荧光基团得以发光,随着DNA拷贝数的增加,荧光信号强度相应增强。
优点:检测特异性强、灵敏度高,适合多重qPCR检测;
缺点:需根据不同模板序列合成不同探针,靶序列浓度极低或存在大量非特异性扩增时无法准确定量。
小贴士:Real-time PCR和qPCR是同一码事儿,都是实时荧光定量PCR哦!
应用场景
1.基因表达差异分析
2.microRNA等小RNA研究
3.病毒载量精确测定
4.药物处理后的转录调控研究
5.需要高灵敏度检测的场合
总的来说,不同的PCR方法各有特点,理解它们的区别和联系是设计分子实验的基础,传统PCR是DNA研究的基石,而RT-qPCR为RNA定量分析提供了强大工具,科研小伙伴们应根据具体科学问题、样本特点和实验条件,合理选择技术路线,无论选择哪种方法,严格的实验对照、优化的反应条件和规范的操作流程都是获得可靠结果的关键保障。






