北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
无需显微镜即可观察的人源心脏类器官及房颤模拟应用
37 人阅读发布时间:2026-01-06 12:40
由密歇根州立大学Aitor Aguirre团队主导构建了一个人类心脏-巨噬细胞组合体(hHMA)模型,首次在体外重现了胚胎期心脏驻留巨噬细胞(TRMPs)的发育整合、功能调控及其在炎症驱动的心律失常(如房颤)中的作用。
一、研究背景:为什么做?
- 心脏巨噬细胞(TRMPs)在胚胎期即定植心脏,参与心脏发育、电传导、细胞外基质(ECM)重塑、凋亡细胞清除(efferocytosis)等关键过程。
- 现有心脏类器官(hHO)缺乏TRMPs,无法模拟免疫-心脏互作。
- 房颤(AF)等心律失常与慢性炎症密切相关,NLRP3炎症小体激活是核心机制之一,但缺乏人源化模型进行机制研究和药物筛选。
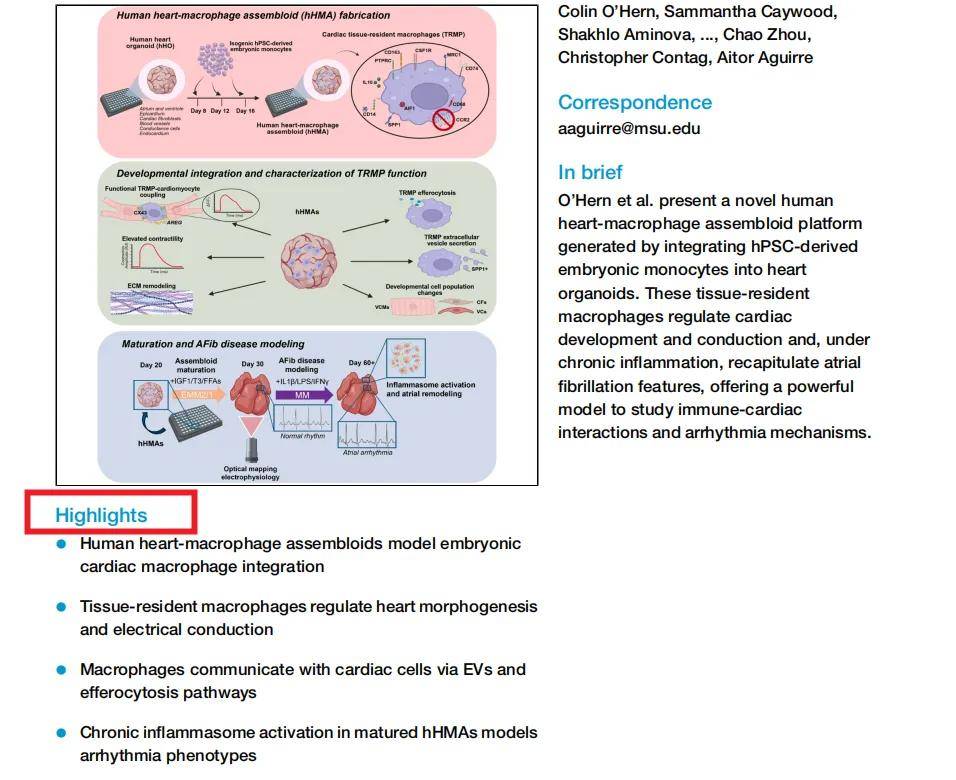
二、技术路线:怎么做?
1. 构建hHMA:心脏类器官+巨噬细胞:“先让心脏类器官(hHO)长到容易‘接待’巨噬细胞的时间窗,再把 hPSC 来源的卵黄囊样单核细胞按胚胎定植节奏分三批‘投递’进去,让它们在类器官内自然分化成组织驻留巨噬细胞(TRMPs)。”
心脏类器官(hHO):由hPSC通过自组装分化形成,包含心室/心房肌细胞(VCM/ACM)、成纤维细胞(CF)、内皮细胞(ENC)、瓣膜细胞(VC)等。
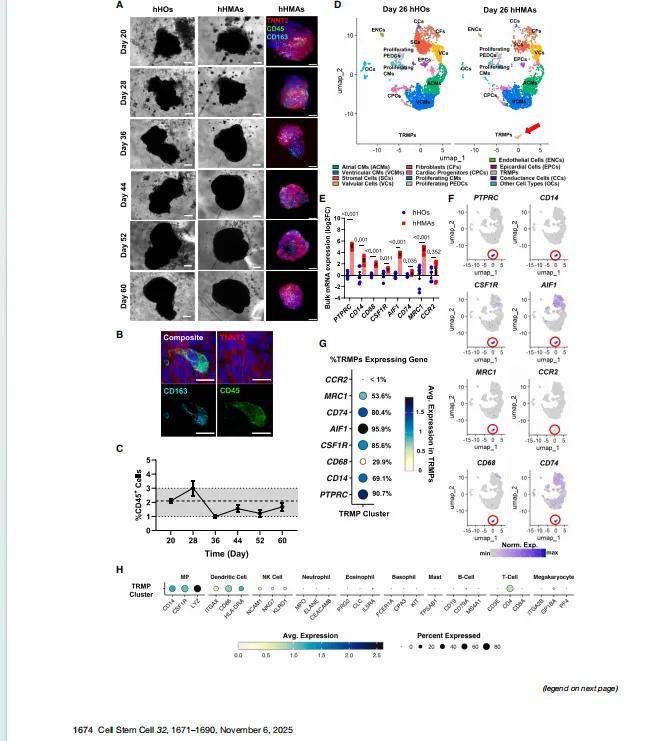
巨噬细胞来源:hPSC分化为卵黄囊样原始单核细胞(CD14+),在hHO发育第8、12、16天分批次整合,模拟胚胎期TRMPs定植。
整合效率:20,000–30,000单核细胞/次,最终TRMPs占比1–3%,与胚胎心脏一致。

巨噬细胞来源与预培养
- 细胞来源
- 与心脏类器官同基因背景的 hPSC(H9、H1、iPSC-L1 等均可)。
- 单核细胞分化(Yanagimachi 5 步法改良)
- D0:hPSC 用 Accutase 解离 → 80 ng/mL BMP4 + 2 µM Thiazovivin 诱导 EB。
- D2:EB 贴 Matrigel,续用 BMP4。
- D4:换液,加 VEGF/SCF/bFGF(造血血管过渡)。
- D6–D14:依次加 SCF、IL-3、TPO、M-CSF、FLT-3L,向髓系倾斜。
- D18 起:每 4 d 收一次非贴壁细胞 → 富集 CD14⁺单核细胞(MACS,130-050-201 Miltenyi)→ 纯度 ≥ 94%。
- 收得细胞立即使用或 4 °C 保存 ≤ 6 h,以保证存活与整合效率。
心脏类器官准备(hHO)
- 标准流程(Lewis-Israeli 2021 改良)
- D0:10 000 hPSC/孔,96 孔超低吸附圆底板,100 g 离心 3 min 促聚集。
- D1:加 CHIR99021(4 µM)+ BMP4 + Activin A,24 h。
- D2:换 RPMI/B27(-insulin)。
- D4:加 Wnt-C59(2 µM),48 h。
- D6–D8:基础 RPMI/B27(-insulin)。
- D7:短暂再 CHIR(2 µM,1 h)→ 诱导心外膜前体。
- D8 起:换 RPMI/B27(+insulin) 每 48 h 换液。
- 关键质量检查
- D8 细胞数 ≈ 2.9 × 10⁵/类器官(PicoGreen 定量)。
- 转录水平:VCAM1 高、TNNT2 阳性,无 CD45/PTPRC 信号(确保无内源免疫细胞)。
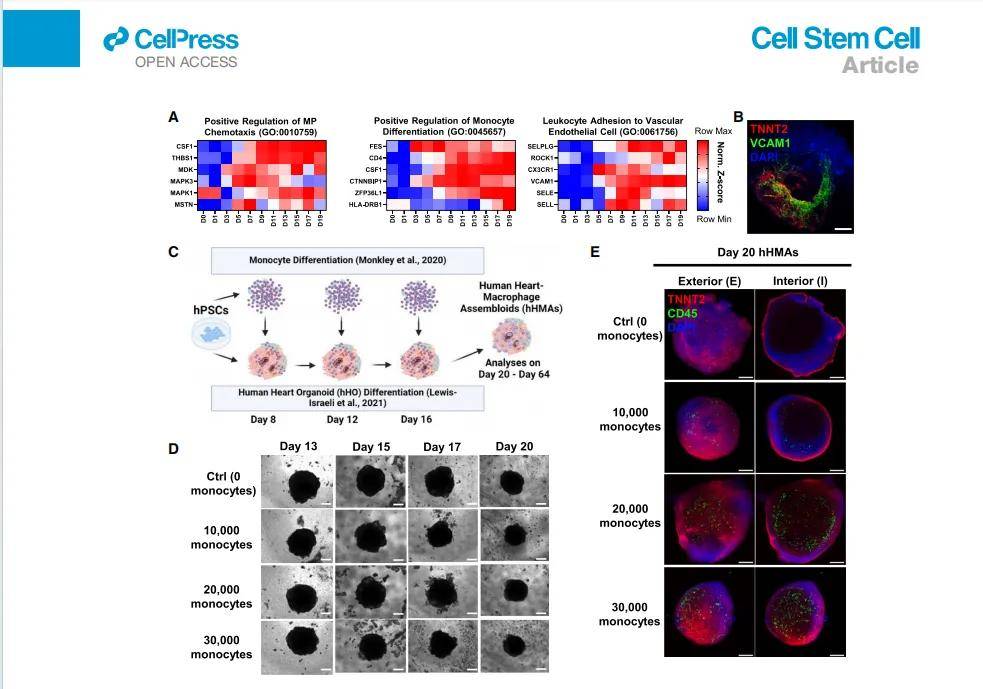
2. 模型成熟与疾病诱导
成熟期:第20–30天使用增强成熟培养基(EMM2/1),含脂肪酸、甲状腺激素、IGF-1等。
炎症刺激:第30–64天加入LPS+IL-1β+IFN-γ(低/中/高剂量),模拟慢性炎症状态。
药物干预:使用NLRP3抑制剂MCC950验证机制。
三、主要发现:得到了什么?
1. TRMPs成功整合并长期存活
形态:TRMPs均匀分布于心脏类器官内部,形成CX43间隙连接与心肌细胞电耦合。
转录组:表达TRMP标志物(CD14、CD68、CD163、CSF1R、MRC1),不表达CCR2(符合胚胎TRMP特征)。
功能:
- efferocytosis:吞噬凋亡心肌细胞,依赖MERTK通路。
- ECM重塑:调控胶原纤维(COL1A1)分布,促进心室肌细胞成熟与收缩力增强。
- 电生理:TRMPs表现出更长动作电位时程(APD),与心肌细胞同步钙瞬变。
2. TRMPs重塑心脏细胞组成
scRNA-seq显示:TRMPs促进心室肌细胞(VCM)、成纤维细胞(CF)、瓣膜细胞(VC)增殖,减少传导细胞(CC)、内皮细胞(ENC)等。
配体-受体分析:TRMPs通过SPP1-整合素轴与所有心脏细胞类型通讯,分泌SPP1+胞外囊泡(EVs),富含炎症、迁移、代谢相关蛋白。
四、机制解析:TRMPs如何参与心律失常?
1. 炎症激活TRMPs
NLRP3炎症小体激活:中高剂量炎症刺激下,TRMPs表达NLRP3、CASP1、IL-1β、IL-6、TNF-α,分泌促炎因子,形成ASC specks。
表型转化:从稳态(M0)向M1型极化,同时尝试通过IL-10进行负调控。
2. 心房肌细胞(ACM)电生理异常
心律失常表型:
- 自发性不规则节律(ectopic beats)
- 早期后除极(EADs)
- 延迟后除极(DADs)
- 自发钙升高(SCaEs)
机制:
- NLRP3激活导致钙处理异常(RYR2上调)
- ECM重塑(COL1A1、COL3A1、FN1上调)
- 细胞黏附分子VCAM1上调
药物验证:MCC950抑制NLRP3,显著减少EADs和ASC specks,部分恢复电生理稳定性。
五、疾病模型:房颤(AF)的体外重现

六、创新点
- 首次在体外构建人源化心脏-巨噬细胞组合体,重现胚胎期TRMPs整合。
- 首次将NLRP3炎症小体激活与人源心房心律失常直接关联。
- 首次实现TRMPs-心肌细胞电耦合的活体成像与功能验证。
- 首次在体外模型中重现房颤的免疫-电生理特征,并验证药物靶点。

Kirkstall Quasi Vivo®类器官串联芯片动态互作培养系统