北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
Kirkstall Quasi Vivo串联类器官共培养技术推动免疫相关疾病机制研究的核心路径(附应用案例)
362 人阅读发布时间:2025-11-11 16:28
类器官技术凭借其 “模拟体内组织结构、保留供体遗传背景、支持长期体外培养” 的独特优势,为免疫相关疾病(如癌症、炎症性肠病、感染性疾病等)的机制研究提供了 “体外微生理模型”,可从细胞互作、微环境调控、基因 - 免疫关联、动态病理过程四大维度突破传统模型局限,本文详细概述应用路径:
一、重构 “免疫细胞 - 靶器官上皮细胞” 互作模型,解析细胞间通讯机制
免疫相关疾病的核心病理特征往往是 “免疫细胞与靶器官上皮细胞的互作失调”(如 IBD 中 T 细胞攻击肠道上皮、癌症中免疫细胞与肿瘤细胞的双向调控),而类器官可通过 “共培养系统” 精准模拟这一过程,揭示细胞间通讯的分子机制。
(一)构建多样化共培养体系,覆盖不同免疫细胞类型
根据疾病类型选择靶器官类器官与对应免疫细胞进行共培养,还原体内免疫微环境的细胞组成:
- 肿瘤免疫研究:采用 “肿瘤类器官(tumouroids)+ 肿瘤浸润免疫细胞” 共培养,模拟肿瘤微环境(TME)中的细胞互作。例如,将结直肠癌患者肿瘤类器官与自体肿瘤浸润淋巴细胞(TILs)、巨噬细胞共培养,可观察到 TILs 在类器官周围的浸润模式 —— 未处理组 TILs 因肿瘤细胞表达 PD-L1 而处于 “耗竭状态”(分泌 IFN-γ 减少、表达 PD-1 增加),而加入抗 PD-L1 抗体后,TILs 浸润能力增强且肿瘤细胞杀伤效率提升,证实 “PD-L1/PD-1 通路” 是肿瘤免疫逃逸的关键机制;同时发现肿瘤类器官分泌的 IL-10 可诱导巨噬细胞向 M2 型极化,进一步抑制 T 细胞功能,为 “抗 PD-L1 + 抗 IL-10” 联合治疗提供机制依据。
- 炎症性疾病研究:以 IBD 为例,构建 “肠道类器官 + 外周血免疫细胞 / 肠道固有层免疫细胞” 共培养系统。例如,将健康人结肠类器官与 IBD 患者的 CD4+T 细胞共培养,发现患者 T 细胞可通过分泌 IFN-γ 诱导类器官上皮细胞凋亡(表现为类器官结构瓦解、紧密连接蛋白 occludin 表达下降),而加入 IFN-γ 中和抗体或 JAK 抑制剂可阻断这一过程,证实 “T 细胞来源的 IFN-γ 是肠道上皮损伤的核心介质”;进一步通过单细胞测序分析,发现患者 T 细胞中 “Th17 细胞亚群比例升高”,且其分泌的 IL-17 可协同 IFN-γ 增强上皮损伤效应,揭示 IBD 中 “Th17-Th1 细胞协同致病” 的新机制。
- 感染性疾病研究:利用 “呼吸道 / 肠道类器官 + 固有免疫细胞” 共培养,解析病原体感染引发的免疫应答。例如,将人肺肺泡类器官与肺泡巨噬细胞共培养,感染新冠病毒(SARS-CoV-2)后,观察到巨噬细胞迅速激活并分泌 TNF-α、IL-6 等促炎细胞因子,同时类器官上皮细胞表达 ACE2(病毒受体)增加,进一步促进病毒复制;而加入 IL-6 受体拮抗剂(托珠单抗)可抑制巨噬细胞过度激活,减少上皮细胞损伤,为新冠炎症风暴的机制研究提供体外证据。
(二)借助技术手段精准调控互作过程,定位关键分子
- 时空分辨率观察:结合活细胞成像技术(如共聚焦显微镜、光片显微镜),实时追踪免疫细胞与类器官的动态互作。例如,在 “肠道类器官 + 中性粒细胞” 共培养中,通过荧光标记中性粒细胞的整合素(LFA-1)和类器官上皮细胞的 ICAM-1(配体),观察到炎症刺激下中性粒细胞通过 “LFA-1/ICAM-1 结合” 黏附于类器官表面,随后穿越上皮屏障进入类器官内部,这一过程与体内肠道炎症中的中性粒细胞浸润模式一致,且阻断 LFA-1 可显著减少浸润,证实该通路是中性粒细胞迁移的关键。
- 分子干预验证:通过基因编辑(CRISPR/Cas9)或药物抑制,特异性阻断候选分子,验证其在细胞互作中的作用。例如,在 “肝癌类器官 + NK 细胞” 共培养中,发现肝癌类器官高表达 MICA/B(NK 细胞激活受体 NKG2D 的配体),NK 细胞通过 NKG2D 识别 MICA/B 后激活并杀伤肿瘤细胞;而敲除类器官中的 MICA/B 基因或阻断 NKG2D,可显著降低 NK 细胞的杀伤效率,证实 “NKG2D-MICA/B 通路” 是肝癌免疫监视的核心分子轴。
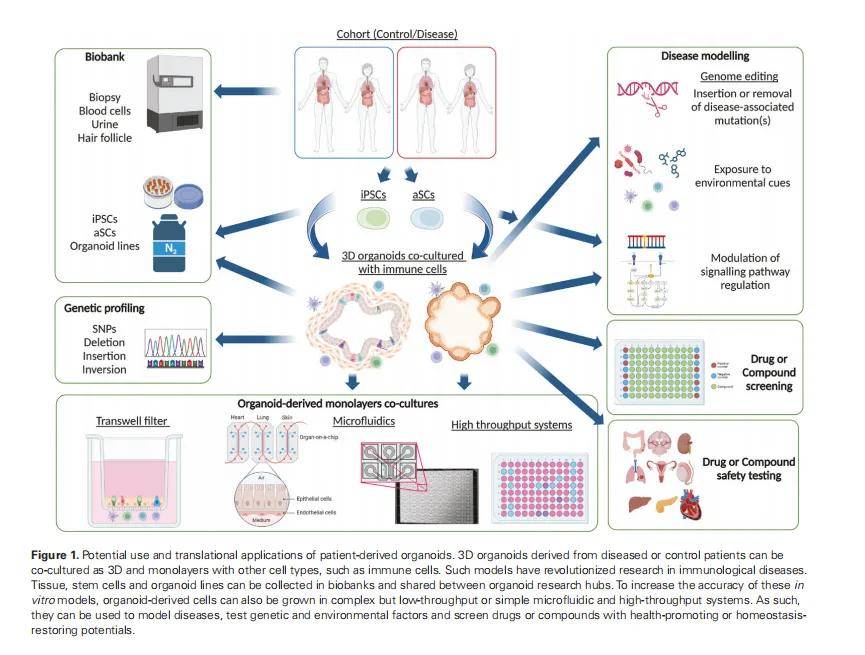
二、模拟免疫微环境的 “多因素调控”,解析微环境失衡的致病机制
免疫相关疾病的发生不仅依赖 “细胞 - 细胞互作”,还与微环境中的细胞外基质(ECM)、细胞因子梯度、机械信号(如剪切力)、菌群代谢物等多因素相关,类器官可通过 “定制化微环境构建”,还原这些因素对免疫应答的调控作用。
(一)重构细胞外基质(ECM)的免疫调控作用
ECM 不仅是组织结构的 “支架”,还通过与免疫细胞表面受体(如整合素、TGF-β 受体)结合调控免疫细胞功能。类器官培养中可通过调整 ECM 成分(如胶原蛋白、Matrigel、纤维连接蛋白的比例),模拟健康与疾病状态下的 ECM 差异:
- 案例:在乳腺癌研究中,健康乳腺类器官培养于 “低刚度 ECM”(模拟正常乳腺组织),而乳腺癌类器官培养于 “高刚度 ECM”(模拟肿瘤纤维化微环境)。将两者与巨噬细胞共培养发现,高刚度 ECM 可通过激活巨噬细胞表面的整合素 β1,诱导其向 M2 型极化(分泌 IL-10、TGF-β),进而抑制 T 细胞的抗肿瘤活性;而降低 ECM 刚度或敲除整合素 β1,可恢复巨噬细胞的 M1 型极化(分泌 TNF-α、IL-12),增强 T 细胞杀伤,揭示 “ECM 刚度通过整合素通路调控巨噬细胞极化” 是肿瘤免疫抑制的重要机制。
(二)模拟细胞因子梯度与机械信号的免疫调控
- 细胞因子梯度:利用Kirkstall Quasi Vivo微流控芯片技术,在类器官共培养系统中构建 “梯度化细胞因子环境”(如模拟炎症部位从 “炎症中心” 到 “正常组织” 的细胞因子浓度递减)。例如,在肠道类器官芯片中,通过微流控通道形成 “IL-22 梯度”(肠道炎症中上皮修复区的 IL-22 浓度高于损伤区),发现高浓度 IL-22 可促进类器官肠干细胞增殖(激活 STAT3 通路),而低浓度 IL-22 则诱导干细胞分化为杯状细胞(分泌黏液),证实 “IL-22 梯度通过调控干细胞命运参与肠道炎症修复”;同时发现梯度环境下,免疫细胞(如 ILC3)更易向高浓度 IL-22 区域迁移,揭示细胞因子梯度对免疫细胞归巢的引导作用。
- 机械信号:在器官芯片中引入 “流体剪切力”(模拟血管血流、肠道蠕动)或 “细胞拉伸”(模拟肺部呼吸运动),研究机械信号对免疫应答的影响。例如,在肺类器官芯片中,模拟正常呼吸的 “周期性拉伸”(5%-10% 拉伸幅度,12 次 / 分钟),发现拉伸可促进类器官上皮细胞表达 TLR4( Toll 样受体 4,识别细菌脂多糖 LPS),当加入 LPS 后,拉伸组的上皮细胞与巨噬细胞共培养体系中,促炎细胞因子(IL-1β、IL-8)分泌显著高于静态组,证实 “呼吸运动的机械信号可增强肺部对细菌感染的免疫应答”;而在慢性阻塞性肺疾病(COPD)模型中,过度拉伸(20% 幅度)则会导致上皮细胞 TLR4 表达下调,免疫应答减弱,解释了 COPD 患者易反复感染的机制。
(三)整合肠道菌群 - 免疫 - 上皮互作,解析菌群相关免疫疾病机制
肠道菌群代谢物(如短链脂肪酸 SCFAs、色氨酸代谢物)是调控肠道免疫稳态的关键因素,类器官可通过 “类器官 - 菌群 / 菌群代谢物 - 免疫细胞” 共培养,解析菌群对免疫疾病的影响:
- 案例:在 IBD 研究中,将健康人肠道类器官与自体 PBMCs 共培养,同时加入健康人肠道菌群的 SCFAs(如丁酸盐)或 IBD 患者菌群的代谢物(如吲哚乙酸)。发现丁酸盐可通过激活类器官上皮细胞的 GPR43 受体,促进其分泌 IL-18(增强肠道屏障功能),同时抑制 PBMCs 中 Th17 细胞分化;而 IBD 患者菌群的吲哚乙酸则会抑制上皮细胞 IL-18 分泌,促进 Th17 细胞增殖,导致类器官上皮损伤。进一步通过宏基因组测序发现,IBD 患者菌群中 “丁酸盐产生菌(如 Faecalibacterium prausnitzii)减少”,而 “吲哚乙酸产生菌增加”,证实 “菌群代谢物失衡通过调控上皮 - 免疫互作参与 IBD 发病”。
三、结合基因编辑与患者来源类器官,解析 “基因 - 免疫” 关联机制
免疫相关疾病多具有遗传易感性(如 IBD 的 NOD2 基因、类风湿关节炎的 HLA-DRB1 基因),类器官可通过 “基因编辑 + 患者来源类器官(PDOs)” 的组合,精准解析 “遗传变异如何通过调控免疫应答引发疾病”。
(一)基因编辑类器官:验证单个基因的免疫调控功能
通过 CRISPR/Cas9 在健康人干细胞类器官中 “敲入致病突变” 或 “敲除候选基因”,单独评估基因变异对免疫应答的影响:
- 案例 1(IBD 的 NOD2 基因):在健康人肠道类器官中敲入 NOD2 基因的致病突变(如 R702W),与野生型类器官对比发现,突变类器官对细菌细胞壁成分(MDP,NOD2 配体)的应答显著异常 —— 野生型类器官会分泌 IL-22(促进屏障修复),而突变类器官则分泌大量 IL-1β(促炎),且与 PBMCs 共培养时,突变类器官更易诱导 T 细胞向 Th1 型分化(分泌 IFN-γ),证实 “NOD2 突变通过增强促炎应答、削弱修复应答参与 IBD 发病”。
- 案例 2(癌症的 HLA 基因):在肝癌类器官中敲除 HLA-A 基因(负责呈递肿瘤抗原给 CD8+T 细胞),发现敲除后的类器官无法被肿瘤抗原特异性 CD8+T 细胞识别,T 细胞杀伤效率下降 90% 以上;而回补 HLA-A 基因则可恢复 T 细胞杀伤,证实 “HLA-A 表达缺失是肝癌免疫逃逸的重要遗传机制”。
(二)患者来源类器官(PDOs):解析遗传异质性对免疫机制的影响
不同患者的遗传背景差异(如单核苷酸多态性 SNP、拷贝数变异 CNV)会导致免疫应答的异质性,PDOs 因保留患者遗传特征,可用于解析这种异质性的机制:
- 案例(肺癌免疫治疗响应差异):收集 20 例非小细胞肺癌(NSCLC)患者的 PDOs,均携带 EGFR 突变,但 TMB(肿瘤突变负荷)不同(高 TMB 组 10 例,低 TMB 组 10 例)。将 PDOs 与自体 PBMCs 共培养,加入抗 PD-1 抗体后发现,高 TMB 组 PDOs 的 T 细胞浸润率(CD8+T 细胞比例)显著高于低 TMB 组,且高 TMB 组 PDOs 分泌的肿瘤抗原肽更多,可更有效激活 T 细胞;进一步通过全外显子测序发现,高 TMB 组患者的 “抗原呈递相关基因(如 B2M、TAP1)表达正常”,而低 TMB 组患者中 3 例存在 B2M 基因突变(导致 HLA 分子无法表达),证实 “TMB 水平 + 抗原呈递基因状态共同决定肺癌患者对 PD-1 抑制剂的响应”,为免疫治疗疗效预测提供机制依据。
四、动态模拟免疫疾病的 “病理进程”,解析疾病发展的阶段特异性机制
传统细胞模型多为 “静态快照”,无法模拟免疫疾病从 “稳态 - 炎症启动 - 慢性进展 - 修复 / 恶化” 的动态过程,而类器官可通过 “长期培养 + 分步诱导”,还原疾病的动态病理,解析不同阶段的关键机制。
(一)模拟炎症性疾病的 “急性发作 - 慢性化” 过程
以 IBD 为例,通过 “分步诱导” 构建动态模型:
- 急性炎症阶段:向健康人肠道类器官 + PBMCs 共培养体系中加入 TNF-α(模拟急性炎症触发),观察到 1-3 天内类器官上皮细胞凋亡增加、屏障功能下降,同时 PBMCs 中 Th1/Th17 细胞比例升高,这与 IBD 急性发作期的病理特征一致;通过转录组分析发现,急性阶段 “NF-κB 通路显著激活”,而抑制 NF-κB 可缓解上皮损伤。
- 慢性化阶段:持续低剂量 TNF-α 刺激(2-4 周),模拟慢性炎症,发现类器官逐渐出现 “纤维化样改变”(胶原沉积增加、成纤维细胞活化),同时 PBMCs 中出现 “耗竭型 T 细胞”(表达 PD-1、TIM-3),其分泌 IFN-γ 的能力下降;进一步研究发现,慢性阶段类器官分泌的 TGF-β 增加,可诱导 Treg 细胞分化,但这些 Treg 细胞的免疫抑制功能减弱(因表达 IL-17),形成 “致病性 Treg 细胞”,加剧炎症慢性化,揭示 IBD 从急性转为慢性的关键机制 ——“Treg 细胞功能异常 + 纤维化”。
(二)模拟肿瘤免疫的 “免疫监视 - 免疫逃逸 - 免疫治疗响应” 过程
在肿瘤类器官中动态模拟肿瘤免疫的发展阶段:
- 免疫监视阶段:将早期肺癌类器官(低突变负荷)与自体 PBMCs 共培养,发现 NK 细胞和 CD8+T 细胞可识别并杀伤肿瘤细胞,类器官生长受抑,证实 “免疫监视可抑制早期肿瘤进展”;此时肿瘤细胞表达 NKG2D 配体(MICA/B),为 NK 细胞识别提供信号。
- 免疫逃逸阶段:持续培养 4-6 周,发现部分肿瘤类器官出现 “免疫逃逸表型”——MICA/B 表达下调,同时分泌 PD-L1 和 IL-10,诱导 T 细胞耗竭;通过基因测序发现,这些类器官发生 “JAK2 基因突变”,导致 STAT3 通路持续激活,进而调控 PD-L1 和 IL-10 表达,揭示 “JAK2 突变通过激活 STAT3 通路介导肿瘤免疫逃逸” 的新机制。
- 免疫治疗响应阶段:向逃逸阶段的类器官中加入抗 PD-1 抗体 + JAK 抑制剂,发现联合治疗可恢复 T 细胞杀伤功能,类器官生长受抑,而单独使用抗 PD-1 抗体则效果不佳,证实 “JAK2 突变是 PD-1 抑制剂耐药的原因之一,联合 JAK 抑制剂可逆转耐药”。
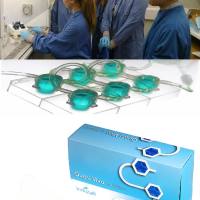
Kirkstall Quasi Vivo类器官与串联多器官芯片
总 结 与 展 望
Kirkstall Quasi Vivo® 串联多细胞 / 器官动态仿生共培养系统,凭借微流控技术支撑的 “动态生理模拟” 与 “多器官串联” 核心优势,可针对性突破当前类器官研究在免疫相关疾病机制探索中的瓶颈,为领域带来多维度革新。
在细胞互作机制解析层面,该系统能精准复现免疫细胞与靶器官上皮细胞互作的 “动态时空场景”。例如研究 IBD 时,可通过微流控通道构建肠道类器官与 T 细胞、巨噬细胞的串联共培养,模拟肠道蠕动的机械剪切力与细胞因子梯度,实时观察 T 细胞从 “血管募集→上皮黏附→屏障浸润” 的完整过程,同时监测不同区域细胞因子(如 IFN-γ、IL-22)的动态变化,破解传统静态共培养无法捕捉的 “免疫细胞迁移 - 功能调控” 关联机制。
针对免疫微环境多因素调控研究,Kirkstall Quasi Vivo® 串联多细胞 / 器官动态仿生共培养系统其多器官串联设计可实现 “肠道 - 肝脏 - 免疫细胞” 等跨器官互作模拟。以肠道菌群相关免疫疾病为例,系统能将肠道类器官(接触菌群代谢物)、肝脏类器官(代谢转化)与免疫细胞串联,动态追踪菌群代谢物(如丁酸盐)经肠道吸收、肝脏转化后,对免疫细胞分化的影响,揭示 “菌群 - 器官 - 免疫” 轴的上下游调控通路,弥补单一器官类器官无法模拟的系统级免疫调控机制。
在基因 - 免疫关联验证中,该系统可结合基因编辑类器官,实现 “遗传变异 - 动态免疫应答” 的高通量分析。例如对携带不同 NOD2 突变的肠道类器官,通过系统的动态培养与实时检测,量化不同突变型类器官在炎症刺激下的免疫细胞招募效率、细胞因子分泌规律差异,快速验证遗传变异对免疫应答的影响权重,加速免疫相关疾病遗传机制的筛选与确认。
未来,随着该系统与单细胞测序、活细胞成像等技术的深度融合,有望构建 “患者特异性动态免疫疾病模型”,为解析个体化免疫疾病机制、开发精准靶向疗法提供更贴近临床的研究工具,推动免疫相关疾病机制研究从 “静态模拟” 迈向 “动态精准还原”。
Kirkstall Quasi Vivo® 串联多细胞 / 器官动态仿生共培养系统——类器官技术通过 “重构细胞互作、模拟微环境、解析基因 - 免疫关联、动态还原病理进程” 四大核心路径,为免疫相关疾病机制研究提供了 “更贴近体内、可精准调控、可长期观察” 的体外模型。其优势在于:既能还原疾病的复杂性(如多细胞、多因素互作),又能通过技术手段(共培养、基因编辑、微流控)实现 “精准拆解”,定位关键细胞、分子与通路,从而突破传统模型的局限,推动免疫疾病机制研究从 “宏观现象” 深入到 “分子调控”,为疾病诊断标志物发现、靶向药物开发提供核心理论依据。

Kirkstall Quasi Vivo®类器官串联3D动态灌流共培养系统