北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
Kirkstall 串联多细胞共培养系统揭示TNBC缺氧外泌体如何构建免疫保护屏障
130 人阅读发布时间:2025-10-23 11:42
北 京 基 尔 比 生物科技公司主营产品:
Kilby 多通道3D细胞培养系统,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物等地面重力环境模拟装置【可以定制】,
Kilby Bio类器官摆动式精密灌注摇床,
Kirkstall Quasi Vivo 类器官3D串联芯片灌注培养系统

在肿瘤微环境(TME)研究领域,传统体外模型常受限于无法模拟体内动态细胞互作、难以单独分析各细胞类型响应等问题,而三阴性乳腺癌(TNBC)作为高转移性、预后差的恶性肿瘤,其缺氧微环境中分泌的外泌体(EVh)对 TME 的调控机制更是研究难点。
传统 2D 细胞培养无法模拟体内细胞间的动态信号交流,3D 共培养虽提升复杂性,却难以单独追踪不同细胞类型的响应 —— 这一行业痛点长期制约肿瘤微环境研究的精准性。
Kirkstall 串联多细胞培养系统,凭借其独特的多室循环设计,为突破上述研究瓶颈提供了关键工具。

2025年7月,来自巴西圣卡洛斯联邦大学(Universidade Federal de São Carlos, UFSCar) 与巴西巴雷图斯癌症医院(Barretos Cancer Hospital)的Heloisa Sobreiro Selistre-de-Araujo等学者以Kirkstall 串联多细胞培养系统“多室分隔 + 循环流动” 的双重创新设计 ,为体外还原 TME 生理状态提供了全新的解决方案,其核心优势完美匹配学术研究对 “精准性、可追溯性、生理性” 的需求。
原文作者研究以 “TNBC 缺氧外泌体(EVh)如何构建保护性肿瘤微环境” 为核心科学问题,全程以 Kirkstall 串联多细胞培养系统为关键研究平台,设计了 “从单细胞响应到多细胞互作” 的递进式研究路径,充分体现了该系统对复杂科学问题的支撑能力:
一、研究思路
- (一)先析单细胞效应,明确 EVh 的基础调控作用:
- 通过传统单培养对比,初步验证 EVh 对单一细胞类型的影响 —— 如诱导单核细胞(THP-1)分化为 M2 型巨噬细胞(抗炎症、促肿瘤表型)、促进内皮细胞明胶侵袭能力等,为后续多细胞互作研究奠定基础。
- (二)再用 Kirkstall 串联多细胞培养系统循环共培养,解析 EVh 的系统性调控网络:
- 将 TME 四大核心细胞类型(TNBC 细胞、内皮细胞、成纤维细胞、单核细胞)分别接种于 Kirkstall Quasi Vivo各培养室,启动循环体系并加入 EVh 处理,通过以下维度揭示 EVh 的保护性机制:
- 追踪巨噬细胞在循环体系中的分布(如 THP-1 在 TNBC 细胞室的聚集情况),分析 EVh 对巨噬细胞吞噬功能的抑制作用;
- 检测各细胞室中细胞形态、侵袭能力变化(如 TNBC 细胞的明胶降解面积);
- 收集循环培养液,分析细胞因子(IL-6、IL-1β)、基质金属蛋白酶(MMP-2)的分泌水平,构建 EVh 调控 TME 的 “细胞 - 分子” 关联网络。
- (三)结合传统共培养(直接 / 间接),验证 Kirkstall 串联多细胞培养系统数据的可靠性:
- 将 Kirkstall 串联多细胞培养系统的结果与 Boyden 小室间接共培养、同孔直接共培养的数据对比,发现三者均证实 “EVh 促进促肿瘤表型”,但 Kirkstall Quasi Vivo系统能额外捕捉到 “EVh 通过循环体系增强成纤维细胞 II 型 / III 型胶原合成” 这一传统模型未发现的效应 —— 进一步凸显该系统在 “揭示系统性调控机制” 上的独特价值。

- 二、关键研究步骤
- 2.1 EVh 制备与表征:为后续实验奠定高质量基础:
- 从缺氧培养(1% O₂)的 MDA-MB-231 细胞中,通过差速超速离心法提取 EVh,依据 MISEV2023 指南,用 Kirkstall Quasi Vivo系统兼容的检测手段(纳米颗粒追踪分析 NTA、透射电镜 TEM、Western blot)验证 EVh 的纯度与特性 ——NTA 显示 EVh 粒径集中在 130.2±78.7nm,Western blot 检测到 CD63、ALIX 等外泌体标志物,未检测到钙连蛋白(细胞污染标志物),确保实验材料的可靠性。
- 2.2 串联多细胞培养系统实验设计:标准化操作降低变量干扰:
- 细胞接种:各培养室分别接种 5×10⁴ cells/mL 的 MDA-MB-231、HUVEC,1×10⁴ cells/mL 的 HDFa,THP-1 单核细胞预染后加入循环 reservoir;
- 处理分组:设置 EVh 处理组(10⁹ particles/mL)与 PBS 对照组,37℃、5% CO₂条件下循环培养 24h;
- 数据采集:培养结束后,单独收集各室细胞进行免疫荧光染色(如胶原 II/III、β- 连环蛋白),循环培养液用于 ELISA 细胞因子检测与明胶酶谱分析 —— 整个流程中,Kirkstall Quasi Vivo 系统的精准流速控制与稳定温湿度环境,确保了两组实验数据的可比性,降低了因操作差异导致的误差。
三、研究结果
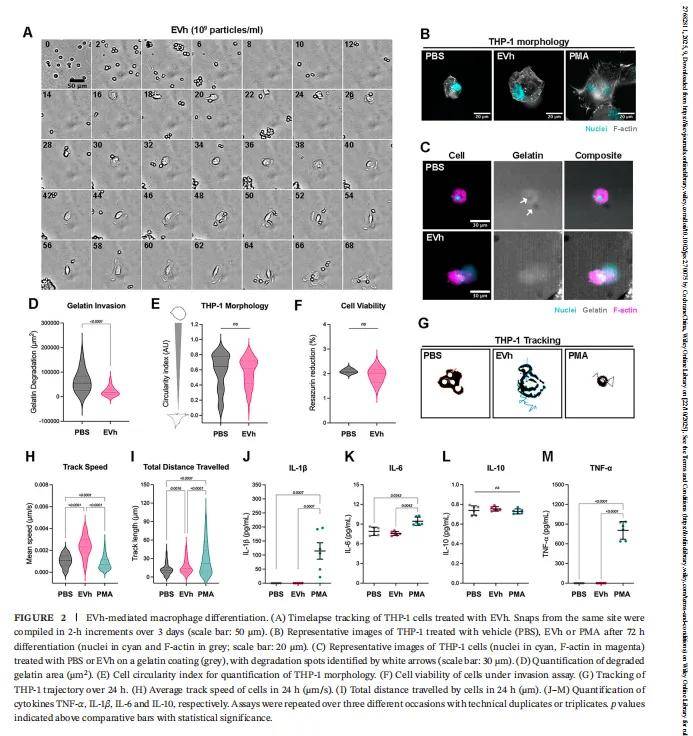
- 3.1 EVh 诱导 M2 型巨噬细胞,抑制肿瘤细胞吞噬清除
- 通过系统追踪 THP-1 细胞的分化与分布,发现 EVh 处理后,单核细胞分化为 M2 型巨噬细胞(IL-10 表达维持、IL-6 降低),且在 TNBC 细胞室的聚集减少;同时,TNBC 细胞与内皮细胞的 “吞噬死亡”(Phagoptosis)率显著降低(完整细胞比例提升 30% 以上)。这一结果首次在动态循环模型中证实:EVh 通过调控巨噬细胞表型,为肿瘤细胞构建 “免疫保护屏障”。
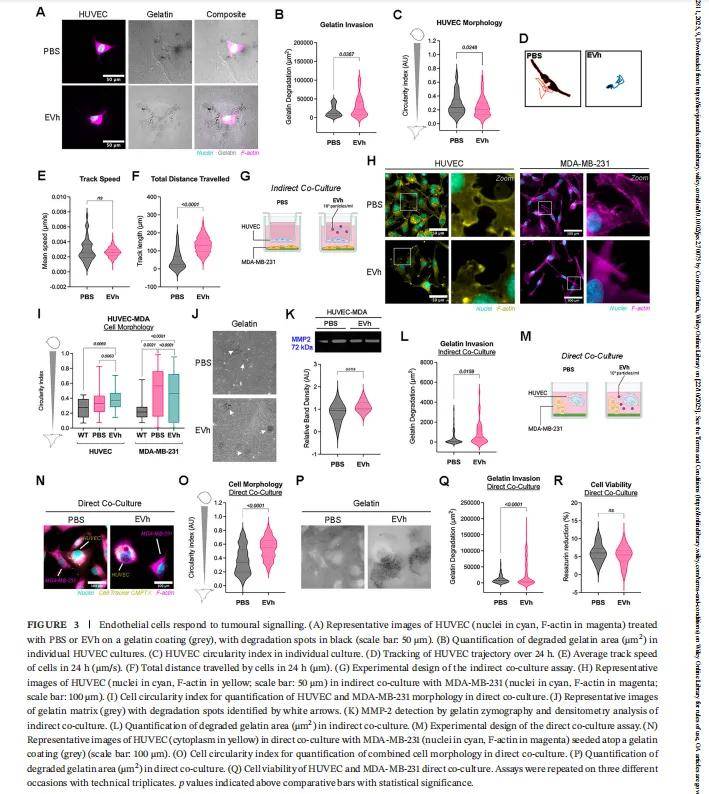
- 3.2 EVh 激活内皮细胞促血管生成表型,助力肿瘤侵袭
- 单独分析 HUVEC 细胞响应显示,EVh 处理后内皮细胞中 β- 连环蛋白(细胞间黏附关键分子)、VEGFR2(血管生成受体)的表达分别提升 2.1 倍、1.8 倍,同时内皮细胞的明胶侵袭面积增加 40%—— 表明 EVh 通过增强内皮细胞的黏附与侵袭能力,为肿瘤细胞穿透血管、发生转移创造条件。这一发现为靶向 EVh - 内皮细胞互作的抗转移药物筛选提供了靶点。
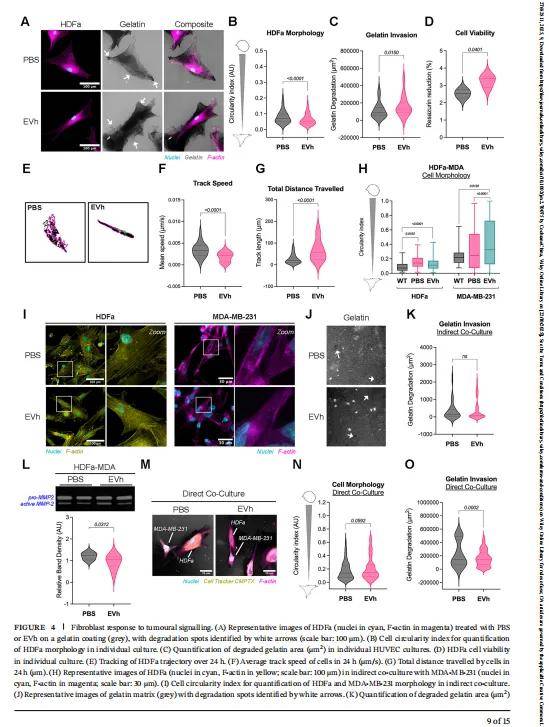
- 3.3 EVh 促进成纤维细胞胶原合成,重塑 ECM 支撑肿瘤生长
- 对Kirkstall Quasi Vivo 系统的成纤维细胞室分析显示,EVh 处理后 II 型、III 型胶原的表达分别提升 2.3 倍、1.9 倍,且胶原主要分布在细胞周围 —— 这种 ECM 重塑会增加肿瘤微环境的硬度,为肿瘤细胞的增殖与迁移提供物理支撑,同时可能增强肿瘤对放疗的抵抗性。这一结果为 “联合靶向 EVh 与胶原重塑的综合治疗策略” 提供了实验依据。
- 3.4 循环体系验证 EVh 的系统性调控作用:
- 与传统静态培养相比,Kirkstall Quasi Vivo系统的循环环境更真实地模拟了体内 EVh 的扩散效应 —— 实验发现,EVh 在循环体系中可同时调控三种以上细胞类型,且各细胞的响应存在协同效应(如内皮细胞的促血管生成表型与成纤维细胞的 ECM 重塑共同促进肿瘤侵袭)。这一结果凸显了 “动态循环模型” 在研究 TME 系统性调控中的不可替代性,也印证了 Kirkstall Quasi Vivo系统对 “复杂生物学过程” 的还原能力。
Kirkstall Quasi Vivo串联多细胞/器官灌注培养系统以其创新性设计,为肿瘤微环境研究、药物筛选、精准医疗等领域提供了 “从实验室到临床” 的全链条工具价值:
- 对科研机构:提升研究精准性与创新性:系统解决了传统模型 “无法模拟动态互作、难以单独追踪细胞响应” 的痛点,助力研究人员发现传统模型遗漏的关键机制(如 EVh 对成纤维细胞胶原合成的调控),为发表高水平学术成果提供技术支撑。
- 对制药企业:加速抗肿瘤药物筛选与验证:可基于系统构建 “个性化 TME 模型”(如患者来源的肿瘤细胞与基质细胞共培养),用于评估药物对 TME 各细胞类型的影响,预测药物在体内的疗效与毒性,缩短药物研发周期。
- 对临床转化:推动精准医疗落地:通过模拟患者 TME 的动态特征,可用于分析不同患者肿瘤外泌体的调控差异,为 “基于外泌体的预后标志物筛选”“个体化治疗方案制定” 提供实验平台。

Kirkstall Quasi Vivo®多细胞器官串联式灌流培养系统