北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
用于研究神经细胞相互作用的3D共培养模型
181 人阅读发布时间:2025-09-24 10:32
北 京 基 尔 比 生物科技公司主营产品:
Kilby 多通道3D细胞培养系统,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物等地面重力环境模拟装置【可以定制】,
Kilby Bio类器官摆动式精密灌注摇床,
Kirkstall Quasi Vivo 类器官3D串联芯片灌流共培养系统

请联系我们,了解更多产品详情!
一、引言
1. 中枢神经系统(CNS)特性
CNS 是人体结构和功能最复杂的系统,以神经组织为基本组织,主要由神经元和神经胶质细胞构成。这些细胞以极其精密且高度复杂的方式结合,形成具有三维(3D)结构的系统。通过神经元或其他细胞间复杂有序的连接,形成各类神经传导通路和神经回路,调控器官系统功能活动,维持机体与外界环境的统一。
2. 传统培养系统的局限性
传统培养系统仅包含单一细胞类型,且脱离了体内自然复杂的生长环境,细胞特性趋于简单,原始生物学特性逐渐丧失,导致其生理或代谢特性与体内天然菌株或细胞完全不同,无法探究多细胞系统间的相互关系。
而细胞生存的微环境中,细胞间需要信息交换和物质代谢,细胞间信号传导对细胞生物学行为至关重要,研究不同类型细胞间的通讯机制对理解某些疾病的病理机制意义重大。
3. 共培养系统的优势与用途
细胞共培养技术能在很大程度上模拟体内环境,便于观察细胞与细胞、细胞与培养环境间的相互作用,通过检测不同细胞因子间的关系,探究药物作用机制及潜在靶点。
共培养系统的出现,使在体外阐明神经细胞间的相互作用、重现复杂神经回路成为可能,可用于研究细胞分化、细胞功能与活力、细胞增殖与迁移、CNS 发育以及代谢机制等。相较于动物模型,体外共培养模型能更便捷、精准地揭示细胞、组织或器官间相互作用的深层机制。
二、2D 共培养模型在神经细胞 - 细胞相互作用研究中的应用
2D 共培养模型可观察细胞间或细胞与其周围微环境的相互作用,主要分为直接接触共培养和间接接触共培养两类。
1. 直接接触共培养模型
- 细胞混合共培养
将两种或多种细胞按一定比例混合,在特定条件下接种到同一界面。其最大优势是能清晰展示神经胶质细胞与神经元细胞间的相互作用,例如神经干细胞(NSCs)与小胶质细胞共培养时,小胶质细胞分泌的因子可促进人 NSCs 向多巴胺能神经元分化;与星形胶质细胞共培养时,星形胶质细胞能促进 NSCs 向神经元分化。此外,还可向共培养系统中添加免疫细胞因子等调控因子研究细胞间相互作用,如向包含原代小鼠皮质神经元和神经胶质细胞的混合培养系统中添加白细胞介素 33(IL-33),发现 IL-33 可诱导神经胶质细胞释放炎症介质,从而降低共培养系统中神经元的死亡率。
- 饲养层细胞共培养
将细胞接种在特定细胞(如颗粒细胞、成纤维细胞、输卵管上皮细胞等)形成的单层上,饲养层细胞经有丝分裂抑制剂(常用丝裂霉素)处理后,虽失去分裂能力,但仍保留分泌生长因子的能力。某些细胞的存活和增殖依赖饲养层细胞分泌的生长因子,在细胞培养过程中,饲养层可促进细胞生长增殖,抑制细胞分化,这在胚胎干细胞(ESCs)培养中尤为明显,且该系统中多种细胞类型间更易形成细胞连接。在此基础上,还建立了由神经元、星形胶质细胞和小胶质细胞组成的三培养系统,能更真实地模拟体内神经炎症反应,助力理解细胞间通讯对神经炎症的影响。
2. 间接接触共培养模型
细胞间的相互作用或调控不仅依赖直接接触,更多通过微环境中释放的化学信号实现,因此需要避免细胞直接接触的共培养系统。间接接触共培养是将两种或多种不同类型细胞培养,使细胞通过培养基中的化学因子相互作用,而无物理直接接触,主要实现方式有以下三种:
- 条件培养基
收集含有细胞分泌的多种生长因子或刺激物的细胞培养上清液,用于研究这些因子对细胞生长或分化的影响。例如,收集经不同时长缺氧处理的神经元的条件培养基,可诱导小胶质细胞呈现不同表型。
- 盖玻片上的饲养细胞
将分泌特定因子的细胞接种在盖玻片上,避免与培养皿中接种的细胞直接接触。该方法适用于研究特定条件下细胞的旁分泌作用,且可进行定量分析。
- Transwell 培养系统
由于具有可重复性、标准化和操作简便的特点,Transwell 共培养系统在间接细胞间相互作用研究中被广泛认可和应用。例如,通过 Transwell 方法共培养施万细胞(SCs)和神经元,发现 SCs 分泌的 β- 细胞素可影响神经元行为,增加突触长度,进而促进神经再生。
3. 2D 共培养模型的局限性
尽管科研人员尝试在 2D 条件下重现体内微环境,但体内细胞处于具有特定空间结构的 3D 环境中,该环境会影响细胞行为,因此 2D 共培养条件下获得的数据可能与体内结果存在显著差异。2D 培养中细胞的生长模式、形态和功能与体内生理条件下明显不同,细胞呈扁平生长状态,分裂异常,还可能丧失分化表型,这种异常的细胞形态会影响细胞增殖、分化、凋亡、基因和蛋白质表达等多种细胞过程。
三、3D 共培养模型在神经细胞相互作用研究中的应用
3D 共培养系统因能模拟体内环境,为研究复杂神经细胞相互作用(如各类神经细胞间的协同作用和保护作用)提供了可靠方法。3D 共培养技术可展示细胞分化、蛋白质表达等细胞活动和细胞间反应,实现真实的细胞生物学功能研究。本文将 3D 共培养系统分为基于细胞的 3D 共培养系统、基于组织切片的 3D 共培养系统和基于类器官的 3D 共培养系统。
1. 基于细胞的 3D 共培养系统
- 构建原理
为构建模拟体内结构的 3D 架构,可将神经细胞包埋在凝胶化后具有特定 3D 结构的水凝胶中。天然水凝胶和合成水凝胶均已用于 3D 系统的生物工程构建,但这些生物材料会对细胞行为(如细胞活力、增殖、迁移或分化)产生额外影响,这可能与水凝胶的生物力学特性以及材料 - 细胞相互作用有关。
- 常用水凝胶类型及应用
Matrigel
作为一种天然水凝胶,Matrigel 对维持细胞生长、促进干细胞向神经元分化以及轴突延伸具有积极作用。然而,源于小鼠的 Matrigel 由于成分不确定且具有肿瘤来源,无法应用于临床。
胶原水凝胶
除 Matrigel 外,胶原水凝胶对神经谱系细胞也具有类似作用。例如,Yang 等人研究发现,小分子化合物与胶原水凝胶联合处理可诱导原位内源性 NSCs 向神经元分化,并恢复受损功能。
海藻酸盐
另一种天然水凝胶海藻酸盐,因结构与脑内细胞外基质(ECM)的主要成分透明质酸相似,也被用作构建 3D 细胞培养系统的潜在生物材料。海藻酸盐是从海带或褐藻的马尾藻中提取碘和甘露醇的副产品,其水溶液具有高黏度,常用作食品增稠剂、稳定剂和乳化剂。Moxon 等人将海藻酸盐和胶原混合,制备出模拟脑 ECM 某些特性的定制水凝胶,研究发现包埋其中的人多能干细胞(hPSCs)来源的神经元能黏附在水凝胶基质上,并形成 3D 神经网络。
水凝胶复合材料
近年来研究表明,Matrigel、海藻酸盐等天然材料可通过设计、合成形成水凝胶复合材料,进而制备具有多孔或特定排列结构的支架。这些结构能为 3D 支架上的接种细胞提供所需的生物力学支撑,并创造优化条件,促进功能性组织的形成。例如,Primo 等人利用具有特定排列的功能化单壁碳纳米管基海藻酸盐复合凝胶,建立了一种制备用于细胞治疗和其他应用的导电基质的新方法。
在另一项研究中,将成年 NSCs 培养在碳纳米管(CNT)- 水凝胶复合材料上,优化后的生物力学支撑提高了神经元与星形胶质细胞的比例,并诱导形成更高的突触连接性,表明水凝胶复合材料有望成为兼具高导电性和生物相容性的材料,用于促进神经再生。
脱细胞组织基质(DTM)
脱细胞组织基质(DTM)是开发个性化临床方法的另一种有前景的支架,在促进神经组织再生方面展现出独特优势,尤其是源于中枢神经系统的 DTM。Xu 等人对源于脊髓的 DTM 水凝胶(DSCM - gel)进行分析,发现 DSCM - gel 保留了类 ECM 的纳米纤维结构,且具有更高的孔隙率,在 3D 培养中能增强 NSCs / 神经祖细胞(NPCs)的活力、增殖、迁移和神经元分化。
总结与注意事项
水凝胶支架易于支持 3D 神经细胞培养,支架的多孔结构有利于氧气、营养物质和代谢产物的运输,使细胞能在支架网络内增殖、迁移,并最终黏附在支架网络上(具体案例见表 1)。但需控制通过该技术获得的球体大小,因为较大的 3D 球体会因缺乏营养而导致中心坏死。
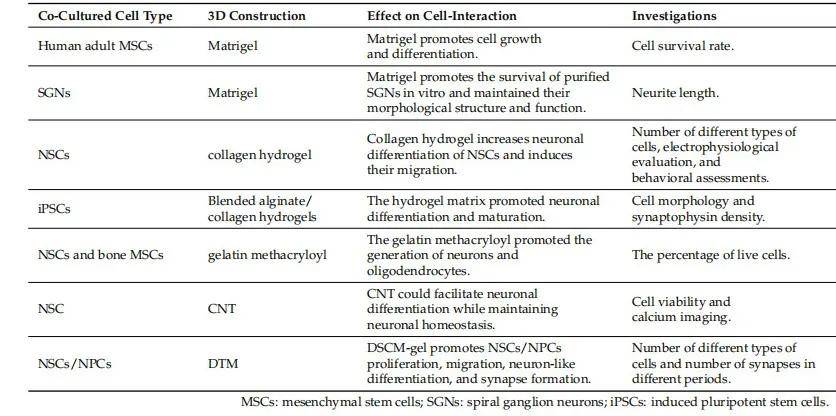
表 1 基于细胞的 3D 共培养系统案例
2. 基于组织切片的 3D 共培养系统
- 发展历程
器官型脑切片培养技术最早于 20 世纪 60 年代发展起来,1991 年 Stoppini 等人将脑切片培养作为神经科学研究的新模型引入,至今已被广泛用作体外模型,用于研究神经发育和再生的多个方面,如细胞增殖、凋亡、胚胎皮质形成以及神经肿瘤细胞的迁移 / 侵袭等(具体案例见表 2)。
- 优 势
保留体外系统优势: 组织切片保留了体外系统的主要优势,弥补了细胞系功能缺失的不足,在一定程度上维持了组织的形态结构、组织活性和器官功能,为神经分化和神经回路形成提供了有利的微环境。例如,Wang 等人通过将诱导多能干细胞(iPSCs)与人胎儿小脑切片共培养,成功诱导 iPSCs 分化为具有电生理功能的浦肯野细胞;研究还表明,牙髓干细胞(DPSCs)在器官型切片共培养系统中可分化为神经元。
研究血管系统与 CNS 的关系: 器官型切片的另一优势是保留了生理状态下血管系统的 3D 排列。血管系统与中枢神经系统存在功能上的相互依赖,因此脑切片可作为研究血管系统对神经分化和发育影响的理想模型。例如,将胚胎干细胞(ESCs)与海马切片共培养,ESCs 会分化为神经祖细胞(NPCs)并迁移到海马切片的血管上,而血管相关星形胶质细胞产生的趋化因子 CXCL12 在这一迁移过程中发挥重要作用。
疾病模型研究: 将器官型切片与共培养技术结合,对研究各种神经通路和疾病模型尤为有益。例如,在缺氧缺糖条件下,海马切片可用于模拟氧化应激引起的中枢神经系统损伤;将成年全脑冠状切片与胶质瘤干细胞(GSCs)共培养,可用于模拟胶质母细胞瘤肿瘤 - 宿主细胞相互作用,研究多形性胶质母细胞瘤的治疗方法。
此外,脑切片还是在细胞和分子水平阐明少突胶质前体细胞(OPC)分化和髓鞘形成机制的有力工具,如 Baudouin 等人将 OPC 移植到小脑切片中研究髓鞘形成。
脊髓切片的应用
除脑切片外,脊髓切片也广泛应用于神经修复和再生等神经科学研究。脊髓作为中枢神经系统的重要组成部分,是周围神经与大脑之间的通路,向上与延髓相连,向下通过脊神经与周围神经相通。例如,有研究将大鼠脊髓切片与周围神经移植物共培养,并施加不同浓度的米诺环素,观察其对运动神经元存活率的影响;为分析血管和神经结构之间的相互作用,
Mariya 等人将小鼠脊髓切片与主动脉片段在体外共培养,结果表明神经组织对主动脉出芽具有显著的积极影响,该共培养系统为进一步研究驱动神经组织和内皮组织之间复杂相互作用的机制提供了有用且有前景的模型。
- 局限性
基于切片的共培养系统虽能提供与体内高度接近的微环境,但仍存在一定局限性,如组织切片的制备和操作过程复杂,需要相对精细的操作和经验积累,且与其他体外培养一样,脑切片无法完全重现体内的生理环境。
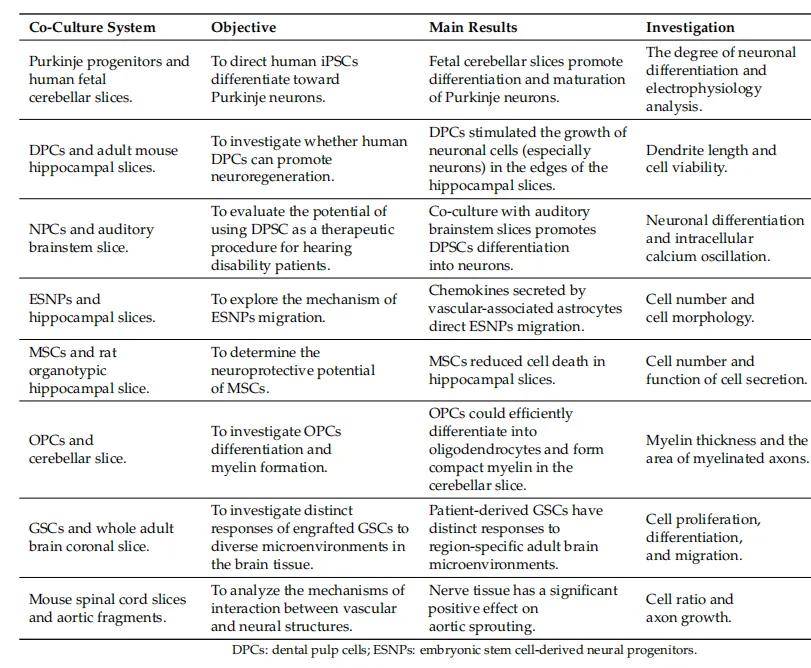
表 2 基于组织切片的 3D 共培养系统案例
3. 基于类器官的 3D 共培养系统
- 类器官的优势
源于多能干细胞(PSCs)的新型 3D 模型 —— 类器官,在神经发育建模、疾病机制分析和潜在治疗方法开发方面具有巨大潜力。脑类器官、脊髓类器官等类器官可在体外重现神经发育过程,探究中枢神经系统不同区域间的相互作用,以及人类中枢神经系统的进化及其独特调控机制。
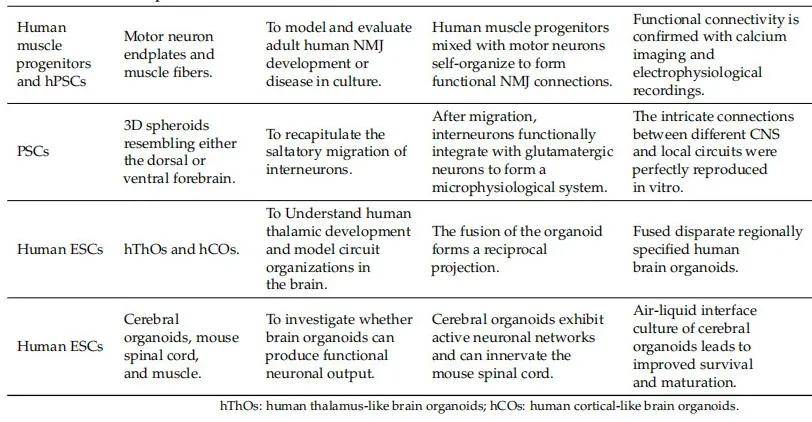
因此,基于类器官的 3D 共培养系统可用于研究涉及多个系统或组织的疾病过程,如神经肌肉疾病(NMDs)、肌萎缩侧索硬化症(ALS)以及中枢神经系统不同区域与局部回路间的复杂连接(具体案例见表 3)。
- 主要类型及应用
- 神经肌肉共培养系统
神经肌肉疾病(NMDs)由中枢神经系统、骨骼肌或神经肌肉接头(NMJ)的功能缺陷引起,而 NMJ 是一种独特的特殊化学突触,在将脊髓运动神经元的信息传递和放大到骨骼肌过程中起着关键作用。Martins 等人利用人多能干细胞(hPSC)来源的轴干细胞生成了可在三维空间中维持数月的人神经肌肉类器官(NMOs)。这些 NMOs 具有自组织特性,可同时生成脊髓神经元和骨骼肌细胞,并产生由功能性 NMJ 驱动的收缩活动,为深入了解人类发育过程以及分析不同细胞类型在 NMDs 中的作用提供了独特视角。
该研究的优势在于这些 NMOs 直接源于多能干细胞,可分别分化为属于外胚层或中胚层的脊髓神经元和骨骼肌细胞。未来的挑战在于实现 NMOs 的完全成熟,并探究发育过程中功能性 NMJ 如何形成。例如,ALS 是一种进行性 NMD,涉及运动神经元丢失和肌肉萎缩。为提供研究 ALS 发病机制的平台,Osaki 等人在 3D 基质中共同培养骨骼肌束和 iPSCs,在该 3D 共培养系统中,可观察到运动神经元与骨骼肌形成功能性连接的 NMJ,且二者具有协同作用。
目前,体外 NMJ 模型主要用于小规模独立研究,未来有望通过共培养系统的进一步发展,加深对周围神经系统神经退行性疾病的分子水平理解,并助力药物筛选,为人类 NMD 病理生理学研究和开发实用有效的治疗策略提供可能。
组装体(Assembloids):多器官共培养系统
在中枢神经系统中,许多神经细胞聚集形成有机网络或回路,不同脑区与局部回路间存在复杂连接,相互影响并决定中枢神经系统的功能活动,而协调与整合是完成这些功能活动的重要特征,但人类在这些关键活动的功能研究方面仍存在较大局限。在体外融合具有不同区域特性的多个类器官,为研究特定神经元细胞类型的相互作用以及有机网络的协调提供了机会。值得注意的是,这些体外特定类器官可在个性化人类微生理系统中由 hPSCs 生成。
2017 年,Birney 等人构建了一种人类 3D 微生理系统,该系统包含功能整合的谷氨酸能神经元和 γ- 氨基丁酸能(GABA)神经元,分别类似背侧或腹侧前脑,能够捕捉更复杂的发育过程。此外,通过融合区域特异性类器官并进行实时成像,可分析人类中间神经元的迁移和整合,用于模拟人类中间神经元迁移。值得一提的是,融合类器官中的神经元比非融合单一类器官中的神经元表现出更高的放电频率,这表明融合类器官具有单一类器官所不具备的额外神经元特性。例如,人类内侧神经节隆起类器官和皮质类器官可生成具有生理功能的神经元和神经网络。
最典型的基于类器官的共培养系统是脑 - 脊髓 - 骨骼肌组装体,可用于模拟 NMDs。2019 年,Lancaster 团队发表了一种在气 - 液界面培养脑类器官的方案,并成功利用脑类器官控制肌肉收缩。该系统不仅大幅提高了神经元的成熟度和存活率,还能使脑类器官神经元的轴突侵入脊髓,进而通过控制脊髓来控制肌肉,在体外完美重现了中枢神经系统不同区域与局部回路间的复杂连接。
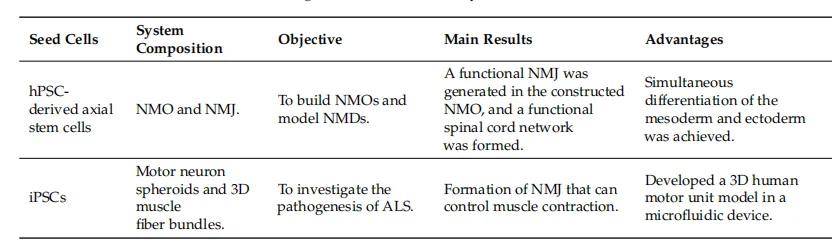
表 3 基于类器官的 3D 共培养系统案例
四、基于微流控平台的神经 - 神经胶质细胞共培养系统
1. 微流控平台的优势与组成
阐明中枢神经系统不同脑区与局部回路间的复杂连接需要长期培养和精确控制。为实现长期培养,研究人员构建了微流控装置来模拟体外环境,在该装置中,不同类型的细胞在相互连接的独立腔室中培养。微流控装置可通过流体循环为细胞提供营养和氧气,使细胞暴露于分化、生长、存活和增殖所需的空间信号或信号梯度,还能在可重复的体外培养条件下分析动态的细胞间相互作用。近年来,微流控系统已在癌症研究、药物筛选、血管模型和神经科学等多个领域得到广泛应用。
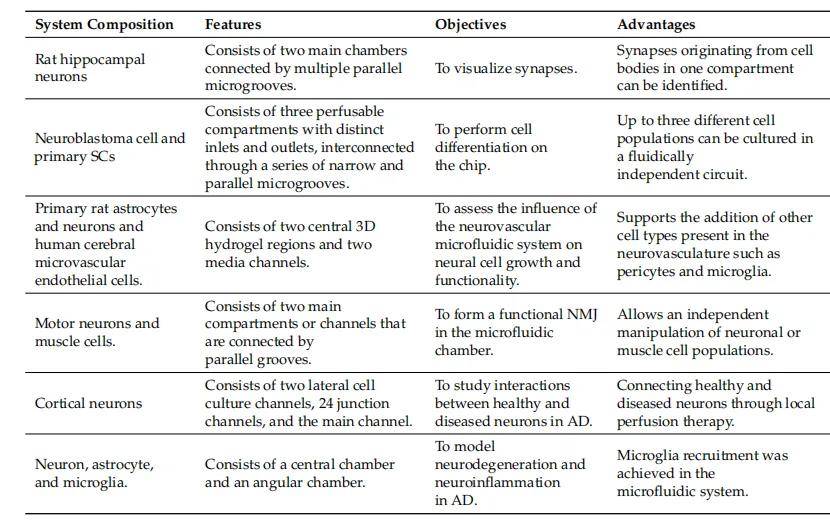
微流控系统是一个整合了微流体驱动、操控、监测、反应、检测和分析等功能的实验平台,通常由流体驱动子系统、过程监测子系统、微流控芯片以及检测分析子系统等不同子系统组成。其中,微流控芯片是系统的核心组件,通常需根据研究应用设计微流控芯片,再根据芯片功能需求选择所需的其他组件。微流控芯片的主要特征是其有效结构(通道、反应室和某些其他功能组件)在至少一个维度上以微米尺度容纳流体。由于微米尺度的结构,流体在其中表现出与宏观尺度不同的特定性质,因此具有独特的分析特性。与传统培养方法相比,微流控装置具有诸多优势,如可实现不同细胞类型的空间分离,能更好地控制细胞微环境,且与 3D 细胞培养兼容,为构建疾病模型开辟了新途径(具体案例见表 4)。
表 4 微流控平台案例
2. 微流控平台的应用案例
- 突触可视化与细胞分化研究
Taylor 等人利用分区微流控腔室尝试对两组不同的海马神经元进行分区培养,以便观察它们之间的突触。该微流控分区由两个主要腔室组成,通过多个平行微槽连接。
研究发现,神经元轴突会交织进入微槽和相邻的分区腔室,表明两组不同神经元群体之间的突触可在微槽内形成。随后,Vitis 等人开发了一种三腔室装置,可用于控制细胞迁移、不同腔室间的神经突导向以及芯片上的细胞分化。该平台有三个不同的可灌注腔室,具有不同的入口和出口,通过一系列狭窄且平行的微通道连接。在这项研究中,进行了长期细胞培养,发现细胞在微流控系统中可分化为特定表型。
- 神经血管模型构建
Adriani 等人开发了一种微流控装置,该装置包含两个中央 3D 水凝胶区域,其中含有模拟神经组织的神经元和星形胶质细胞,两侧是两个培养基通道,其中一个通道中培养模拟血管壁的脑内皮细胞。每个通道都与相邻通道相通,为细胞间相互作用和分子信号交换提供了可能。他们展示了由原代大鼠星形胶质细胞、神经元和人脑微血管内皮细胞组成的这种 3D 神经血管模型的功能。
在另一项研究中,Zahavi 等人开发了一种微流控系统,可实现轴突向外生长并支配远端腔室中的肌肉,该研究为深入分析运动神经元和肌肉之间的双向分子通讯提供了帮助。
- 中枢神经系统疾病模型研究
基于微流控系统的共培养系统也是理想的中枢神经系统疾病体外模型。Kunze 等人开发了一种微流控系统,在两个独立的细胞腔室中分别培养健康神经元和患病神经元,该系统中形成了神经突起网络连接,为体外研究阿尔茨海默病(AD)中受影响和未受影响神经元之间的相互作用提供了新平台。
此外,Park 等人开发了一种神经元 - 星形胶质细胞 - 小胶质细胞的微流控培养系统,该系统可实现小胶质细胞募集、促炎细胞因子 / 趋化因子分泌以及神经元 / 星形胶质细胞丢失,克服了以往 AD 神经元模型无法包含小胶质细胞介导的神经炎症变化的局限性。
微流控系统不仅可用于细胞培养,还可应用于组织切片培养。有研究利用微流控系统在通过微通道相互连接的腔室中培养海马切片,切片通过微通道延伸轴突,形成功能性连接,为研究癫痫的病理生理机制和药物筛选提供了新思路。此外,该平台还可用于研究其他脑区之间的通路(包括前额叶皮质、海马、杏仁核和下丘脑之间的边缘系统通路),有助于更深入地了解大脑的信息处理回路。
五、利用共培养系统建立微生物感染神经疾病模型
某些微生物(如病毒)可穿过血脑屏障进入中枢神经系统,因此可将类器官与微生物共培养,建立微生物感染神经疾病模型。本文主要总结了共培养系统中病毒感染脑类器官的相关研究。
1. 利用脑类器官共培养系统研究寨卡病毒(ZIKV)损伤中枢神经系统
ZIKV 是一种蚊媒黄病毒,成人感染通常症状较轻,但母婴垂直传播可导致新生儿小头症。许多研究通过 2D 神经祖细胞(NPCs)单细胞培养、3D 神经球培养或前脑切片培养来模拟 ZIKV 感染,但这些模型都难以揭示 ZIKV 诱导小头症的机制。而在一定程度上可模拟体内神经发育的脑类器官则是研究该机制的理想模型。
Haddow 等人利用 ZIKV 感染的前脑类器官进行研究,观察到感染的前脑类器官体积较对照组显著减小。该研究表明,ZIKV 进入胎儿大脑后,会靶向作用于 NPCs 的增殖,导致皮质发育出现类似小头的缺陷。
此外,Garcez 等人从多个层面(包括 iPSC 来源的 NSCs、NSC 形成的神经球和人 iPSC 来源的脑类器官)研究了 ZIKV 感染对神经分化和神经发生的影响,结果进一步证实 ZIKV 通过靶向 NPC 群体抑制神经发育,并诱导细胞死亡,从而影响神经球形成。这些研究为揭示 ZIKV 对人类大脑发育的影响做出了贡献,也进一步证实了 ZIKV 感染 NPCs 与新生儿小头症之间的关联。除揭示机制外,ZIKV 感染的脑类器官还可用于筛选治疗 ZIKV 感染的药物。
2. 病毒 - 脑类器官共培养系统为探究 SARS-CoV-2 潜在神经毒性提供初步见解
由严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)引起的 2019 冠状病毒病(COVID-19)会导致潜在致命的呼吸道症状,同时也会对肾脏、心脏、肝脏和大脑等其他器官造成损伤和功能障碍。越来越多的临床证据表明,COVID-19 患者会出现脑血管损伤、精神状态改变、脑病、低张力、嗅觉减退和神经精神障碍等神经系统症状,部分患者的尸检结果也显示其大脑中存在该病毒。
鉴于脑类器官的优越特性,其被广泛用于研究病毒对中枢神经系统的感染部位及其潜在作用靶点。研究表明,SARS-CoV-2 可感染脑脉络丛,并破坏脑类器官中的血脑屏障。另一项研究利用人 iPSC 来源的脑细胞单层和区域特异性脑类器官进行研究,发现 SARS-CoV-2 感染与炎症反应和细胞功能缺陷相关。这些发现表明,脑类器官为揭示 COVID-19 神经精神并发症的病理生理线索和潜在治疗方案提供了有前景的工具。
值得注意的是,从 2D 单层细胞模型到 3D 神经球和脑类器官模型,在不同水平进行全面研究,将有助于更深入、更全面地分析 SARS-CoV-2 感染中枢神经系统的机制。通常,神经球模型代表神经发生的早期特征,而脑类器官模型则展现出人类皮质发育的特征,能重现人类大脑的发育过程和生理结构。
综上,共培养系统已被广泛应用于缺血性中风、帕金森病(PD)、阿尔茨海默病(AD)和肌萎缩侧索硬化症(ALS)等多种神经系统疾病的研究,这有望成为未来神经科学研究的趋势。随着共培养和类器官建模技术的发展,基于脑类器官的共培养系统将在神经系统疾病机制研究和临床前研究中发挥更大作用。
六、结论与未来展望
1. 共培养系统的发展与优势
共培养系统的设计目的是模拟体内发生的细胞相互作用,通过共培养系统研究神经细胞间相互作用和神经回路,需要满足所有相关细胞类型需求的复杂培养条件。目前,细胞共培养系统已从 2D 发展到 3D 组装体,微流控装置的进步使细胞培养环境更接近体内生理环境。
毫无疑问,新型 3D 细胞培养模型是克服传统单层培养局限性的有效方法,尤其是 3D 组装体在模拟各种疾病状态、药物筛选以及研究生理和病理条件下细胞间相互作用方面具有巨大潜力。最重要的是,科研人员可利用患者来源的细胞生成这些组装体,构建个性化疾病模型,开展个体化治疗研究。
2. 共培养系统面临的挑战
然而,3D 组装体仍缺乏血管或免疫细胞等关键组成部分,因此将多个类器官组合成一个大型单一结构时,难以避免中心坏死的问题。另一个重大挑战是共培养模型的标准化。
3. 未来发展方向
结合当前培养、生物传感器和微流控等多学科技术,有望开发出更复杂、可重复且更接近自然的体外组织模型。毫无疑问,多器官共培养系统在神经发育、神经调节机制和神经系统疾病等领域的实际应用和理论研究中已取得一定成果,为该领域研究开辟了新的可能性和方向。
以上内容发表于《International Journal of Molecular Sciences》2022 年第 23 卷,由吉林大学相关研究团队
Rongrong Liu et al.撰写,系统综述了用于研究神经细胞相互作用的共培养模型,涵盖 2D、3D 共培养系统及微流控平台的应用,还探讨了其在病毒感染中枢神经系统(CNS)疾病模型中的作用,并对未来研究方向进行展望。
共培养系统(尤其是基于类器官的共培养系统)是控制和分析细胞相互作用的强大工具和技术集合。但类器官模型是人类组织实验研究中的最新技术,与传统模型相比仍处于探索阶段,其稳定性、可重复性、可扩展性以及如何精确控制微环境条件,已成为基于类器官的共培养技术发展需要克服的问题。为构建用于细胞相互作用研究的相关共培养系统,将类器官模型与标准化微装置相结合是未来的重要发展方向。
Kirkstall Quasi Vivo 多细胞/器官芯片串联动态灌流共培养系统平台,可通过流体循环为细胞供营养氧气、提供信号梯度,分析动态细胞互作,如分区腔室助观察海马神经元突触形成,三腔室装置控细胞迁移分化,还能构建神经血管模型、模拟 AD 等疾病。
Kirkstall Quasi Vivo 系统应用于神经细胞共培养研究,借鉴微流控平台优势,以动态灌流模拟体内微环境,为神经细胞提供更接近生理的培养条件,助力深入探究神经细胞间的复杂相互作用,如神经元与神经胶质细胞的信号传递、神经回路形成等机制,弥补传统静态培养不足,为神经科学研究提供新工具。

Kirkstall Quasi Vivo®类器官串联3D灌流共培养系统