北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
三维3D细胞培养评估多种霉菌毒素复合暴露
108 人阅读发布时间:2025-08-25 10:01
北 京 基 尔 比 生物科技公司主营产品:
Kilby 多通道3D细胞培养系统,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物的地面重力环境模拟装置【可以定制】,
Kilby Bio类器官芯片摇摆灌注仪,
Kirkstall Quasi Vivo 类器官3D串联仿生共培养系统

请联系我们,了解更多产品详情!
(一)研究背景
霉菌毒素问题:人类通过饮食同时暴露于多种霉菌毒素(如STE、OTA、PAT),但现有风险评估多基于单一毒素,可能低估实际风险。
研究目的:填补联合暴露的评估空白,评估STE、OTA、PAT三种霉菌毒素单独及联合暴露的毒性,并分析其相互作用。

(二)研究方法
模型:使用三维(3D)球体培养的人类神经母细胞瘤(SH-SY5Y)和健康骨髓间充质干细胞(BM-MSCs),更接近生理状态。
毒素浓度:基于文献和膳食暴露数据,设定STE(1.56–50μM)、OTA(0.78–25μM)、PAT(0.15–5μM)的浓度范围。
实验设计:单独及联合暴露(二元组合:STE+OTA、STE+PAT、OTA+PAT;三元组合:STE+OTA+PAT)72小时。
评估方法:
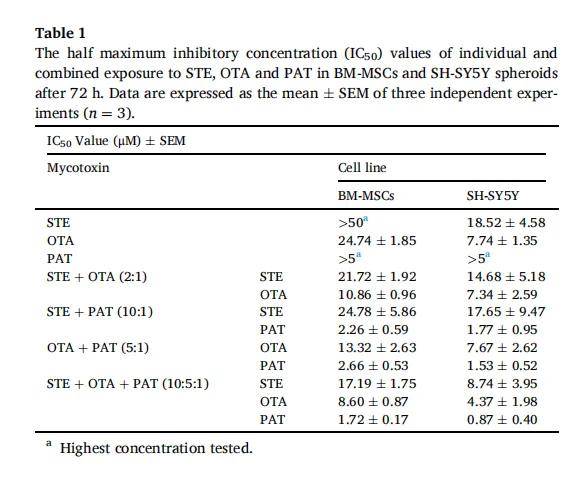
- 细胞毒性:ATP法测定细胞活力,计算IC50值。
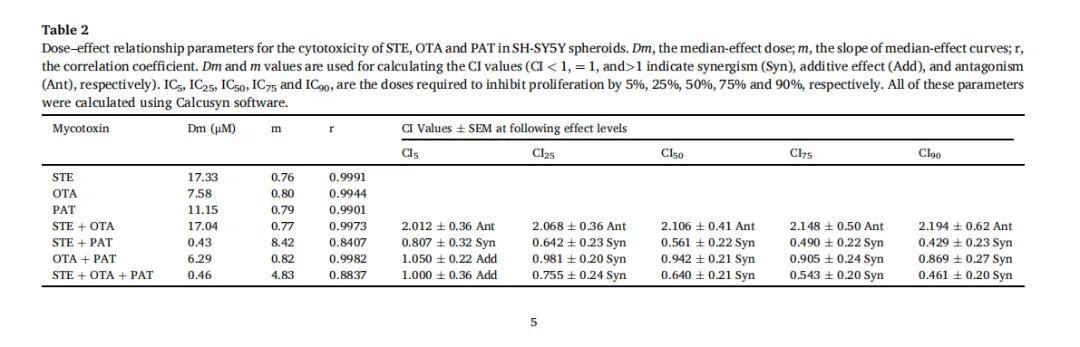
- 相互作用分析:使用等效线图(isobologram)和联合指数(CI)判断协同(CI<1)、相加(CI≈1)或拮抗(CI>1)效应。
(三)研究步骤
3-I、模型选择与构建
1. 细胞来源
• 肿瘤细胞:SH-SY5Y 人神经母细胞瘤细胞系(ATCC CRL-2266)。
• 健康细胞:BM-MSCs 人骨髓间充质干细胞(ATCC PCS-500-012),≤P9 代以内,以尽量维持干性。
2. 3D 球体制备流程
① 单层扩增 → ② 酶消化成单细胞悬液 → ③ 计数并调整密度 → ④ 接种到超低吸附(ULA)96 孔圆底板 → ⑤ 48 h 自聚集形成均一直径(≈250–300 µm)球体 → ⑥ 每 2–3 d 半量换液,保持微环境稳态。
3. 培养基配方
• SH-SY5Y:高糖 DMEM + 10 % FBS + 1 % NEAA + 1 % P/S。
• BM-MSCs:MSC 专用基础培养基 + 7 % FBS + 2.4 mM L-alanyl-L-glutamine + 125 pg/mL rhFGF-b + 15 ng/mL rhIGF-1 + 0.5 % P/S。
3-II、3D 球体的生理相关性
1. 结构特征
• 模拟体内微组织:外层增殖区、中层静止区、核心低氧/坏死区,形成氧气/养分/代谢物梯度。
• 细胞-细胞与细胞-基质相互作用恢复:E-cadherin、整合素信号、细胞极性等与体内组织相似。
2. 功能特征
• 代谢酶与转运体活性增强:如 CYP450、ABC 转运蛋白表达水平显著高于 2D,药物外排/代谢更接近人体。
• 基因表达谱变化:上调细胞外基质(COL1A1、FN1)、干细胞干性(SOX2、OCT4)及神经分化相关基因。
3. 与 2D 的差异

3-III、毒理学评价方法
1. 终点检测
• 细胞活力:CellTiter-Glo® 3D ATP 发光法,可穿透球体核心,保证全球体均一裂解。
• 高内涵成像(可选):PI/Calcein-AM 双染,验证坏死/凋亡空间分布。
2. 数据处理
• 浓度-反应曲线:非线性回归(log[inhibitor] vs. normalized response)计算 IC50。
• 三维重现性:独立实验 ≥3 次,每实验 3–4 复孔,确保 SEM <10 %。
3-IV、为什么选择 3D 而非动物模型
1. 伦理与 3R 原则:减少(Reduce)、优化(Refine)、替代(Replace)。
2. 通量与成本:96 孔平台,一次可同时检测数十种浓度组合,成本 <1/10 小鼠实验。
3. 人源化:直接使用人细胞,避免种属差异。
4. 剂量设计:依据欧洲膳食摄入估计值(谷物 222.5 g/d,水果 139 g/d)将体内 nM–µM 摄入量换算到 72 h 体外暴露系统,确保环境相关。
5. 组合毒性:球体模型能探测到 2D 难以发现的低剂量协同效应,如 STE+OTA+PAT 在 0.46 µM 即表现出明显毒性(CI≈0.46)。
(四)研究结论
联合毒性:STE、OTA、PAT联合暴露时毒性增强,提示实际风险可能高于单一毒素评估结果。
模型优势:3D球体模型提高了结果的生理相关性,为制定霉菌毒素混合物的监管标准提供了科学依据。
政策建议:需重新评估现有安全限值,考虑联合暴露风险,尤其在食品中多种霉菌毒素共存的情况下。
(五)研究意义
该研究利用 3D 球体模型在结构、代谢、基因表达层面高度模拟体内微组织,为霉菌毒素联合暴露的毒性评估提供了高生理相关性、高通量、低伦理负担的先进平台,其结果更能真实反映人类膳食暴露风险,并为后续监管决策提供坚实数据基础。
首次系统评估STE、OTA、PAT联合毒性,为霉菌毒素混合物的风险评估和监管政策提供重要参考,推动从单一毒素向多毒素联合评估的转变。
局 限 与 展 望
1. 缺乏血管化:今后可引入微流控芯片或共培养人脐静脉内皮细胞(HUVEC),构建“血管化球体”。
2. 免疫组分缺失:可整合巨噬细胞或外周血单核细胞(PBMC)形成免疫-肿瘤-毒素三向相互作用模型。
Kirkstall Quasi Vivo 3D 类器官串联芯片动态培养系统,作为类器官培养领域的前沿技术代表,为科研工作者提供了一个高度仿生的体外研究平台,其未来发展充满无限潜力,有望在多个关键领域掀起变革浪潮。
在药物研发进程中,该系统将扮演愈发关键的角色。一方面,它能够模拟药物在人体多器官中的吸收、分布、代谢和排泄(ADME)全过程,精准评估药物的疗效与安全性,大幅提升新药研发的成功率,缩短研发周期
疾病研究领域,Kirkstall Quasi Vivo 系统可构建出更复杂、更贴近真实情况的多器官疾病模型。以糖尿病并发症研究为例,将胰岛类器官与肾脏、心血管类器官串联培养,模拟糖尿病患者胰岛功能受损后,对肾脏和心血管系统的连锁影响,深入剖析疾病发生发展的分子机制,为开发针对性的治疗方案奠定基础。同时,利用患者特异性细胞构建个性化多器官芯片模型,能够预测药物对个体的疗效,真正实现精准医疗,提高治疗效果,减少不必要的医疗资源浪费。
在再生医学与组织工程范畴,该系统助力研究不同器官间的相互作用,如血管与器官的协同关系,为组织工程和器官移植开辟新思路。通过模拟体内环境,优化生物材料在多器官系统中的应用,促进器官的再生与修复。比如在构建人工肝脏组织时,利用该系统模拟肝脏微环境,使培养出的肝脏类器官具备更好的功能和活性,为肝脏移植提供更多可能。
此外,随着技术的持续迭代升级,Kirkstall Quasi Vivo 类器官串联芯片动态培养系统有望在食品安全评估、环境毒理学研究等领域发挥重要作用,评估食品添加剂、环境污染物等对人体多器官的潜在影响,守护公众健康与生态环境。