北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
Beijing kilby 构建与爆炸相关轻度创伤性脑损伤的脑类器官模型
65 人阅读发布时间:2025-08-18 15:29
军警人员在训练和作战中频繁暴露于低水平重复爆炸冲击波(rLLB),可能导致轻度爆炸性脑损伤(mbTBI),表现为慢性认知、精神、运动障碍。现有动物模型存在低通量、与人类神经结构差异大、重复性差等问题;传统细胞模型缺乏人脑复杂性。
脑类器官为研究重复爆炸引起的轻度脑损伤提供了前所未有的人源化、可控、高通量模型。未来需整合精密加载设备 + 高保真类器官 + 非侵入监测技术,以加速机制阐明、诊断标志物发现与干预策略开发。
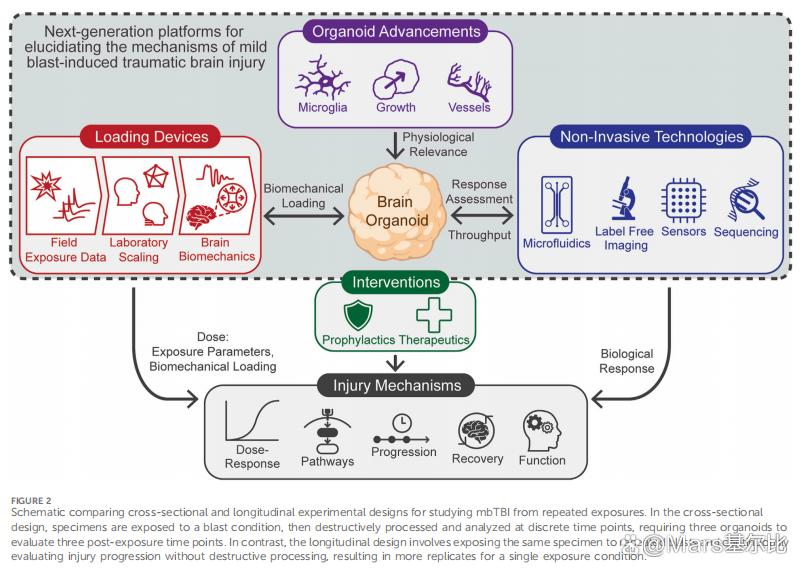
(一)脑类器官在模拟脑损伤(特别是爆炸引起的轻度创伤性脑损伤,mbTBI)方面,相较传统动物模型和二维细胞模型,具备以下五大核心优势:
✅ 1. 人源性:高度还原人类神经生理
来源:由人类诱导多能干细胞(iPSC)生成,保留个体遗传背景。
结构:具备人脑特有的细胞类型(神经元、星形胶质细胞、少突胶质细胞)和三维组织结构。
功能:可形成突触连接、神经网络和电活动,模拟真实脑功能。
✅ 2. 可控性:精确控制损伤参数
加载设备可模拟真实爆炸波形(频率、幅度、持续时间),实现剂量-反应关系研究。可独立研究原发性(压力波)损伤机制,排除动物模型中混杂的二次/三次损伤因素。
✅ 3. 高通量:适合大规模筛选
可并行测试多个爆炸参数或药物干预,显著提高实验效率。结合Kirkstall Quasi Vivo微流控芯片系统,实现标准化、可重复的大规模实验。
✅ 4. 长期动态监测:支持纵向研究
通过非侵入性技术(如微电极阵列、无标记成像)可连续观察损伤发展、修复过程。避免传统横断面设计的“牺牲式”采样,减少动物使用、降低成本。
✅ 5. 机制研究深入:细胞与分子层面解析
可结合单细胞测序、CRISPR基因编辑、外泌体分析,揭示: 细胞类型特异性的损伤反应, 炎症、氧化应激、突触功能障碍等分子机制, 潜在的生物标志物和治疗靶点
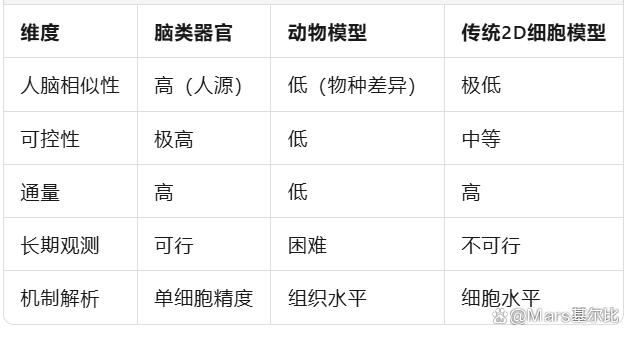
📌 小结对比表:

(二)诱导-成熟-加载-评估” 四阶段 21 步,标准化流程
脑类器官是当前最接近人类脑损伤生理过程、同时兼具实验可控性与伦理优势的模型系统,特别适合用于研究如爆炸暴露这类复杂、慢性、低剂量损伤机制。以下为标准化流程,将文献与最新实践整合为“诱导-成熟-加载-评估” 四阶段 21 步,可直接用于构建模拟爆炸所致轻度创伤性脑损伤(mbTBI)的人源脑类器官模型。
------------------------------------------------
阶段 1 诱导:从 iPSC 到神经上皮圆顶 (约 10–12 天)
1 材料准备
• hiPSC(融合度 70–80 %)
• mTeSR1 / Essential 8 培养基
• ROCK 抑制剂(Y-27632,10 μM)
• Accutase、Matrigel(生长因子减少型,4 ℃过夜解冻)
• 低黏附 96 U 底板、24 孔板、60 mm 皿
2 单细胞化 : Accutase 37 ℃ 5 min;重悬于含 ROCK 抑制剂的 mTeSR1,计数。
3 拟胚体(EB)形成 : 9000 活细胞 / 150 µL / 孔(96 U 底板),37 ℃ 5 % CO₂。24 h 可见光滑 EB。
4 神经诱导: EB 直径 500–600 µm 时转入神经诱导培养基(DMEM/F12 + N2 + SB431542 + LDN-193189,每 2 d 半换液,共 4–5 d)。
5 神经上皮圆顶出现 : EB 表面呈亮晕,出现放射状假复层上皮,提示原始神经外胚层形成。
------------------------------------------------
阶段 2 成熟:3D 结构扩张与功能成熟 (约 30–60 天,可扩展至 120 天)
6 Matrigel 包埋 : EB 转入 30 µL Matrigel 滴(4 ℃操作),37 ℃ 20 min 凝固,再置于 60 mm 皿。
7 扩张培养 : 脑类器官分化培养基(DMEM/F12 + B27 + BDNF + GDNF + IGF-1 + cAMP + 抗坏血酸),每 3–4 d 全换液,摇床 80 rpm。
8 区域化(可选): 如需特定脑区,在 D10–D15 加入模式因子:
• 前脑:DKK-1 + SHH
• 中脑:SHH + FGF8
• 皮质:仅 BDNF/IGF-1
9 血管化(可选): D20 起Kirkstall Quasi Vivo系统共培养人脐静脉内皮细胞(HUVEC)或 3D 打印微通道,改善核心供氧。
10 微胶质整合(可选): D25 起加入 iPSC 来源的微胶质前体(1×10⁵ cells / organoid),持续 7 d。
11 功能验证
• 免疫荧光:SOX2、PAX6、TBR1、MAP2、GFAP、OLIG2
• 电生理:MEA 记录自发锋电位与同步振荡
• 生长曲线:直径 ≥ 2 mm 且核心无坏死为佳。
------------------------------------------------
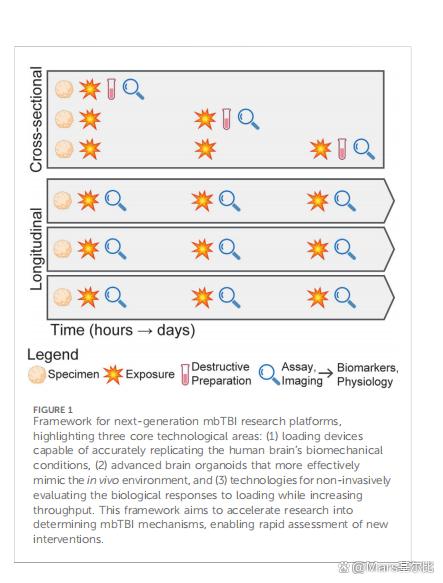
阶段 3 加载:模拟爆炸冲击波 (单次或重复)
12 设备选择
• 压电驱动压力腔(Silvosa 模型)或
• 微流控冲击管(MPS-on-chip)或
• 声辐射力冲击(Lai 模型)
13 压力校准 : 使用空压传感器在类器官表面测量峰值压力 28–90 kPa(对应 4–13 psi),持续时间 5 ms,频率 1–10 Hz。
14 固定与耦合 : 将类器官嵌入 1 % 低熔点琼脂糖或 3D 打印颅骨模拟器,确保边界条件一致。
15 单次加载 : 暴露 1×90 kPa 5 ms,用于急性损伤。
16 重复加载 : 30×28 kPa 5 ms,间隔 30 s,模拟训练日多次冲击。
17 对照设置 : 同装置、同温度、无压力暴露的类器官作为 Sham。
------------------------------------------------
阶段 4 评估:非侵入式纵向读出 (0 h–14 d)
18 实时记录
• 48 通道 3D-MEA:记录损伤前后网络振荡变化
• Ca²⁺ 成像(GCaMP6):观察急性 Ca²⁺ 峰与延迟去同步
19 结构成像
• 光片显微镜(LSFM)或三光子(3p.m.):深度 > 1 mm,无标记检测空洞与轴突断裂
• 高分辨 OCT:量化组织肿胀与空化
20 分子分析
• 单细胞 RNA-seq:分离神经元、星形胶质、微胶质,解析炎症、凋亡通路
• 外泌体(EV)液体活检:收集培养上清,检测 GFAP、Tau-p、IL-6、TDP-43
21 功能行为(新兴) : Organoid Intelligence 平台:将类器官与 AI 闭环训练,评估学习-记忆曲线损伤与恢复
------------------------------------------------
时间线速览
Day 0 iPSC 扩增
Day 1–5 EB 形成
Day 6–12 神经上皮诱导
Day 13–45 3D 扩张 + 区域化/血管化/微胶质
Day 46 功能验证
Day 47 爆炸加载
Day 48–60 纵向评估
------------------------------------------------
关键注意事项
• 全程 37 ℃ 5 % CO₂,摇床 80 rpm 防沉淀坏死
• Matrigel 滴 ≤ 30 µL,防止中心缺氧
• 爆炸加载前 2 h 停止摇床,避免剪切力干扰
• 重复加载实验需同批类器官、同装置、同操作者,确保可重复性

(三)类器官精密摇床(orbital shaker)/类器官芯片摇摆灌注仪在脑类器官培养中的作用,并非“可有可无”,而是解决三维组织内部物质交换瓶颈的核心环节。
1. 克服扩散极限,防止“中心坏死”
类器官直径 > 0.4 mm 后,仅靠静态扩散无法将 O₂/营养送到核心,代谢废物也无法排出,导致中心细胞缺氧、酸中毒、凋亡。 摇床通过持续低速摇动,形成连续的对流微流,显著扩大有效扩散半径,使类器官可长至 2–3 mm 仍保持活性。
2. 均一化微环境,减少批次差异
静态培养易造成局部营养梯度、pH 梯度,导致不同位置的细胞命运不一致。摇动使培养基均匀循环,保证每个类器官处于相同的温度、O₂、pH、生长因子浓度,提高实验可重复性。
3. 促进剪切力诱导的“机械成熟”
轻度层流剪切力(< 0.5 dyn cm⁻²)模拟胚胎脑发育中的脑脊液流动,可促进神经前体细胞增殖→神经元分化;上调血管生成因子(VEGF),协同血管化;诱导极化,帮助形成皮质分层结构。
4. 防止类器官沉降、粘连,维持圆球形态
静态条件下,类器官易沉降到培养皿底部,局部贴壁→形态塌陷、组织融合。摇动使类器官悬浮旋转,保持对称 3D 球状,利于后续受力均匀和成像定位。
类器官精密摇床(orbital shaker)/类器官芯片摇摆灌注仪通过“微尺度对流+轻度剪切力”,解决三维脑类器官核心坏死、微环境不均、形态失控三大难题,是脑类器官从“存活”走向“成熟”与“标准化”的关键硬件。
北 京 基 尔 比 生物科技公司主营产品:
Kilby 多通道3D细胞培养系统,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物的地面重力环境模拟装置【可以定制】,
Kilby Bio类器官芯片摇摆灌注仪,
Kirkstall Quasi Vivo 类器官3D串联仿生共培养系统