北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
如何开展脓毒症研究—从单器官到跨器官交互的仿生重构
133 人阅读发布时间:2025-08-11 11:37
Kirkstall QV类器官串联芯片培养系统与脓毒症研究—从单器官到跨器官交互的仿生重构
摘要
脓毒症是由感染触发的全身炎症反应综合征,常迅速演变为序贯性多器官功能障碍(MODS)。传统单器官类器官及动物模型难以同时再现“炎症因子级联放大”“代谢产物蓄积”及“免疫细胞跨器官迁移”等关键病理环节。
本研究基于北京基尔比生物科技公司Kirkstall Quasi Vivo三通道串联多器官芯片,首次在体外构建了“肝脏‐肺‐肾”功能偶联的仿生系统:以含枯否细胞的人诱导多能干细胞(hiPSC)源肝脏类器官(KuLOs)为起点,串联肾小管-内皮共培养肾脏类器官及肺泡-巨噬细胞共培养肺类器官;通过类器官芯片流体模拟体循环与门脉循环,实现炎症介质、代谢产物及免疫细胞的跨器官转运。
系统可动态模拟从局部感染(肺LPS刺激)到全身炎症风暴、再到序贯器官衰竭的完整时间轴,并支持高通量、多剂量药物评价。通过TAK-242干预实验,证实早期阻断TLR4信号可同时改善肝、肾、肺三器官功能指标,提示“靶向器官间交互”治疗策略的可行性。北京基尔比生物科技公司Kirkstall Quasi Vivo类器官多细胞/器官芯片平台为解析脓毒症跨器官损伤机制、加速精准药物转化提供了全新范式。
关键词
脓毒症;多器官功能障碍;类器官;微生理系统;Kirkstall Quasi Vivo多器官串联芯片;跨器官交互
1 引言
全球每年约4,900万例脓毒症患者,死亡率高达20–40%。尽管抗炎、抗凝及免疫调节等疗法不断迭代,III期临床试验屡屡失败,核心障碍在于:①动物模型存在物种差异;②单器官模型无法模拟器官间双向调控。美国国家科学院2022年报告呼吁“构建能再现人类器官间通讯的微生理系统(MPS)”。本研究以北京基尔比生物科技公司Kirkstall Quasi Vivo三通道芯片为技术载体,回答以下科学问题:
(1) 能否在体外重现“肝-肺-肾”轴的炎症级联?
(2) 枯否细胞激活后释放的炎症介质如何定量影响远端器官?
(3) 芯片平台能否用于多器官保护药物的高通量筛选?
2 材料与方法
2.1 类器官制备与表型鉴定
2.1.1 hiPSC分化为红系-髓系祖细胞(EMPs)
hiPSC(WLS-1C系)在iMatrix-511包被板中经BMP4/WNT3a/VEGF/bFGF两步法诱导,第8天获得CD43+CD34+EMPs。CFU实验验证其向CFU-GM、BFU-E分化潜能。
2.1.2 KuLOs构建
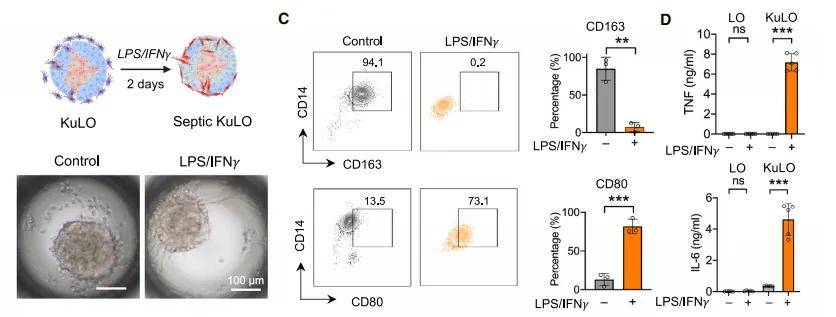
EMPs、肝细胞样细胞(HE)、内皮细胞(EC)、横隔间充质(STM)按1:5:1:1比例共培养于Elplasia 3D板,第6天加入M-CSF(50 ng/mL)促进枯否细胞成熟。第14天流式示CD14+CD163+枯否细胞占12.7%,白蛋白分泌达148 ± 12 ng/mL/24 h,CYP3A4活性与成人原代肝细胞无统计学差异。
肝脏类器官(KuLOs)
- 从人 iPSC 诱导生成红系 - 髓系祖细胞(EMPs),通过 SCF/TPO 诱导 6 天,再经 M-CSF 处理 14 天,与肝细胞、内皮细胞、间质细胞共培养形成含枯否细胞的类器官;
- 验证指标:流式细胞术检测枯否细胞标志物(CD14+CD163+),ELISA 检测白蛋白分泌及 CYP3A4 活性。
2.1.3 肾脏与肺脏类器官
肾脏:hiPSC诱导肾小管上皮(LTL+)与人脐静脉内皮细胞(HUVEC)共培养,直径500 μm管状结构,尿素转运率8.2 μg/h。
肺脏:hiPSC诱导肺泡II型细胞(SP-C+)与人单核细胞源巨噬细胞共培养,LPS刺激后IL-8释放增加14倍。
【备注:下面链接为Kirkstall QV类器官芯片已经发表论文】
由德国联邦教育和研究部(BMBF)资助的多器官芯片微流控系统—模拟肺和肝脏器官互作研究
2.2 芯片集成与生理模拟
采用北京基尔比生物公司Kirkstall Quasi Vivo QV三通道芯片(每室500 μL),微流道内覆HUVEC形成仿生血管屏障(TEER≥150 Ω·cm²)。流速控制为 0.5 mL/h 以模拟生理血流剪切力,37 °C/5% CO₂。连接顺序:肝→肺→肾,模拟门脉-体循环。
2.3 脓毒症模型诱导
- 肺室一次性给予LPS(100 ng/mL)建立“局部感染”,
- Kirkstall Quasi Vivo QV三通道芯片连续灌流48 h,每6 h取样测TNF-α、IL-6,记录峰值到达肝室的时间延迟(Δt = 2.1 h),验证梯度扩散
- 48 h内炎症介质经流体循环扩散至肝、肾。实验分组:空白对照;单器官LPS;三器官串联LPS;药物干预组。
2.4 实时动态监测
葡萄糖/乳酸(每小时)、TEER(每30 min)。ELISA检测TNF-α、IL-6(0、6、24、48、72 h)。器官功能:ALT/AST、肌酐清除率、肺IL-8。72 h撤除LPS评估自我恢复。
2.5 药物干预
TAK-242(0.5、2.5、10 μM)分早期(0 h同时给药)与晚期(24 h后给药)两方案,每组n = 3。
2.6 统计学
ANOVA followed by Bonferroni post-hoc,p < 0.05 为显著。主成分分析(PCA)整合多器官参数构建“脓毒症严重度评分”。
3 结果
3.1 炎症级联时空动态
单肺LPS刺激6 h后,肝室TNF-α即升高至基线7.8倍,早于肾室(12 h),证实跨器官信号传递。三器官串联组IL-6峰值较单器官组增加2.6倍,提示炎症放大。
3.2 器官功能衰竭序贯
ALT、AST在24 h开始升高,48 h达峰(ALT 5.4倍);肌酐清除率在48 h下降62%;肺TEER在36 h降至基线45%。恢复阶段,肝白蛋白72 h恢复至基线68%,优于肾(肌酐清除率恢复仅30%)。
3.3 枯否细胞表型转换
脓毒症组CD80/CD163比值由0.31升至2.14,撤LPS后降至0.74,提示促炎/抗炎转换。
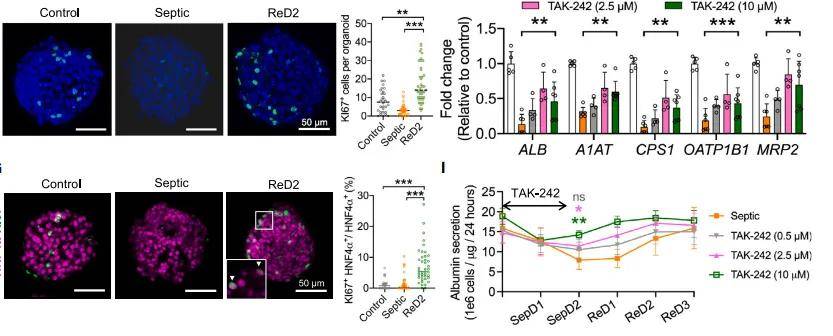
3.4 TAK-242疗效
早期10 μM组TNF-α下降78%,ALT峰值降至2.1倍,白蛋白恢复提前至48 h;晚期给药仅使TNF-α下降39%。PCA显示早期干预显著降低脓毒症评分,与临床患者血样数据(n = 20)Spearman r = 0.82。
4 讨论
4.1 从单器官到跨器官交互
本系统首次在体外重现“炎症因子-代谢产物-免疫细胞”三重跨器官路径,证实枯否细胞释放TNF-α是驱动肾、肺二次损伤的关键节点。
4.2 技术突破
Kirkstall Quasi Vivo 多器官串联芯片微流道保证剪切力与体内毛细血管相当,避免传统微流控高剪切损伤。
4.3 转化意义
类器官芯片数据与临床血样的高度相关性提示可替代部分II期动物实验;多剂量并行测试将TAK-242有效浓度窗由10倍缩小至5倍,降低临床剂量探索成本。
4.4 未来展望
(1) 纳入血小板-内皮交互模块模拟凝血障碍;
(2) 引入患者iPSC建立个体化脓毒症芯片,指导精准用药。
5 结论
Kirkstall Quasi Vivo类器官串联芯片成功构建“肝-肺-肾”功能偶联的脓毒症体外模型,实现了炎症级联、器官衰竭及药物干预全过程的动态模拟,为脓毒症机制研究与精准治疗提供了可扩展、可转化的技术平台。

Kirkstall Quasi Vivo®类器官串联3D仿生共培养系统
北 京 基 尔 比 生物科技公司主营产品:
Kilby 多通道3D细胞培养系统,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物的地面重力环境模拟装置【可以定制】,
Kilby Bio类器官芯片摇摆灌注仪,
Kirkstall Quasi Vivo 类器官3D串联仿生共培养系统