北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0.5
- 0.5
- 2.5
- 2.5
推荐产品
技术资料/正文
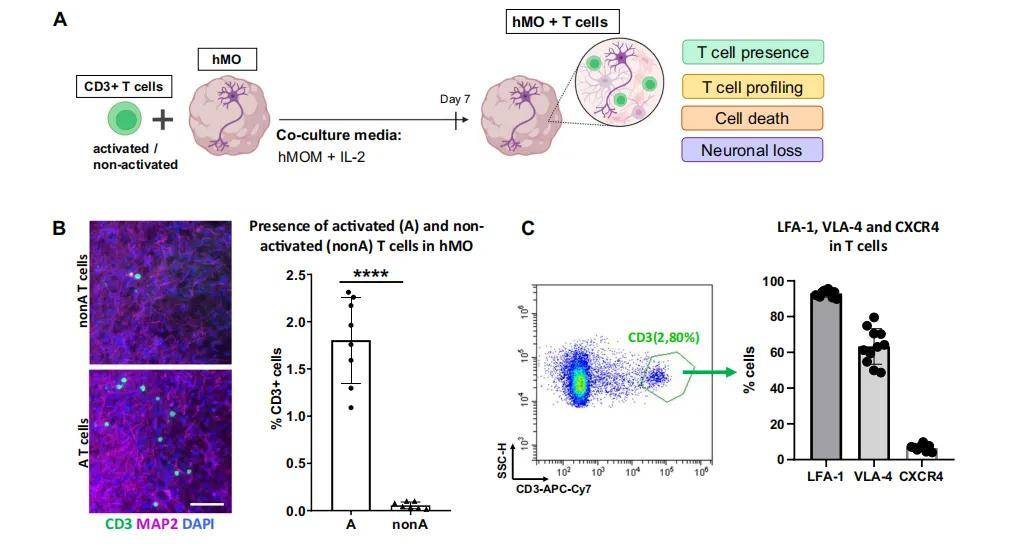
基尔比生物介绍脑类器官与T细胞3D共培养,研究帕金森病相关免疫-神经相互作用
61 人阅读发布时间:2025-08-01 22:28
帕金森病(PD)的神经变性与外周免疫细胞(尤其是 T 细胞)浸润中枢神经系统(CNS)及其与脑内细胞的相互作用密切相关,但 T 细胞与脑细胞的具体作用机制尚未明确。
构建一种由人诱导多能干细胞(hiPSC)衍生的中脑类器官(hMO)与外周血 T 细胞组成的 3D 共培养模型,旨在模拟 T 细胞与中脑组织的空间相互作用,为研究 PD 相关免疫 - 神经相互作用提供工具。
第一章:经典回顾
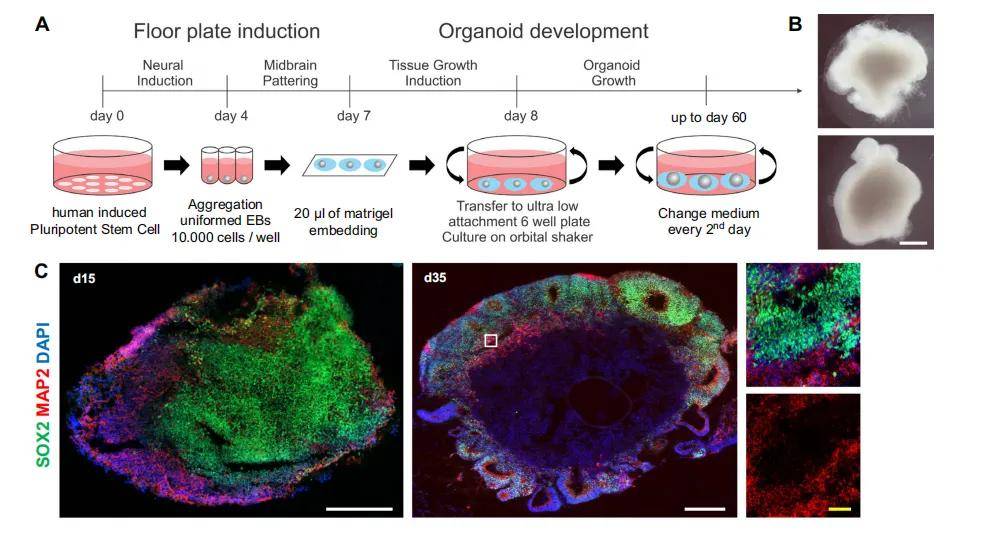
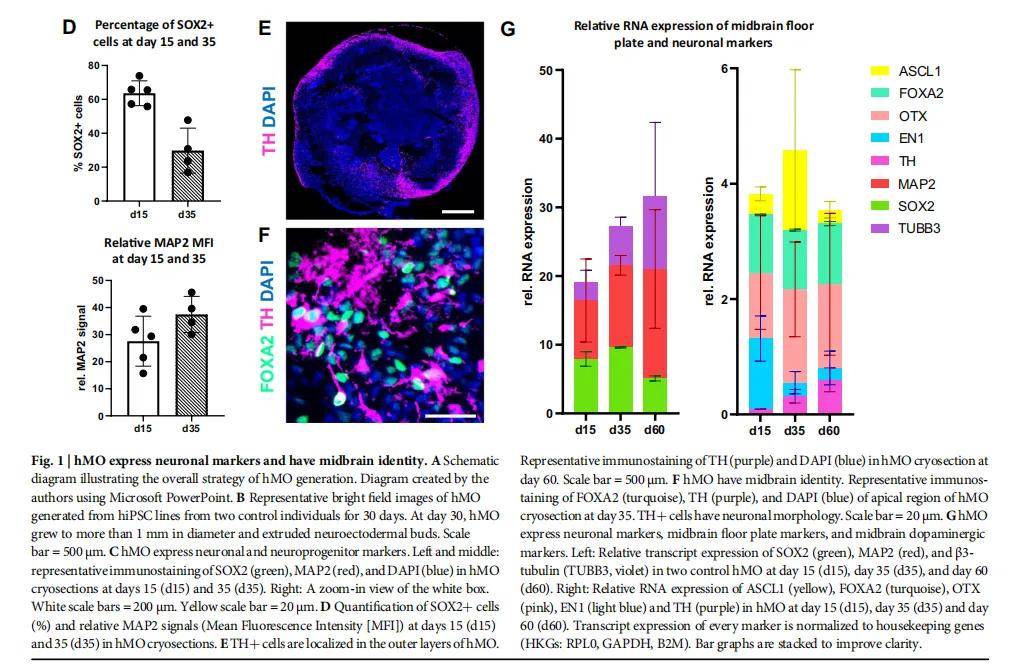
(一)人中脑类器官(hMO)的生成与分化:hMO 由健康供体成纤维细胞重编程为 hiPSC 后诱导分化而来
- hiPSC 制备
- 健康供体成纤维细胞通过逆转录病毒转导 OCT3/4、c-MYC、SOX2、KLF4 四因子重编程为 hiPSC,筛选 TRA1-60 阳性率 > 95% 的细胞系。
- 分阶段分化(30 天 / 60 天)
- 神经诱导阶段(第 0-4 天)
- hiPSC 单细胞接种于低吸附 U 型 96 孔板,使用神经诱导培养基(DMEM/F12:Neurobasal=1:1,添加 N2、B27(无维生素 A)、GlutaMAX、非必需氨基酸、β- 巯基乙醇、肝素、10μM SB431542、200ng/ml Noggin、0.8μM CHIR99021),并加入 10μM ROCK 抑制剂 Y27632(前 48 小时),2 天更换一次培养基。
- 中脑模式化阶段(第 4-7 天)
- 加入 100ng/ml SHH-C25II 和 100ng/ml FGF8,诱导神经外胚层芽形成。
- 组织生长阶段(第 7 天后)
- 将类器官嵌入 20μL Matrigel,使用组织生长诱导培养基(含 Neurobasal、N2、B27、胰岛素、层粘连蛋白、SHH-C25II、FGF8)培养 24 小时;随后转移至超低吸附 6 孔板,使用终分化培养基(含 BDNF、GDNF、抗坏血酸、db-cAMP),置于摇床上培养(促进营养交换),每 2 天换液,持续至 30 天或 60 天。
(二)外周血 T 细胞的分离与激活
分离:健康供体外周血单个核细胞(PBMC)中,通过 Pan T 细胞分离试剂盒(磁珠阴性选择法)分离 T 细胞,培养于含 10% 热灭活胎牛血清(FCS)的 RPMI 培养基中。
激活:使用 CD3/CD28 磁珠体外激活 T 细胞 48 小时(通过抗 CD3 和 CD28 抗体分别触发 T 细胞受体和共刺激分子),激活后涡旋 1 分钟去除磁珠,用于后续共培养。
(三)共培养实验步骤(核心部分)
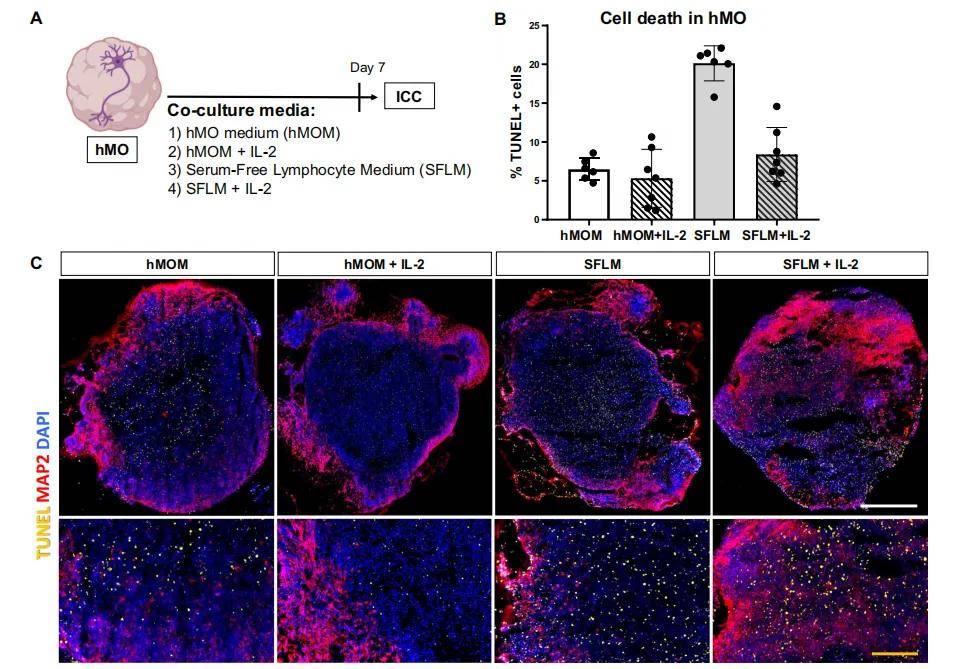
1. 共培养条件优化:通过测试 4 种培养基(hMOM、hMOM+IL-2、SFLM、SFLM+IL-2),评估 hMO 存活率和 T 细胞活性,确定最佳条件
- hMOM(中脑类器官培养基)
- 支持 hMO 存活的基础培养基(含 Neurobasal、N2、B27、BDNF、GDNF 等)。
- IL-2 补充
- 25U/ml IL-2 可维持 T 细胞存活与激活(流式细胞术显示 CD25 + 激活 T 细胞比例更高,存活率提升)。
- 最终选择
- hMOM+IL-2 为最优共培养培养基(同时支持 hMO 存活和 T 细胞活性)。
2. 共培养操作流程
- 细胞准备
- hMO:选择 30 天龄(1 个月)或 60 天龄(2 个月)的 hMO(分别模拟不同成熟阶段)。
- T 细胞:使用激活后的 T 细胞(CD3+CD25 + 比例约 100%)。
- 接种比例
- 每孔 2 个 hMO 对应 100 万 T 细胞(参考 PD 患者死后中脑组织中 T 细胞与神经细胞比例)。
- 培养条件
- 24 孔板中加入 2ml hMOM+IL-2 培养基,放入 hMO 和 T 细胞。
- 37°C、5% CO₂培养箱中,置于摇床上培养 7 天(促进细胞接触和营养交换),每 2 天更换一次培养基。
3. 共培养后分析方法
- T 细胞浸润检测
- 通过免疫细胞化学(ICC)染色 CD3 + 细胞,定量 hMO 中 T 细胞比例(流式细胞术或 ImageJ 计数)。
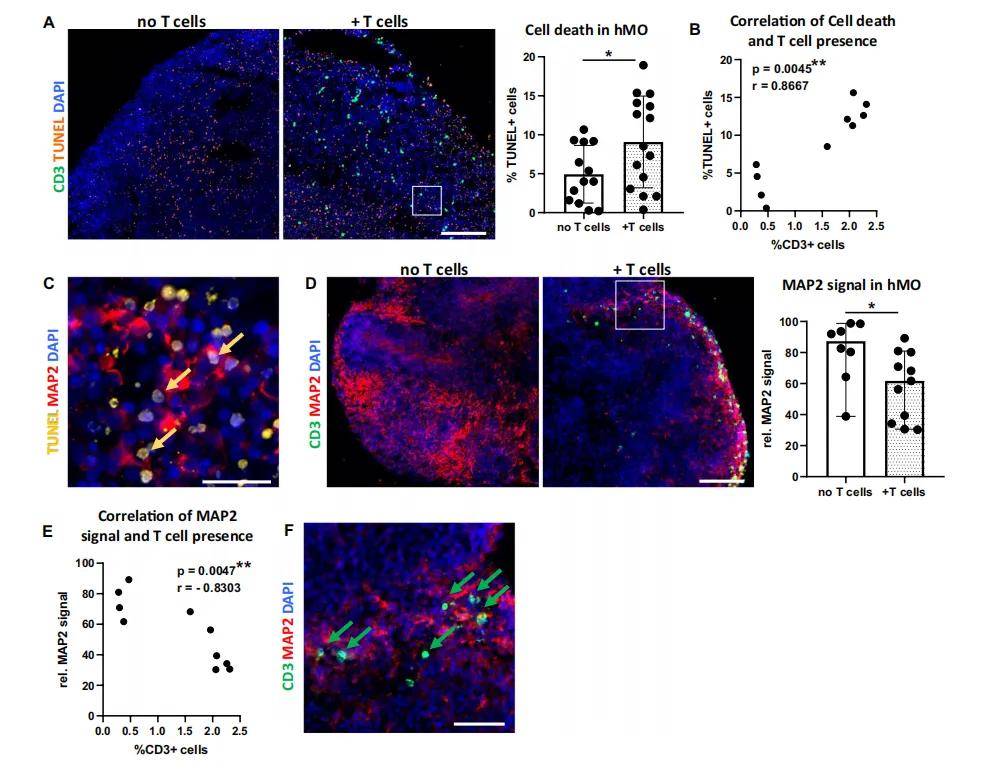
- 神经细胞损伤评估
- TUNEL 染色检测细胞凋亡(定量 TUNEL + 细胞比例)。
- MAP2 免疫荧光染色(神经元标志物),通过平均荧光强度(MFI)评估神经元丢失。
- T 细胞表型分析
- 流式细胞术检测浸润 T 细胞的亚型(CD4+/CD8 + 比例)、细胞毒性分子(CD107a、颗粒酶 B)及细胞因子(IFN-γ、IL-17、TNF-α 等)。
(四)本文研究的主要结果
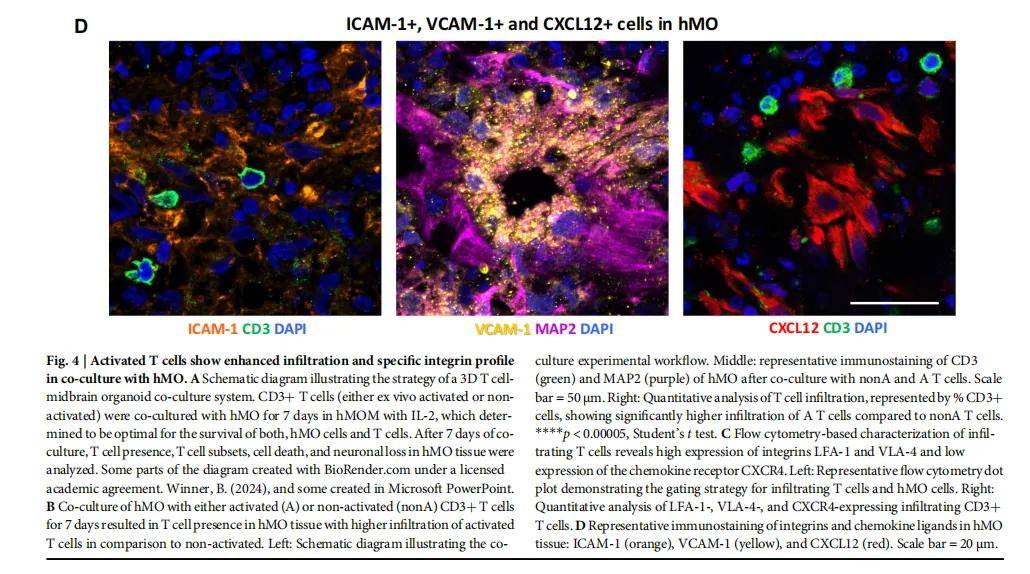
- T 细胞浸润与神经损伤
- 激活的 T 细胞可浸润 hMO,且 60 天龄 hMO 浸润更多(年龄依赖性);T 细胞浸润导致 hMO 中 MAP2 + 神经元减少,TUNEL + 凋亡细胞增加(与 T 细胞比例呈正相关)。
- 脑区特异性
- 与大脑皮质类器官(hCO)相比,hMO 对 T 细胞浸润更敏感,且 T 细胞介导的神经损伤更显著(符合 PD 中中脑易损性特征)。
- 机制提示
- 浸润的 T 细胞高表达 LFA-1 和 VLA-4 整合素(与 hMO 中的 ICAM-1、VCAM-1 配体结合),且 CD8+ T 细胞分泌颗粒酶 B 等细胞毒性分子,CD4+ T 细胞分泌促炎细胞因子,共同介导神经损伤。
上述3D 共培养模型可模拟 T 细胞与中脑组织的空间相互作用,揭示了 T 细胞浸润的年龄依赖性(老年 hMO 更敏感)和脑区特异性(中脑比皮质更易受损),为研究 PD 中免疫介导的神经变性机制及潜在治疗靶点提供了新工具。
第二章:用于T细胞和中脑类器官共培养的其他研究方法
除了第一章节文中提到的 3D 直接共培养方法(hMO 与 T 细胞在 hMOM+IL-2 培养基中混合培养),针对 T 细胞与中脑类器官的共培养研究,还有多种方法可从系统结构、细胞互作模式、环境模拟等角度优化或扩展
从微环境模拟(如Kirkstall Quasi Vivo微流控类器官串联芯片、支架)、细胞互作模式(间接共培养、多细胞协同)、病理相关性(疾病特异性模型)和动态监测(实时成像)等角度扩展了共培养体系,可根据研究目标(如机制探索、药物筛选)选择适配的方法。例如,微流控模型适合研究 T 细胞迁移的分子机制,Kirkstall Quasi Vivo多细胞串联共培养模型更适合解析免疫网络对神经变性的调控。
一、微流控芯片共培养系统
原理与设计
利用微流控技术构建仿生微环境,通过微通道分隔或连接类器官与 T 细胞区域,精准控制细胞接触方式、营养梯度和可溶性因子交换,模拟体内血流动力学和组织微环境。
操作要点
- 芯片结构
- 设计双腔室或多通道芯片,一侧接种中脑类器官(hMO),另一侧接种 T 细胞,通过微米级通道连接(通道孔径可调节,控制细胞迁移能力)。
- 流体控制
- 采用 syringe pump 维持培养基低速流动(如 1-5 μL/min),模拟脑内组织液循环,确保营养和代谢物交换,同时避免剪切力损伤细胞。
- 优势
- 可实时观察 T 细胞定向迁移(通过通道进入 hMO 区域)的动态过程;精准调控细胞因子(如趋化因子 CXCL12)的浓度梯度,研究其对 T 细胞浸润的影响;避免传统静态培养中代谢物积累的问题,延长共培养时间(可至 2-4 周)。
二、间接共培养模型(非接触式)
原理
通过物理屏障(如 Transwell 小室)分离 hMO 与 T 细胞,仅允许可溶性因子(细胞因子、趋化因子等)通过,研究 T 细胞通过 “旁分泌作用” 而非直接接触对中脑组织的影响。
操作要点
- Transwell 设置
- 将 hMO 接种于下室(6 孔板),T 细胞接种于上室(0.4 μm 孔径的 Transwell 插入式小室,允许小分子通过但阻止细胞迁移)。
- 培养基
- 使用文中优化的 hMOM+IL-2 培养基,确保上下室营养一致。
- 检测指标
- 下室 hMO 的神经元存活(MAP2 表达)和凋亡(TUNEL);上室 T 细胞分泌的细胞因子(如 IFN-γ、TNF-α)水平(通过 ELISA 或流式细胞术检测);对比直接共培养结果,区分 “T 细胞直接接触损伤” 与 “细胞因子介导的间接损伤”。
三、多细胞共培养模型(引入脑内常驻细胞)
1. 加入小胶质细胞(脑内常驻免疫细胞)
原理
小胶质细胞是脑内免疫调节的核心细胞,可与 T 细胞相互作用(如呈递抗原、分泌细胞因子),共同影响神经元存活。该模型更接近体内 “T 细胞 - 小胶质细胞 - 神经元” 的复杂互作网络。
操作要点
- 小胶质细胞来源
- 从 hiPSC 诱导分化为小胶质细胞(通过添加 CSF1、IL-34 等因子),或使用原代小胶质细胞。
- 共培养步骤
- 先将小胶质细胞与 hMO 共培养 3 天(让其整合入类器官);
- 再加入激活的 T 细胞,使用 hMOM+IL-2 培养基,置于摇床上培养 7 天。
- 优势
- 研究小胶质细胞是否通过 “吞噬 T 细胞释放的颗粒酶” 或 “分泌抗炎因子(如 IL-10)” 调节神经损伤,解释免疫细胞间的协同或拮抗作用。
2. 引入血管内皮细胞(模拟血脑屏障)
原理
血脑屏障(BBB)破坏是 T 细胞浸润脑内的前提,通过在 hMO 表面构建内皮细胞层(模拟 BBB),研究 T 细胞如何突破屏障进入中脑组织。
操作要点
- BBB 模拟
- 在 hMO 表面接种人脑微血管内皮细胞(HBMEC),培养 5-7 天形成紧密连接(通过检测 ZO-1、Claudin-5 等紧密连接蛋白验证)。
- 共培养
- 将 T 细胞接种于内皮细胞层外侧,观察其是否通过 “破坏紧密连接” 或 “跨内皮迁移” 进入 hMO,通过电镜或免疫荧光检测内皮屏障完整性(如 permeability 实验)。
四、3D 支架辅助共培养
原理
使用生物相容性支架(如明胶、海藻酸钠水凝胶)为 hMO 和 T 细胞提供更接近体内的三维空间结构,促进细胞外基质(ECM)相互作用,增强类器官的成熟度和 T 细胞的浸润效率。
操作要点
- 支架制备
- 将 hMO 嵌入含 ECM 成分(如层粘连蛋白、纤维连接蛋白)的水凝胶中,支架孔隙率控制在 100-200 μm(允许 T 细胞迁移)。
- 共培养
- 在支架周围接种 T 细胞,使用 hMOM+IL-2 培养基,通过 confocal 显微镜观察 T 细胞在支架内的迁移路径及与 hMO 的空间接触。
- 优势
- 支架可调节硬度(模拟脑内不同区域的机械特性),研究力学信号对 T 细胞 - 神经元互作的影响(如中脑区域的软硬度是否促进 T 细胞浸润)。
五、疾病特异性共培养模型
原理
文中使用健康供体的 hMO 和 T 细胞,而疾病特异性模型可通过引入 PD 患者来源的细胞,更精准模拟病理状态下的免疫 - 神经互作。
操作要点
- PD 患者 hMO
- 从 PD 患者皮肤成纤维细胞重编程为 hiPSC,诱导分化为 hMO(携带 PD 相关突变,如 LRRK2 G2019S),其多巴胺能神经元通常表现出 α- 突触核蛋白聚集、线粒体功能异常等表型。
- PD 患者 T 细胞
- 分离 PD 患者外周血 T 细胞(可能存在异常激活表型,如 Th17 细胞比例升高)。
- 共培养
- 采用文中优化的 hMOM+IL-2 条件,对比患者与健康对照的 T 细胞浸润能力、神经损伤程度,揭示 PD 特异性免疫机制。

北 京 基 尔 比 生物科技公司主营产品:
Kilby 全自动3D细胞培养仪,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物的地面重力环境模拟装置【可以定制】,
Kilby Bio类器官芯片摇摆灌注仪,
Kirkstall Quasi Vivo 类器官3D串联仿生共培养系统