北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
如何高效快速的成功构建血管化的三维SC-islet类器官模型?
67 人阅读发布时间:2025-06-26 14:41

1. 细胞准备
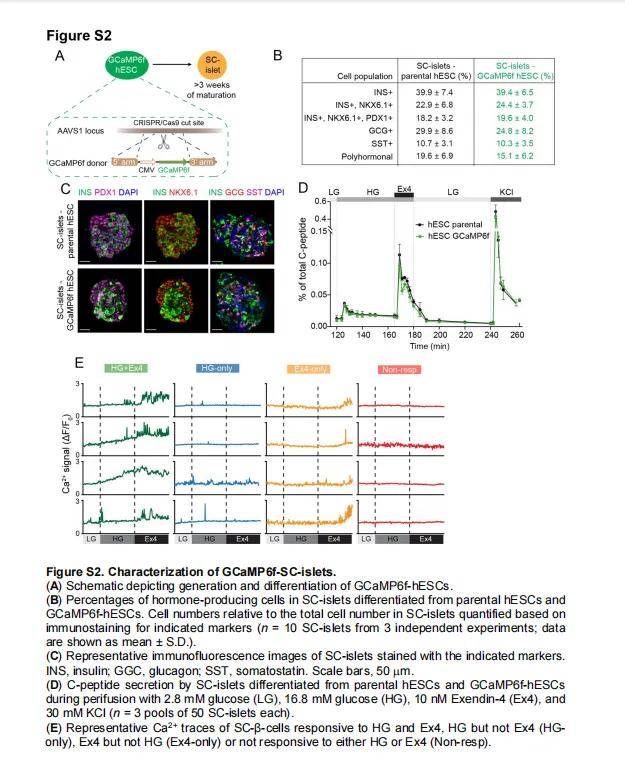
- 人多能干细胞(hESCs)分化为SC-islets:
- 使用H1 hESCs,按照七步分化步骤进行分化。
- 在第21天,将细胞用Accutase消化,重新聚集在低附着6孔板中,浓度为3×10⁶细胞/孔。
- 在第22天,将细胞聚集物转移到新的低附着6孔板中,并在118 rpm下振荡培养。
- 继续培养至第39天,用于后续的共培养实验。
- 人脐静脉内皮细胞(HUVECs):
- 购自Lonza,使用EGM-2培养基培养。
- 在第2代时,用表达Azurite Blue的慢病毒转导ECs,用于血管网络可视化。
- 人肺成纤维细胞(NHLFs): 购自Lonza,使用FGM-2培养基培养。
2. SC-islets的重聚集
- 将SC-islets用Accutase消化成单细胞,然后以约1000个细胞/微孔的密度接种到BSA包被的微孔平台(StemFIT 3D)中。
- 允许细胞在微孔中重新聚集至少2天,形成直径小于200微米的SC-islet簇。
3. 3D血管化SC-islet类器官的组装
- 制备3D纤维蛋白凝胶:
- 将纤维蛋白原粉末溶解在EBM培养基中,浓度为2 mg/ml。
- 将100个重聚集的SC-islets和2×10⁵个分离的ECs和FBs(1:1比例)悬浮在100 µl纤维蛋白原溶液中。
- 将细胞混合物与16 µl的50 U/ml凝血酶混合,形成凝胶。
- 凝胶培养:
- 将混合物倒入24孔板中,形成圆形凝胶滴。
- 在37℃下聚合30分钟。
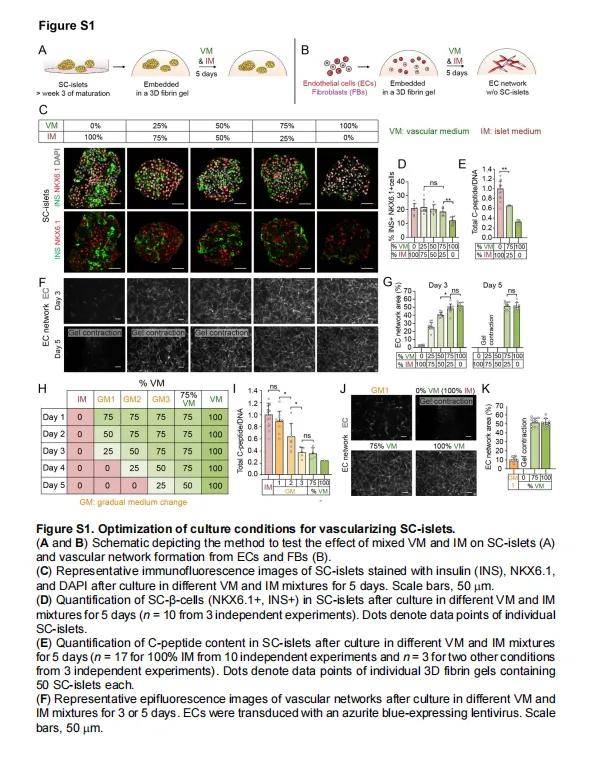
- 在凝胶上添加不同的共培养培养基(见表S1),维持4-7天。
4. 共培养条件优化
- 培养基调整:
- 测试了不同比例的血管化培养基(VM)和SC-islet培养基(IM)对细胞存活的影响。
- 确定75% VM + 25% IM的混合培养基能够支持血管网络的形成,但会降低SC-β细胞的胰岛素含量。
- 采用逐步培养基变化(GM1):从75% VM + 25% IM逐渐过渡到100% IM,以维持胰岛素含量。
- 细胞共培养:
- 在3D纤维蛋白凝胶中,将SC-islets与ECs和FBs共培养。
- 在GM1条件下培养5天,观察到ECs和FBs能够形成完整的血管网络,且SC-islets保持胰岛素含量。
5. 微流控设备中的血管化SC-islet类器官
- 设备制备:(略)
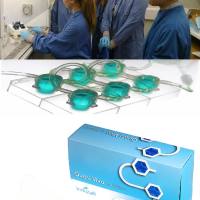
- 小编推荐使用成熟商品化的Kirkstall Quasi Vivo多细胞共培养微流控设备,通道通过组织室连接。
- 细胞加载:
- 将纤维蛋白原溶液(5 mg/ml)与0.15 U/ml抑肽酶和0.2 mg/ml纤维连接蛋白混合。
- 将100-130个SC-islets、35×10³个ECs和FBs(1:1比例)悬浮在5 µl纤维蛋白原-纤维连接蛋白溶液中,与1.2 µl的50 U/ml凝血酶混合后,加载到组织室中。
- 在37℃下孵育10分钟,然后用纤维连接蛋白涂覆上下通道,再孵育15分钟。
- 血管形成与培养:
- 在组织室中添加培养基,通过交替改变四个储液池中的培养基体积,诱导血管形成和与通道的吻合。
- 在第5天,使用70 kDa荧光素-葡聚糖测试血管的通透性。
- 在微流控设备中维持共培养长达7天,使用表S2中的培养条件。
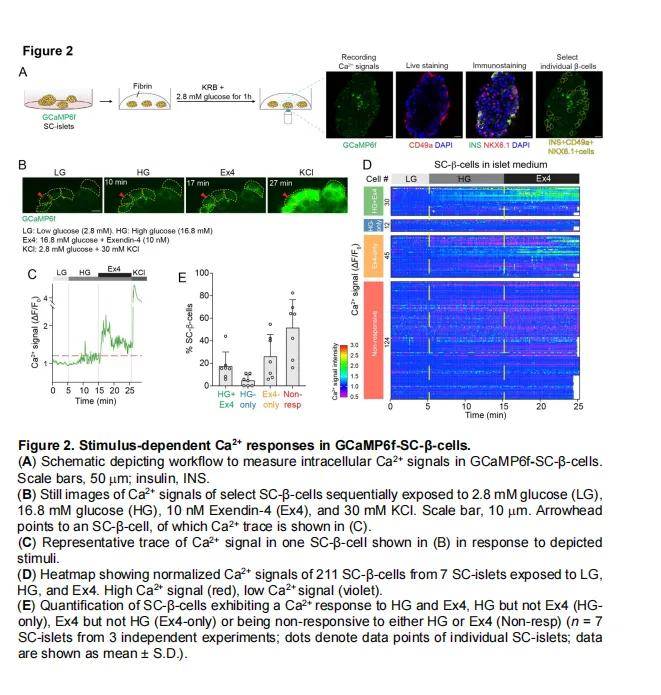
6. 功能验证
- Ca²⁺成像:
- 使用GCaMP6f-hESCs生成的SC-islets,通过活细胞染色和免疫荧光染色,监测SC-β细胞的Ca²⁺信号。
- 在低葡萄糖(2.8 mM)、高葡萄糖(16.8 mM)和Exendin-4(10 nM)刺激下,记录Ca²⁺信号。
- 胰岛素分泌检测:
- 使用Biorep灌流系统进行动态胰岛素分泌检测。
- 测量不同刺激条件下的C肽含量,评估胰岛素分泌功能。
7. 单细胞RNA测序分析
- 对SC-islets和微流控设备中的ECs和FBs进行单细胞RNA测序。
- 使用CellChat分析细胞间通信网络,预测ECs和SC-β细胞之间的信号通路,如BMP4信号。
通过以上步骤, Maike Sander et al.成功构建了血管化的三维SC-islet类器官模型,并验证了其在模拟胰岛功能和疾病模型中的潜力。


附:微流控设备中血管形成的具体操作步骤如下:
(1). 微流控芯片的设计与制备(略)
- 小编推荐使用成熟商品化的Kirkstall Quasi Vivo 动态3D活细胞自动化微流控设备
(2). 基质胶的制备与灌注
- 基质胶预处理:将基质胶预聚液放置于4°C冰上过夜,使其充分融化。同时将移液器、吸头和微流控芯片提前预冷。
- 灌注基质胶:将融化的基质胶与无血清DMEM培养基按1:1比例混合,用预冷的移液器吸取10μL混合液,从微流控芯片中间通道的入口处轻轻注入。
- 凝胶形成:将灌注好的微流控芯片放置于37°C培养箱中孵育30分钟,使基质胶充分聚合形成凝胶。
(3). 细胞接种与培养
- 细胞悬液制备:制备高密度的脐静脉内皮细胞(HUVECs)悬液,浓度为10⁶个/mL,与基质胶预聚液按1:1(v/v)混匀。
- 细胞接种:将HUVEC-Matrigel混合悬液注入微流控芯片的中间通道,置于37°C孵箱中孵育30分钟,形成包埋有细胞的基质胶网络。
- 培养基添加:在两侧通道中加入含有促血管生长因子(如VEGF、bFGF和EGF各10ng/mL)的DMEM完全培养基,为细胞生长提供营养。
(4). 血管生成与观察
- 细胞活性检测:培养3天后,使用钙黄绿素和碘化丙啶进行双染,考察细胞活性状态。
- 细胞迁移与管样结构形成:在促血管生长因子浓度梯度的诱导下,观察内皮细胞的迁移和管样结构形成情况。每隔12小时换液一次,维持浓度梯度。
- 成像与分析:利用相差显微镜或荧光显微镜观察细胞的迁移和管样结构形成情况,使用ImageJ软件计算细胞的最长迁移距离和迁移面积。
(5). 内皮细胞内衬与管腔形成
- 内皮细胞内衬:在微流控通道中,用层粘连蛋白包被通道,随后将高浓度的内皮细胞通入,使细胞均匀粘附在管腔壁上。
- 管腔形成:在细胞培养液层流剪切应力的作用下,24小时后,内皮细胞增殖并形成单层,构建模拟静动脉的大血管的内皮细胞内衬的管腔。
通过上述步骤,可以在微流控设备中成功构建血管网络,用于模拟体内血管生成过程和相关研究。

Kirkstall Quasi Vivo®类器官串联芯片3D动态培养系统
北 京 基 尔 比 生物科技公司主营产品:
Kilby 3D-clinostat 旋转细胞培养仪,
Kilby Gravity 微/超重力三维细胞培养系统,
3D回转重力环境模拟系统,随机定位仪,
类器官芯片摇摆灌注仪,
Kirkstall Quasi Vivo 类器官串联芯片仿生系统

请联系我们,了解更多产品详情!