北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
新发现:应用类器官研究人血管发育与糖尿病等疾病模型
161 人阅读发布时间:2025-04-28 15:09
序:
英国Kirkstall Quasi Vivo 3D类器官串联芯片动态培养系统,它通过在类器官芯片上集成多个模拟不同器官的微环境,实现不同类器官模拟物之间的相互作用和信号传递。这种系统能够模拟体内复杂的生理过程,包括药物代谢、毒性反应以及疾病进展。
(一)血管类器官的诱导与培养步骤
1. 多能干细胞培养
1.1 细胞系:使用人类胚胎干细胞(hESC)系 H9(来自 WiCell)和诱导多能干细胞(hiPSC)系 NC8。
1.2 培养条件:
- 在化学定义的无饲养层条件下培养,定期检测支原体污染,确保为阴性。
- NC8 和 H9 细胞在 E8 培养基中培养,培养皿预先用 165 µg/ml 无血清基质(GFR Matrigel)包被。
- mTagRFPT-CAAX WTC 和 iCRISPR 409-B2 细胞在 mTesR Plus 培养基中培养,培养皿预先用 hESC 质量级 Corning Matrigel 矩阵包被。
- 每天更换培养基,用 0.5 mM EDTA 在磷酸盐缓冲液(DPBS)中传代。
2. 血管类器官(hBVO)生成
2.1 细胞聚集:
- 用 TrypLE 处理细胞,收集后离心,重悬于聚集培养基(KnockOut DMEM/F12、20% KnockOut 血清替代品、1% GlutaMAX、1% 非必需氨基酸、55 µM β-巯基乙醇、100 U/ml 青霉素 - 链霉素、50 µm Y-27632)。
- 将细胞以 100 - 300 细胞 / 微孔的密度接种于 Corning Elplasia 圆底超低附着培养皿中。
- 形成直径 50 - 100 µm 的聚集体后,更换为 N2B27 培养基(Neurobasal : DMEM/F12 1:1、1% B27 补充剂、0.5% N2 补充剂、0.5% GlutaMAX、55 µM β-巯基乙醇、100 U/ml 青霉素 - 链霉素),并添加 12 µM CHIR99021 和 30 ng/ml BMP4。
2.2 中胚层诱导及分化:
- 第 3 天,更换为含 2 µm Forskolin 和 100 ng/ml VEGF-A 的 N2B27 培养基。
- 第 5 天,将聚集体嵌入 Collagen I-Matrigel 溶液(由 11.3% v/v 0.1 N NaOH、4.7% v/v 10X DMEM、0.9% v/v HEPES 缓冲液、0.7% v/v NaHCO3、0.5% v/v GlutaMAX、6.9% v/v Ham’s F12、50% v/v PureCol、25% v/v GFR Matrigel 组成,pH 7.4)中,转移到 12 孔板中。
- 从此时起,血管网络和类器官在 BVO 培养基(StemPro-34 SFM 培养基,添加 StemPro-34 营养补充剂、1% GlutaMAX、100 U/ml 青霉素 - 链霉素、15% 胎牛血清、100 ng/ml VEGF-A 和 100 ng/ml FGF2)中培养,每 2 - 3 天更换新鲜培养基。
- 第 10 天,将含有血管网络的凝胶置于培养皿盖上,在立体显微镜下用 27G 针头手动切取单个血管类器官,转移到 96 孔超低附着培养皿中继续培养。
(二)血管类器官疾病建模及移植步骤
1. 基因编辑
- 利用CRISPR/Cas9技术对多能干细胞进行基因编辑,引入与血管疾病相关的突变。
- 将编辑后的细胞进行筛选和扩增,获得稳定表达突变基因的细胞系。
2. 类器官诱导与培养: 按照上述血管类器官的诱导与培养步骤,从基因编辑后的多能干细胞中诱导形成血管类器官。
3. 疾病表型分析
- 通过免疫荧光染色、基因表达分析等方法,检测类器官中与疾病相关的分子和细胞表型。
- 观察血管类器官的形态、功能以及细胞间的相互作用,评估疾病模型的相似性和可靠性。
4. 药物筛选与验证
- 将不同药物添加到疾病模型类器官的培养基中,观察药物对疾病表型的影响。
- 通过高通量筛选技术,快速评估多种药物的疗效和潜在机制。
5. 移植模型评估
- 将携带疾病突变的血管类器官移植到免疫缺陷小鼠体内,观察其在体内的生长、分化和功能。
- 通过组织学分析和功能测试,评估移植后类器官的成熟度和疾病相关表型。
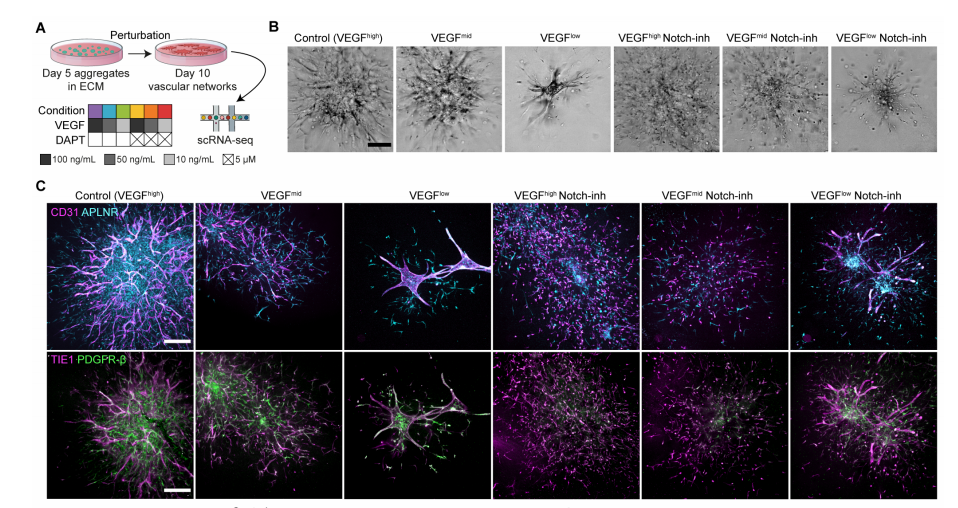
(三)原作者重要研究结论
Marina T. Nikolova et al.cell. 2025 Apr 16:S0092-8674(25)00387-3.
通过多种实验技术,对人血管类器官(hBVO)的发育进行深入研究,在糖尿病模型、脑血管研究等方面取得重要结论,为理解血管发育和相关疾病机制提供关键依据。
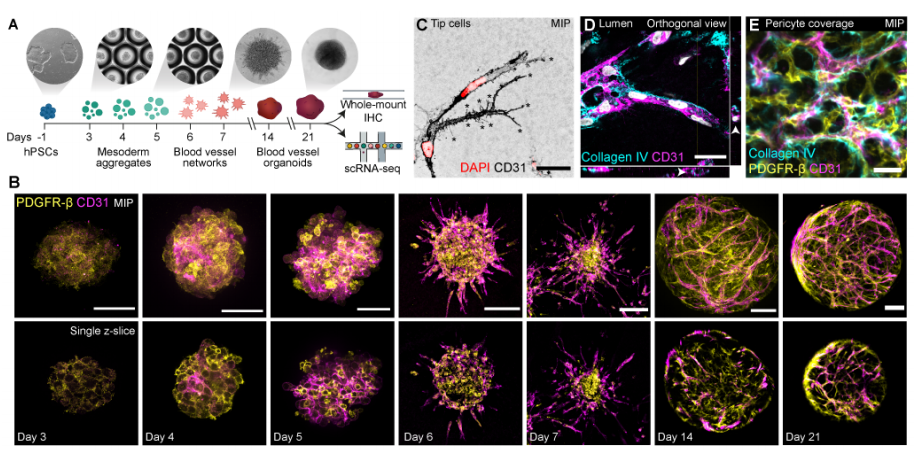
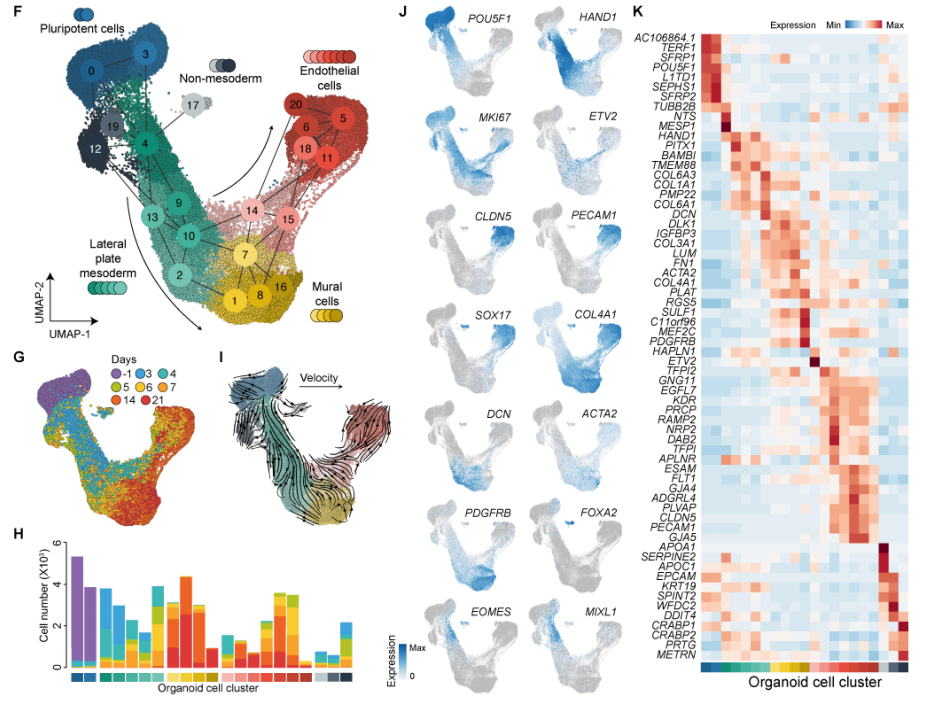
1. hBVO发育过程中的细胞命运和状态转变:研究利用单细胞转录组学等技术,详细解析hBVO发育轨迹。发现从多能干细胞开始,经侧板中胚层阶段,细胞逐渐分化为内皮细胞和壁细胞。其中,内皮细胞发育存在两个分支,早期内皮祖细胞(EPCs)在第4天出现,其ETV2表达峰值明显,之后逐渐分化,而晚期EPCs主要出现在第14 - 21天,且不表达ETV2 。同时,研究还证实了hBVO壁细胞具有分化为内皮细胞的潜能,丰富了对血管细胞发育的认知。
2. 糖尿病模型:文中构建hBVO模拟糖尿病血管病变。研究表明,hBVO在模拟糖尿病环境下,血管结构和细胞组成发生显著变化,与体内糖尿病血管病变特征相似。通过对相关信号通路的研究发现,VEGF和Notch信号通路对hBVO的发育和血管生成至关重要。在糖尿病状态下,这些信号通路的异常激活或抑制,会影响内皮细胞的分化、增殖和血管的稳定性,进而导致血管功能障碍。这为深入研究糖尿病血管病变的发病机制提供了重要的体外模型,有助于开发针对糖尿病血管并发症的治疗策略 。
-
在模拟糖尿病环境下,hBVO 的血管结构和细胞组成出现与体内糖尿病血管病变相似的显著变化,且 VEGF 和 Notch 等信号通路异常。这启示我们,深入探究这些信号通路的具体调控机制,明确它们在糖尿病血管病变中的关键节点,将有助于揭示糖尿病血管并发症的发病根源,为开发精准治疗策略提供理论支撑。例如,针对 VEGF 和 Notch 信号通路的异常变化,可以研发特异性的抑制剂或激活剂,精准干预病变过程,从而改善血管功能 。 -
人血管类器官hBVO 作为有效的体外模型,可用于评估潜在药物对糖尿病血管病变的治疗效果。在实验中,通过观察药物处理后 hBVO 血管结构和细胞功能的变化,能够快速筛选出具有治疗潜力的药物,大大提高药物研发的效率。以改善内皮细胞功能的药物筛选为例,可在 hBVO 模型上测试不同药物对内皮细胞分化、增殖和血管生成的影响,挑选出效果最佳的药物进行进一步研究和临床试验,缩短药物研发周期,降低研发成本 。
3. 脑血管研究:在脑血管研究中,研究人员发现hBVO内皮细胞与人类胎儿胰腺的内皮细胞在转录组上最为相似,但与脑内皮细胞存在差异。尽管如此,与脑海绵状毛细血管畸形相关的基因在hBVO内皮细胞中的表达高于胎儿小脑或大脑的内皮细胞。这一发现暗示,hBVO在模拟脑血管疾病方面具有一定潜力,同时也表明,虽然hBVO与脑内皮细胞存在差异,但某些疾病相关基因的表达特征可能为研究脑血管畸形的病理机制提供新线索 。通过对hBVO的研究,有助于深入理解脑血管疾病的发生发展过程,为开发针对性的治疗方法提供理论基础。
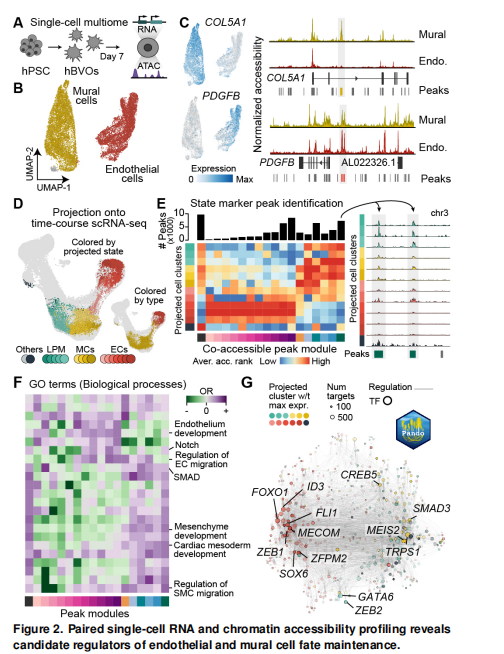
4. 其他重要结论:通过对hBVO进行基因扰动实验,明确了多个转录因子和受体在血管发育中的关键作用。例如,ETV2对内皮细胞发育不可或缺,MECOM虽在hBVO的内皮细胞中高表达,但并非内皮细胞发育所必需,而是对造血细胞和某些壁细胞亚型的分化具有指导作用 。此外,研究还发现hBVO移植到免疫缺陷小鼠后,内皮细胞可进一步成熟并获得动脉或静脉样表型,且壁细胞在体内可分化为多种间充质起源的细胞,这为研究血管发育后期阶段以及细胞治疗提供了重要信息 。
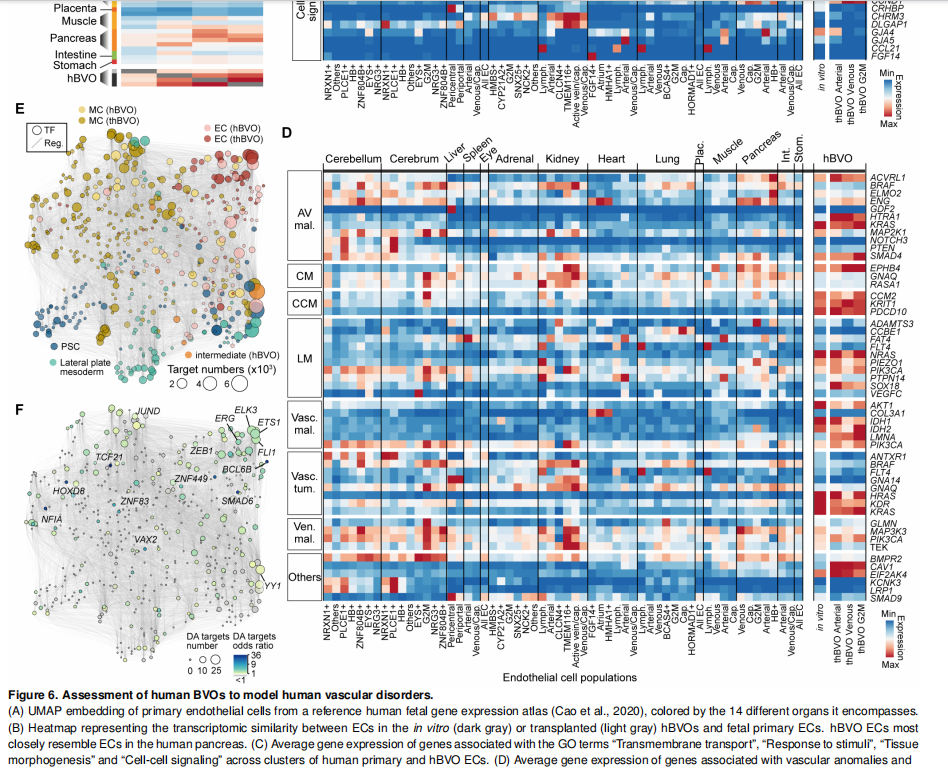
(四) 创 新 展 望
4.1 血管类器官的动态培养与成熟
-
- 提升类器官成熟度:Kirkstall Quasi Vivo系统 能够模拟体内微环境的动态条件,如血流、氧气梯度和营养物质的实时交换,这有望促进hBVO在体外的进一步成熟。通常hBVO在体外培养时未能完全获得明确的动脉-静脉内皮身份,而动态培养条件可能有助于改善这一局限,使类器官在体外就能更接近体内血管的分化和成熟状态。
-
- 增强细胞功能与相互作用:动态系统可以增强内皮细胞和壁细胞之间的相互作用,模拟体内血管的生理功能,如血管收缩和舒张。这种动态培养环境可能使hBVO中的细胞展现出更接近体内的功能特性,例如内皮细胞的屏障功能、壁细胞对血管稳定性的调节作用等,从而为研究血管功能和疾病机制提供更准确的模型。
4.2 多器官芯片系统中的血管网络构建
-
- 构建复杂的血管网络:Kirkstall Quasi Vivo系统允许将多个类器官或不同的组织类型整合在一起,模拟人体不同器官之间的连接和相互作用。结合hBVO,可以构建包含多个血管分支的复杂血管网络,模拟人体内不同器官的血液供应和循环系统,这对于研究器官间的物质交换、药物分布以及疾病传播等具有重要意义。
-
- 研究器官间的相互影响:通过将hBVO与其他器官类器官(如肝脏、肾脏、心脏等)在Kirkstall Quasi Vivo系统中进行共培养,可以研究血管系统与其他器官之间的相互影响。例如,观察血管类器官在不同器官微环境中的适应性变化,以及器官病变对血管系统的影响,从而深入了解多器官疾病的发生发展机制和全身性的病理生理变化。
4.3 疾病建模与药物筛选
-
- 更精准的疾病模型:将携带特定血管疾病基因突变的hBVO置于Kirkstall Quasi Vivo系统的动态环境中,可以更好地模拟疾病发生发展的复杂过程。这种动态疾病模型能够更准确地反映体内疾病的病理生理特征,为研究疾病的分子机制提供更可靠的平台,有助于发现新的疾病标志物和治疗靶点。
-
- 高通量药物筛选:Kirkstall Quasi Vivo系统的微流控设计和模块化结构使其具备高通量筛选的潜力。结合hBVO,可以在该系统中快速测试大量药物对血管类器官的影响,评估药物的疗效和安全性。同时,动态培养条件能够实时监测药物对血管功能的动态影响,为药物研发提供更全面的评估信息,加速血管相关疾病的药物发现进程。
公司主营产品:
Kilby 3D-clinostat 三维旋转仪,
Kilby 微/超重力细胞旋转培养系统,
3D回转重力环境模拟系统,随机定位仪,
类器官芯片摇摆灌注仪,
Kirkstall 类器官串联芯片灌流仿生构建系统