推荐产品
公司新闻/正文
使用人角质形成细胞、成纤维细胞、周细胞和内皮细胞进行血管化和可灌注的皮肤移植的三维生物打印
人阅读 发布时间:2022-05-25 18:12
影响声明
三维打印可用于生成多层带血管化的人体皮肤移植,这可能会克服目前在无血管皮肤替代品中观察到 的移植物存活的限制。在皮肤生物墨水中包含人周细胞似乎可以促进皮肤和表皮的成熟。
引言
他综合了美国由于静脉淤积、糖尿病或压力引 起皮肤溃疡的年发病率估计有700万人吗1并将随之增 加预期寿命不断延长,糖尿病的患病率也在不断增加。易感患者的伤口愈合能力往往受损。不能愈合的皮肤伤口可直接导致残疾,并作为局部和全身感染并发症的门户。2目前的治疗方法包括这两种局部伤口治疗/敷料和植皮。3自体皮肤移植虽然有效,但在收获部位产生新的伤口,这些人的愈合也很差。4,5异体皮肤可以提供伤口闭合,但会引发患者免疫系统的强烈排斥。6组织工程多层皮肤移植物,如阿普利格拉夫™, 是第三种治疗选择。Apligraf是一种工程双层结构,包含含有人角质形成细胞(KCs)的表皮和含有新生儿包皮成纤维细胞(FBs)的真皮。7FDA批准的临床经验和基础是,Apligraf作为一种促进愈合的生长因子的来源。7–9 然而, 它在几周内就下跌了。有趣的是,尽管Apligraf的细胞成分与宿主是异体的,但移植物的丢失似乎并不是对这些细胞的免疫介导的排斥反应,也不会使受体的免疫系统对它们敏感。
值得注意的是,Apligraf和其他已批准的双层皮肤替代品缺乏皮肤血管系统,从而阻止了长期稳定的移植。我们对真皮再细胞化的经验表明,将真皮血管系统设计成双层皮肤替代品将促进这些移植物的稳定整合。10此外,人类血管细胞可以提供促进愈合和组织成熟的血管分泌因子。11,12在过去的十年里,组织工程的一个重大进展是三维生物打印的出现,这是一种针对非生物系统开发的工具的改编,使在多个相关长度尺度上精确制造生物系统成为可能。13–15人类皮肤中存在的皮肤微血管系统和其他三维结构的复杂性,很难通过简单的手工制造方法在体外复制。
生物打印方法,如喷墨、微挤出和激光辅助打印,目前正在探索开发更复杂的合成皮肤模型。16–19 最近,黄等人。使用3D生物打印平台作为工具,以促进汗腺细胞的分化和再生。15作者证明了一种基于明胶和海藻酸盐的支架可以创造一个能够诱导表皮祖细胞分化为汗腺细胞的环境。此外,将基质直接印在小鼠烧伤伤口上,可诱导汗腺再生。20将产生色素的黑素细胞和免疫细胞的结合在印刷的皮肤结构也有报道。21–23其他使用三维生物打印技术的方法已经证明可以在体外成功地生成可灌注的毛细血管样结构。24,25 尽管取得了这些进展,但在体外,具有生理相关维度的功能内皮网络的生成仍存在主要的局限性。据我们所知,据报道的皮肤结构中3D生物打印灌注血管的最小直径为80毫米。26这种大小明显大于皮肤微血管中的毛细血管( 浅表水平丛<26mm , 真皮- 皮下丛<50mm)。27,28我们之前已经证明了使用三维生物打印来制造皮肤等效物的可行性。29然而,这种生物打印的皮肤组织缺乏完全成熟的角质层和有血管化的真皮层。在这项研究中,我们展示了使用人类细胞和3D打印技术制造多层、血管化的皮肤结构,该结构在免疫缺陷小鼠植入后通过移植物和宿主微血管灌注。
材料和方法
细胞分离、培养、表型和调节
根据宾夕法尼亚大学机构审查委员会批准的协议,用新鲜丢弃的人包皮中培养的人皮肤纤维纤维和KCs进行了初步的体外实验。随后的实验使用了根据耶鲁大学机构审查委员会批准的协议,在耶鲁大学获得的新鲜丢弃的人类包皮。根据先前发表的方案,从包皮样本中分离出FBs和KCs。30从真皮获得的FBs和从表皮获得的KCs分别在杜尔贝科改良的鹰培养基(DMEM)中培养,分别添加10% 胎 牛 血 清 ( 亚 特 兰 大 生 物 制 剂 ) 、1%Pen/Strep(Gibco)和KGM金培养基(龙沙)。人内皮细胞(ECs) 从脐带血人内皮集落形成细胞(HECFCs) 在EGM2 培养基(Lonza) 中培养。31 周细胞(PCs)在添加20%胎牛血清和1%Pen/Strep的M199培养基(Gibco)中分离培养。32荧光流式细胞术证实, 培养的真皮FBs均表达PDGFR-a、PDGFR-b和CD90,但不表达NG2(pc的标记物)、CD31(ECs的标记物)或CD45(造血细胞的标记物)。此外,免疫荧光显微镜证实了a-平滑肌肌动蛋白的阳性染色(图1a),提示本研究中使用的培养的真皮FBs显示了肌成纤维细胞样表型。33,34 荧光流式细胞术证实人胎盘pc表达NG2、CD90和PDGFR-b, 但缺乏PDGFR-a、CD31 和CD45( 图。而HECFC 衍生的ECs 表达CD31 , 而不表达CD45( 图1c)。为了在体外实现内皮网络的长期活细胞可视化,根据制造商的说明(基因声典),用表达RFP 的慢病毒转导ECs 。所有细胞均保持在37°C 和5%CO条件下2直到打印。
真皮和表皮生物墨水的制备
真皮和表皮生物墨水是根据前面描述的方案设计的。35. 以人包皮为参考,初步实验优化了KCs和FBs的比例。与人类包皮相比,基底上和基底层厚度没有统计学显著差异的条件被用于生成包含FBs 和KCs的3D结构。与人类包皮相比,基底上和基底层厚度没有统计学显著差异的条件被用于生成包含FBs和KCs的3D结构。在体外,打印构建物的真皮室中PCs和ECs与FBs的比例也进行了优化。我们选择在血管内皮稳定自组装而不退化的条件,以及在体外添加最多数量的PCs而不引起胶原收缩的条件,制造由KCs、FBs、ECs和pc组成的3D打印结构。真皮生物墨水的配方为7.0·105/mL 人类FBs 和,在哪里表示,7.0·105/mL人类ECs,含或不含3.5·105/mL 个人PCs , 悬浮在一种溶液中, 包括2.2mL3.5mg/mL 大鼠尾I 型胶原蛋白( 康宁) ,150mL 胎 牛 血 清 ( 亚 特 兰 大 生 物 制 剂 ) ,290mL10XpH 重 组 缓 冲 液 (0.05M NaOH ,2.2%NaHCO3 , 200mMHEPES) , 290mL10·HAM-F12。
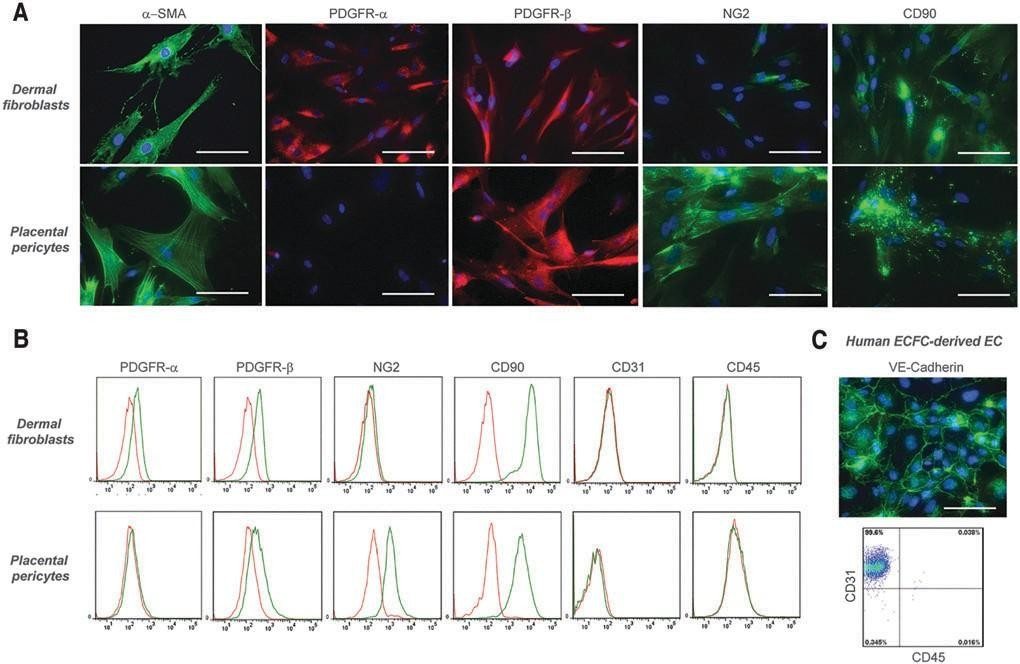
图1. 培养的人皮肤FBs、胎盘PCs和ECFC来源的ECs的免疫特性和表型。
(A) 免疫荧光显微镜证实,真皮FBs表达A-平滑肌肌动蛋白、PDGFR-A、PDGFR-b和CD90,但不表达NG2。胎盘PC的a-平滑肌肌动蛋白、PDGFR-b、NG2和CD90染色阳性,但PDGFR-a染色阴性。(b)真皮FBs的流式细胞术分析证实了PDGFR-a、PDGFR-b和CD90 的表达。此外,这些细胞缺乏NG2、CD31和CD45 的表达。如流式细胞术所证实,PCs显示PDGFR-b、NG2和CD90 的阳性表达,但缺乏PDGFR-a、CD31和CD45的表达。(C) 免疫荧光显微镜下,人ECFC衍生的ECs对VE钙粘蛋白呈阳性染色,流式细胞术分析显示CD31呈阳性表达,但对CD45无阳性表达。流式细胞术的特异性染色显示为绿色;同型匹 配对照染色显示为红色。在来自不同供体的三个独立隔离中观察到类似结果。比例尺:100毫米。FB, 成纤维细胞;周细胞;内皮集落形成细胞。彩色图像可在网上获得。
表皮生物墨水的配方为2·106/mL人KCs在500mL的1:1KGM和皮肤分化培养基中[DMEM/HAM的F-12( 3 : 1 ) 添加10% 胎牛血清, 0.1nM 霍乱毒素(Sigma), 5mg/mL胰岛素(Sigma), 5mg/mL载脂蛋白 转 铁 蛋 白 (Sigma) , 0.4mg/mL 氢 化 可 的 松 – 21(Sigma)和0.5ng/mL表皮生长因子(Peprotech)]。
皮 肤 等 效 物 的 三 维 生 物 打 印
利用先前描述的打印平台进行了改善表皮分化的初步实验。36,37皮肤结构是通过打印含有FBs的冷(4°C)真皮生物墨水(从3mL注射器分配),分辨率为300毫米,气压为6psi,在3毫米孔径的6孔PET插入物上生成的。 在 37°C 下真皮层胶化后, 以300mm的分辨率和2.5psi的500mL打印含有KCs的表皮生物墨水。打印后,1mL的表皮生物墨水没有KCs被添加到6孔Transwell插入物的底部腔室中。在37°C下孵育24小时后,移除Transwell插入物顶部和底部的培养基,改为100%皮肤分化培养基, 如前所述。在介质浸泡4天后,将含有皮肤等效物的Transwell插入物小心地转移到气液界面(ALI), 放置在猎鹰中的100mm孔细胞过滤器上®六井深井板(康宁)。取出顶部的培养基,在细胞滤器底部加入9mL皮肤分化培养基,制作确保没有气泡被困在特兰斯韦尔插入物下面。细胞滤清器下面的培养基每3天更换一次,连续2周。
血管化的皮肤移植是使用市售的生物打印机
(细胞墨水)制作的。一种可更换的打印头,包括一个无菌的 30 号不锈钢钝针头( 内部: 0.15mm,外部:0.31毫米;在50kPa的4°C挤压压力下打印皮肤生物墨水205 秒.生物打印构建物浸在EGM2培养基4天,每天更换培养基,使内皮网络自我组装。第4天,无菌32号不锈钢钝针(内部: 0.10mm , 外部: 0.24 毫米; 在35kPa 的挤压压力下,使用墨水打印表皮生物墨水54s。24小时后,将打印出来的培养物浸泡在100%的皮肤培养基中,再浸泡4天,随后在小鼠身上缝合。
生物打印移植物的形态学特征
为了优化最小化真皮和表皮隔间混合的条件, 根据制造商的说明,根据制造商的说明,分别用™ 红色CMPTX和绿色CMFDA染料对70%的真皮FBs和KCs进行荧光标记。打印后3天,在尼康EclipseTi-E 倒置荧光显微镜(尼康仪器)上使用电动平台进行成像,并获得多个z-堆栈图像,以评估打印构建物中FBs和KCs的空间分布。图像用nis-elents软件(尼康仪器)进行处理,生成每个样本的三维投影。
冷冻切片(7mm)通过H&E、免疫荧光和免疫组化染色进行分析。为了进行免疫荧光分析,组织切片在冷丙酮中浸泡10min,然后用10%正常山羊血清PBS或10%驴血清封闭1小时。然后在4°C潮湿的室内孵育过夜,与抗细胞角蛋白10(兔,1:200, 克隆EP1607IHCY ; Abcam) 、细胞角蛋白14 ( 小鼠, 1 : 200 , 克隆LL002 ; Abcam )、聚丝蛋白(小鼠,1:200,克隆FLG/1561;Abcam)、胶原蛋白(小鼠;1:200,克隆COL-94;Abcam)、层粘连蛋白5 、兔, 1 :200 ,克隆SP6)、人类CD31(小鼠,1:200,小鼠F4/80(大鼠,1:50,克隆BM8;生物科学™),荧光素凝集素I分离素B4(gsl- ib4;1:200;载体实验室),或荧光素真核杆菌凝集素I(UEA-1;1:200;载体实验室)。然后用PBS ( 3· ) 清洗载玻片, 与抗小鼠或抗兔Fluor™488 或AlexaFlaFluor™48Fluor568( 山羊, 1 : 500;H&L二抗在室温下孵育1小时。载玻片用含有DAPI(矢量实验室)的载体抗褪色安装介质进行核染色, 并在尼康EclipseTi-E倒置荧光显微镜(尼康仪器)上成像。免疫组化分析采用以下生物素-sp亲和力纯IgG(H+L)抗体:驴抗兔IgG(H+L), 驴抗小鼠IgG(H+L),山羊抗大鼠。二抗的底物包含在载体染色的ABC过氧化物酶试剂盒和AEC过氧化物酶底物试剂盒中
SCID/bg小鼠有血管化的皮肤
所有程序都按照耶鲁大学动物护理和使用委员会批准的协议进行。在无菌条件下,将打印的皮肤结构移植到6-12周龄女性的侧面C.B-17SCID/bg 小鼠(Taconic 农场, 日耳曼敦, 纽约),腹腔注射氯胺 tong/噻嗪麻醉。从动物背侧切除小鼠皮肤(直径*2),在伤口上放置一块相当大小的打印皮肤,用6-0Prolene缝合线缝合。然后用两层凡士林纱布覆盖,预涂白曲肽乳膏,一层泰加德姆, 两层覆盖伤口大小的绷带, 最后用Coban3M胶带包裹。植入后10天去除绷带。
尾静脉注射荧光素UEA-I评价体内灌注
荧光素UEAI(载体实验室)与盐盐水以1:1的比例稀释。每只小鼠通过尾静脉注射200微升,并在收获移植物前循环30min。对小鼠实施安乐 si, 收获移植物并切成两半:一半用10%缓冲福尔马林固定过夜进行石蜡包埋;另一半用OCT包埋,冷冻,冷冻切片(7mm厚)。
结果
生物打印皮肤移植物的不同表皮/真皮隔室的 产生和特征
为了能够打印多层3D皮肤结构,我们之前使用了NaHCO雾化交联胶原蛋白。29在这个模型中, 依次沉积了8层胶原蛋白前体。在每一层胶原蛋白和FBs之间,雾化NaHCO3作为交联剂应用。我们测试了这种凝胶化方法,以制造一种由人原代细胞组成的带血管化的皮肤移植物,并将雾化时间从5 秒到10秒不等。然而,雾化并不能促进FBs在真皮内的均匀分布,并支持KC的分化(图。2A).当胶原层雾化5s时,真皮FBs沉积在Transwell插入物的底部,而雾化10s产生条纹状图案,FBs层之间有明显的分离。
与这些观察结果一致的是,第20天打印结构的组织学分析显示,胶原层雾化5s时,在Transwell 插入膜附近聚集,而雾化10s导致胶原和FBs层的空间分离。两种情况下都没有或表皮分化差。为了解决这个问题,我们开发了一种胶原联方法, 在打印前将细胞与pH重组缓冲液混合,随后孵育皮肤分化培养基中的37°C(图2B)。
从第4天开始,在ALI处培养打印出来的皮肤结构物。在第30天,这些生物打印结构显示真皮内FBs 的分布显著改善,随后打印的表皮室的形态得到改善(图2C),聚丝蛋白(角质层的标记物)、CK14(基底层的标记物)、CK10(基上层的标记物) 和IV型胶原( 基底膜的标记物) 的表皮染色阳性,类似于人类皮肤。此外,所产生的上皮细胞有组织良好的立方体基底细胞粘附在基底膜上, 这表明了一个成熟的皮肤组织的发育。
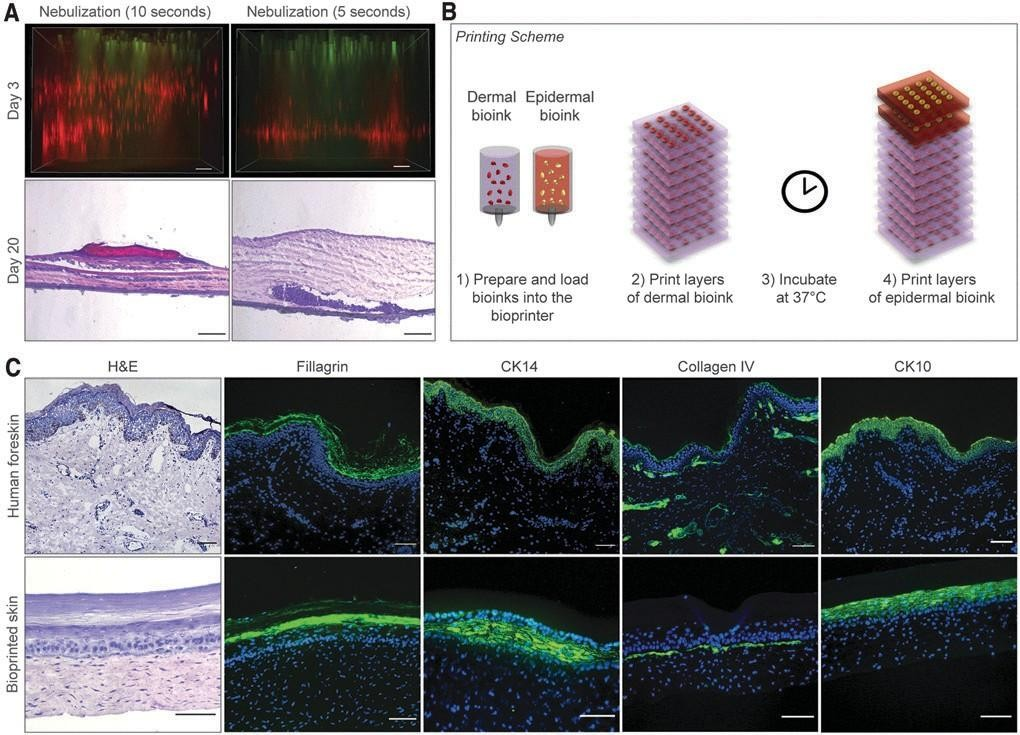
图2 .生物打印皮肤构建物的皮肤/表皮隔间的优化、成熟和表征,体外。
(A)评价雾化NaHCO3的影响.作为一种胶原交联剂,在3D生物打印构建物中,皮肤FBs的分布和KCs的分 化。顶部图像显示为打印结构在第3天的z-堆栈荧光图像的最大投影。FBs和KCs用细胞追踪器进行荧光 标记™红色CMPTX和细胞追踪器绿色CMFDA染料。底部图像显示打印后20天的生物打印结构的H&E染色 显示,当胶原层被雾化时,FBs的分布不均匀。比例尺:100mm。(B)示意图显示了人体皮肤等效物的 分层生物打印。(C)在体外成熟30天后,人包皮和生物打印构建物的H&E和免疫荧光染色的代表性图 像。打印的移植物显示聚丝蛋白、细胞角蛋白14、细胞角蛋白10和IV型胶原的阳性表达,与人包皮相 似。细胞核用DAPI染色(蓝色)。比例尺:100um。KC、角质形成细胞。彩色图像可以在网上找到。
人内皮细胞和胎盘周细胞掺入3D生物打印皮肤移植物的真皮腔室
我们评估了HECFC来源的内皮细胞在生物打印皮肤移植物的真皮腔室中产生血管样结构的能力。我们首先评估了皮肤分化培养基在体外诱导和/或维持内皮网络的能力(图3A)。在皮肤分化培养基中培养的构建物的活体成像分析显示,在培养4天期间没有显示内皮网络的形成(图3B,方案A)。相比之下,EGM2培养基支持血管自组装,但在第4天后不需要(图3B,方案B)。
第10 天皮肤介质的Z-stack共聚焦成像显示开放腔的3D内皮网络(图3C),,分泌IV型胶原,这是基底膜的主要成分毛细血管内皮,并被致密的胶原纤维包围(补充影片S1)。重要的是,在随后的皮肤分化培养基中培养的50天内,没有观察到血管消退的迹象(图。3D). PCs在体内和体外都能稳定微血管。32,38因此, 我们将PCs加入到皮肤生物墨水中。生物打印后7 天,人类PCs与ECs内衬的血管直接相关,而FBs仍然随机分布在基质中(图。3C).为了生成用于植入的血管化双层皮肤结构,真皮和表皮腔室分两个阶段打印。首先,用人ECs和FBs生物打印有血管化的真皮腔室,并在EGM2中培养4天,以促进血管自组装。第二,在第4天将含有KCs的表皮腔室进行生物打印,并在皮肤分化培养基中培养,直到移植,不暴露于ALI(图4A)。这种两步的方法允许在真皮和表皮的内皮网络的自组装232

图. 3.评估培养条件,允许内皮网络组装。
培养条件测试的时间线:表达RFP的ECs与皮肤FBs共培养,在皮肤培养基中培养4天(方案A);或EGM2培养4天,随后在皮肤培养基中培养,直到体外培养的第37天(方案B)。(B)活细胞荧光显微镜观察 用方案A培养的生物打印真皮结构,显示没有EC网络的形成,而方案B促进了EC网络的自组装和长期维 护。比例尺:100mm。第10天,体外皮肤培养基中自组装内皮网络的(C)三维重建。比例尺:50毫米。 网格定义了三维空间。(D)打印样本随访50天,以评估内皮网络在皮肤培养基中的长期稳定性和活力。 活细胞用钙黄绿素(绿色)染色,细胞核用Hoechst(蓝色)染色。(E)打印后7天,表达RFP的ECs、cy5- 真皮FBs和表达GFP的PCs共培养的实时成像。比例尺:100um。彩色图像可以在网上找到。
角质化第10天对含有ECs的皮肤移植物的免疫组化分析显示存在人CD31+真皮内的血管状结构(图。4B).正如预期的那样,没有人ECs的生物打印移植物没有对人CD31进行染色+细胞与人类皮肤相似,所有生物打印的皮肤移植物都显示出表皮基底层Ki67和CK14阳性表达,提示基底KCs正常增殖。有趣的是,在这个实验中, 植皮的真皮中PCs的存在显著增加了表皮的厚度和成熟。特别是,含有人PCs的皮肤移植物显示出表皮基底膜的主要成分层粘连蛋白5的表达增加,以及CK10的存在+基上末端分化组织良好的CK14以上的KC+立方基底KCs。
三维生物打印皮肤移植到免疫缺陷小鼠上的特性分析
在体外培养8天后,将加入和不加入人ec和pc的 生物打印皮肤移植物植入免疫缺陷小鼠的背侧(图。5A).在一项试点实验中,植入14天的生物打印皮肤移植物显示出高度的出血和炎症,与含有人类血管细胞的移植物相比,特别是在非血管化的生物打印移植物中(图。5B).皮肤亚态用人ECs和PCs组成的管状细胞在植入后2周包含血管结构,细胞角蛋白10和14的表达显示出更高程度的表皮组织,以及早期网脊的形成。
移植后30天,通过总蛋白染色评估人表皮的来源,总蛋白染色是人KCs终末分化的标志(图。6A). 免疫组化分析证实,生物打印的血管化皮肤移植物的表皮是由人KCs形成的。此外,在没有ec的生物打印移植物中观察到明显的收缩。第30天生物打印移植物的组织学分析证实,与带血管化的皮肤相比,没有EC的生物打印移植物明显更小,小鼠皮肤占据的面积明显更大(图 6B).与预期的一样,在不包括人EC的移植物中未检测到人ECs(图。6C).人EC在植入后4周包含血管结构。部分微血管用GSL-B染色的小鼠内皮细胞排列4,提示宿主血管生成。然而,许多远离伤口床的血管内排列有人ECs(图6c)。在移植标记的人ECs前30min通过尾静脉注射荧光UEA-1,确认这些血管的灌注。含有PCs 的生物打印移植物显示了人CD31+许多被CD31阴性细胞包围的血管。

图4.移植前的3D生物打印的血管化皮肤等效物的特征。(A)制造人体血管化皮肤等量物的2阶段方案的时 间轴。首先,对在EGM2中培养4天的带血管化的真皮室进行生物打印,其次,对表皮室进行生物打 印,并在皮肤培养基中培养。在第8天,生物打印的构建物被鉴定或植入到免疫缺陷小鼠模型上。(B在移植时,人类成人皮肤和生物打印构建物的H&E和免疫荧光染色的代表性图像。含有ec的生物打印皮肤移植物显示人CD31+血管样结构,而没有人ECs的生物打印移植物则没有。生物打印的皮肤移植物显示表皮基底层Ki67和CK14阳性表达。含有人PCs的皮肤移植物显示层粘连蛋白5和CK10的表达增加+基底上末端分化的KCs。细胞核用DAPI染色(蓝色)。比例尺:50um。彩色图像可以在网上找到。
在有血管化的皮肤移植物中,特别是在含有PCs 的移植物中,可以观察到成熟的层状表皮和网状脊状结构的形成。在所有的移植物中,也可以观察到在表皮-真皮交界处的层粘连蛋白5的表达。有趣的是,除了ECs外,含有PCs的移植物似乎能引起更广泛的血管生成宿主反应。所有移植物在伤口床和移植皮肤表皮的真皮和基底层均有表达F4/80的小鼠巨噬细胞浸润。相比之下,缺乏ECs 的移植物浸润更强烈。与14天的外植体相比,相关的炎症减少,提示消退。
讨论
在目前可用的双层皮肤中缺乏血管床限制了它们作为非愈合皮肤溃疡的永 jiu治疗的能力。在这项研究中,我们在3D生物打印皮肤移植物的真皮层中加入了一个由人类ECs自组装的血管床,有或没有人类PCs。
图 5.移植时和移植后2周在免疫缺陷小鼠上的特征。(A)移植时加入和不合并ECs和;PCs的生物打印移植物的照片。(B)的代表性图像移植后2周,生物打印构建物的H&E和免疫荧光染色。H&E染色显 示,与含ECs的移植物相比,无血管化的生物打印皮肤移植物的出血程度更高。UEA-1染色显示存在人ec内衬的血管。网状脊的形成尤其是在含PCs的带血管化的生物打印移植物。比例尺:50um。彩色图像可以在网上找到。
过去使用3D生物打印技术的方法已经通过在体外预构建与ECs内衬的通道来生成毛细血管样网络。24,25我们使用了另一种方法,专注于ECs的自组装,在移植前产生前血管化的真皮隔室。虽然模式形成策略具有易于连接到流动系统的优点, 但血管模式形成通常是通过非生理设计来实现的,而且较小的血管直径很难产生和灌注。26,39相反,当ECs被允许自组装成微血管时,它们形成复杂的形态,其模式类似于自然组织,管腔直径类似于自然微血管。40,41此外,我们能够证明我们的方法克服了与体外血管回归和体内灌注相关的局限性。26,42 具体来说,FBs和PCs的掺入减轻了植入前的血管退化, 血管在体内以血管分泌的方式灌注(通过宿主血管侵犯证明)和通过吻合(通过预注射Ulex染色证明)。据我们所知,3D生物打印皮肤移植物的生成和植入,包括血管化的真皮和人表皮。最近,Kim等人。使用了一种来自猪皮肤衍生的脱细胞外细胞外的生物墨水通过挤压和喷墨打印模块,利用Lar基质(dECM)对免疫缺陷小鼠进行生物打印,形成有血管化的皮肤贴片。43将人脂肪来源的间充质干细胞(ASC)和HECFC来源的ec装载入dECM生物墨水中,生成直径1cm、厚度1mm的皮肤贴片。在ASC+EC-dECM封装的生物打印贴片中,由于dECM的快速降解,伤口被加速闭合;通过招募宿主细胞观察到宿主新生血管和再上皮化。14天后,宿主几乎完全形成再上皮细胞(*初始间隙长度的90%)。然而,在生物打印皮肤贴片的真皮内存在灌注的人ECs内衬血管没有报道。
限制我们之前努力的一个问题是控制皮肤生物墨水中I型胶原的凝胶化。29我们通过在打印前混合pH重组缓冲液,而不是用NaHCO3雾化,改善了真皮FBs在生物打印真皮中的分布,它以前被用于胶原蛋白交联。29然而,在这些打印条件下,将胶原前体与pH重组缓冲液混合会引发快速交联,增加粘度和凝胶化,并可能堵塞打印组件。我们通过将皮肤生物墨水保持在4°C来解决这个问题,这是用Cellink BIOX生物打印机与一个可互换的冷却打印头,这是对于制造具有一致和高通量生物打印皮肤移植物非常重要。
我们发现,一段体外成熟的时间对于产生与在人类皮肤中观察到的组织组织程度相当的皮肤水平至关重要。皮肤基底膜对表皮的完整性和功能很重要,包括渗透性屏障,形成真皮和表皮之间的粘附界面,并控制细胞的组织和分化。44–46暴露于ALI和成熟所需的培养条件通常被用来诱导皮肤等价物的表皮分化,47,48这些方法也在这里被使用过。例如,在ALI下培养26天的生物打印皮肤构建物显示了表皮分层标记物(CK14、CK10和聚丝蛋白),以及基底膜胶原IV的阳性表达,表明了成熟的人类皮肤发育。然而,当我们试图在体外成熟的生物打印血管化移植物时,ALI培养导致血管退化和自组装内皮网络的崩溃。
我们认为,ALI引起的显著失水对微血管的自组装有不利影响结构为了克服这一问题,我们采用了一种采用两步法治疗拟植入的皮肤结构的方法。这种两步方法在真皮产生开放腔的血管以及表皮基底KCs的分化。虽然这种方法可能会限制血管化生物打印构建物在体外疾病建模中的使用,但我们认为它是一种生产用于植入和体内成熟的构建物的优越方法。
当生物打印的移植物被植入免疫缺陷小鼠身上时,生物打印的带血管化的皮肤移植物被灌注。移植后2周和4周出现人ECs内衬的微血管。此外, 我们观察到宿主微血管快速侵入移植物,特别是在含有ec外的pc的移植物中,这可能解释了非血管化和血管化的生物打印移植物移植物的高存活率。与这些观察结果一致的是,一些研究已经描述了pc通过分泌生长因子,如肝细胞生长因子,49,50和基质金属蛋白酶,允许EC迁移。51我们的数据表明,在工程移植物中加入PCs可能会提高移植物的存活率。

6.移植后4周的3D生物打印皮肤等效物的特征。(A)对放置在伤口边缘的人总苞蛋白进行免疫组化染色,显示3D生物打印的血管化皮肤的表皮来自人类。比例尺:50mm。(B)生物打印移植物的代表性H&E图像显示了收缩的程度。没有ec和pc的生物打印移植物明显更小,小鼠皮肤占据的面积更大。生 物打印移植物和小鼠皮肤之间的边界通过薄表皮、毛囊和深层真皮和脂肪组织来确定。比例尺: 1mm。含有人ec的(C)替代品在植入后4周含有血管结构。通过GSL-B染色检测小鼠微血管的存在和小鼠 巨噬细胞的浸润情况4和分别为F4/80抗体。为了证明人ec内衬的血管被灌注,在外植体前30min注射荧 光UEA-1。箭头指向人工灌注的人工血管。带血管化的生物打印移植物显示了网状脊状结构的形成,特 别是在含有pc的生物打印移植物中。比例尺:100mm。彩色图像可以在网上找到。
有趣的是,我们发现在皮肤生物墨水中包含PCs也改善了移植4周后KC的成熟和表皮网的形成。这 References一观察结果与之前的报道一致,即真皮PCs可以增强FBs对上皮细胞再生的旁分泌作用。52更具体地说,含有PCs的器官型培养显示表皮增厚,基底层内细胞高度极化组织和更有序的基上分层。在器官型培养中, 加入真皮PCs 增强了层粘连蛋白- 511/521 在真皮- 表皮交界处的沉积和BMP-2 的表达, 从而赋予了细胞极性和基底细胞分裂的数量。53我们需要进一步研究PCs调控表皮成熟和宿主血管生成的外部线索。
皮肤组织替代的一个潜在瓶颈是产生皮肤等量物所需的大量细胞,因为它们只能直接从人体活检中少量获得。此外,从受体自身的皮肤中获得这种细胞可能是不切实际的,特别是在受体床受损的患者(例如,糖尿病、热烧伤或腿部静脉溃疡)或血管生成受损的宿主中。54–56在本研究中,我们发现HECFC来源的内皮细胞可用于促进生物打印皮肤移植物的血管化和灌注。这些可以很容易地从脐带血或成人外周血中分离出来,57,58避免皮肤收获。HECFC衍生的ECs可以扩展到至少100倍,59允许产生更大尺寸的移植物。此外,这些ECs可以被克隆,允许基因修饰后的选择。这一特性可能很重要,因为除了促进移植物灌注, 人ECs还可以通过直接将非自身I类和II类HLA蛋白呈现给循环异反应效应记忆T细胞来启动免疫介导的排斥反应。这一人群一致存在于成人外周血中,并与临床同种异体移植物的早期排斥反应和通过过继移植引入的免疫缺陷小鼠的人类皮肤排斥反应相关。60相比之下,Apligraf,一种获得FDA批准的无血管双层皮肤等效物,由于它缺乏专业的抗原呈递细胞和ec,可能不会引起急性排斥反应。61–63虽然含有未经修饰的人ec的移植物具有同种免疫原性, 但这一特性可以通过CRISPR/Cas9 介导的HLA抗原表达的缺失从HECFC来源的ECs中消除。64–66我们预计,通过植入不引发异反应的3D生物打印人皮肤移植将具有巨大的临床效用,并为创造“现成的” 临床产品奠定基础。
结论
皮肤的多层和分层结构使其成为一个可以使用三维生物打印技术制作的原型组织。在这项研究中,我们证明了3D生物打印可以用于在体外从形态和生物学上与人类皮肤相似的人类细胞中制造有血管化的人类皮肤。总之, 我们展示了利用HECFC衍生的PCs和胎盘PCs生成包含可灌注微血管系统的植入式皮肤移植物的潜力。
1. Singer, A.J., and Clark, R.A.F. Cutaneous wound healing. N Engl J Med 341, 738, 1999.
2. Falanga, V. Wound healing and its impairment in the dia- betic foot. Lancet 366, 1736, 2005.
3. Harding, K.G., Morris, H.L., and Patel, G.K. Healing chronic wounds. BMJ 324, 160, 2002.
4. Falanga, V. The chronic wound: impaired healing and so- lutions in the context of wound bed preparation. Blood Cells Mol Dis 32, 88, 2004.
5. Guo, S., and Dipietro, L.A. Factors affecting wound heal- ing. J Dent Res 89, 219, 2010.
6. Alrubaiy, L., and Kathem, K. Al-Rubaiy & Alrubaiy. Skin Substitutes: a Brief Review of Types and Clinical Appli- cations. Oman Med J 24, 6, 2009.
7. Griffiths, M., Ojeh, N., Livingstone, R., Price, R., and Navsaria, H. Survival of Apligraf in acute human wounds. Tissue Eng 10, 1180, 2004.
8. Zelen, C.M., Gould, L., Serena, T.E., et al. A prospective, randomised, controlled, multi-centre comparative effec- tiveness study of healing using dehydrated human amnion/ chorion membrane allograft, bioengineered skin substitute or standard of care for treatment of chronic lower extremity diabetic ul. Int Wound J 12, 724, 2015.
9. Zaulyanov, L., and Kirsner, R.S. A review of a bi-layered living cell treatment (Apligraf) in the treatment of venous leg ulcers and diabetic foot ulcers. Clin Interv Aging 2, 93, 2007.
10. Shepherd, B.R., Enis, D.R., Wang, F., et al. Vascularization and engraftment of a human skin substitute using circu- lating progenitor cell-derived endothelial cells. FASEB J20, 1739, 2006.
“11. Tonnesen, M.G., Feng, X., and Clark, R.A.F. Angiogenesis in the pathogenesis of skin aging. Tissue Eng Part A 21, 2417,”
wound healing. J Invest Dermatol Symp Proc 5, 40, 2000.
12. Dulmovits, B.M., and Herman, I.M. Microvascular remod- eling and wound healing: a role for pericytes. Int J Biochem Cell Biol 44, 1800, 2012.
13. Munoz-Abraham, A.S., Rodriguez-Davalos, M.I., Bertacco A., et al. 3D Printing of organs for transplantation: where are we and where are we heading? Curr Transplant Rep 3, 93, 2016.
14. Lee, H., and Cho, D.-W. One-step fabrication of an organ- on-a-chip with spatial heterogeneity using a 3D bioprinting technology. Lab Chip 16, 2618, 2016.
15. Huang, S., Yao, B., Xie, J., and Fu, X. 3D bioprinted ex- tracellular matrix mimics facilitate directed differentiation of epithelial progenitors for sweat gland regeneration. Acta Biomater 32, 170, 2016.
16. Ng, W.L., Chua, C.K., and Shen, Y.-F. Print Me An Organ! Why We Are Not There Yet. Prog Polym Sci 97, 101145, 2019.
17. Derr, K., Zou, J., Luo, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated mor- phology and barrier function. Tissue Eng Part C Methods 25, 334, 2019.
18. Pourchet, L.J., Thepot, A., Albouy, M., et al. Human skin 3D bioprinting using scaffold-free approach. Adv Health- care Mater 6, 1601101, 2016.
19. Cubo, N., Garcia, M., Del Canizo, J.F., et al. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication 9, 15006, 2016.
20. Liu, N., Huang, S., Yao, B., et al. 3D bioprinting matrices with controlled pore structure and release function guide in vitro self-organization of sweat gland. Sci Rep 6, 34410, 2016.
21. Ng, W.L., Qi, J.T.Z., Yeong, W.Y., and Naing, M.W. Proof- of-concept: 3D bioprinting of pigmented human skin constructs. Biofabrication 10, 25005, 2018.
22. Min, D., Lee, W., Bae, I., et al. Bioprinting of biomimetic skin containing melanocytes. Exp Dermatol 27, 453, 2018.
23. Vidal Yucha, S.E., Tamamoto, K.A., Nguyen, H., Cairns, D.M., and Kaplan, D.L. Human skin equivalents demon- strate need for neuro-immuno-cutaneous system. Adv Biosyst 3, 1800283, 2019.
24. Hoch, E., Tovar, G.E.M., and Borchers, K. Bioprinting of artificial blood vessels: current approaches towards a de- manding goal. Eur J Cardiothorac Surg 46, 767, 2014.
25. Frueh, F.S., Menger, M.D., Lindenblatt, N., Giovanoli, P., and Laschke, M.W. Current and emerging vascularization strategies in skin tissue engineering. Crit Rev Biotechnol 8551, 1, 2016.
26. Abaci, H.E., Guo, Z., Coffman, A., et al. Human skin constructs with spatially controlled vasculature using pri- mary and iPSC derived endothelial cells. Adv Healthcare Mater 5, 1800, 2016.
27. Braverman, I.M., and Keh-Yen, A. Ultrastructure of the human dermal microcirculation. III. The vessels in the mid- and lower dermis and subcutaneous fat. J Invest Dermatol 77, 297, 1981.
28. Braverman, I.M., and Sibley, J. Ultrastructural and three- dimensional analysis of the contractile cells of the cuta- neous microvasculature. J Invest Dermatol 95, 90, 1990.
29. Lee, V., Singh, G., Trasatti, J.P., et al. Design and fabri- cation of human skin by three-dimensional bioprinting. Tissue Eng Part C Methods 20, 473, 2014.
30. Pennacchi, P.C., de Almeida, M.E.S., Gomes, O.L.A., et al.
2015
31. Suarez, Y., Shepherd, B.R., Rao, D.A., and Pober, J.S. Alloimmunity to human endothelial cells derived from cord blood progenitors. J Immunol 179, 7488, 2007.
32. Maier, C.L., Shepherd, B.R., Yi, T., and Pober, J.S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation 17, 367, 2010.
33. Li, R., Bernau, K., Sandbo, N., et al. Pdgfra marks a cel- lular lineage with distinct contributions to myofibroblasts in lung maturation and injury response. Elife 7, 2018.
34. Chen, Y.-T., Chang, F.-C., Wu, C.-F., et al. Platelet-derived growth factor receptor signaling activates pericyte- myofibroblast transition in obstructive and post-ischemic kidney fibrosis. Kidney Int 80, 1170, 2011.
35. Brohem, C.A., da Silva Cardeal, L.B., Tiago, M., et al. Artificial skin in perspective: concepts and applications. Pigment Cell Melanoma Res 24, 35, 2010.
36. Lee, W., Debasitis, J.C., Lee, V.K., et al. Multi-layered culture of human skin fibroblasts and keratinocytes through three-dimensional freeform fabrication. Biomaterials 30, 1587, 2009.
37. Lee, V.K., Kim, D.Y., Ngo, H., et al. Creating perfused functional vascular channels using 3D bio-printing tech- nology. Biomaterials 35, 8092, 2014.
38. Shepherd, B.R., Jay, S.M., Saltzman, W.M., Tellides, G., and Pober, J.S. Human aortic smooth muscle cells promote arteriole formation by coengrafted endothelial cells. Tissue Eng Part A 15, 165, 2009.
39. Hasenberg, T., Mu¨ hleder, S., Dotzler, A., et al. Emulating human microcapillaries in a multi-organ-chip platform. J Biotechnol 216, 1, 2015.
40. Montan˜o, I., Schiestl, C., Schneider, J., et al. Formation of human capillaries in vitro: the engineering of pre- vascularized matrices. Tissue Eng Part A 16, 269, 2010.
41. Marino, D., Luginbu¨hl, J., Scola, S., Meuli, M., and Reichmann, E. Bioengineering dermo-epidermal skin grafts with blood and lymphatic capillaries. Sci Transl Med 6, 221ra14, 2014.
42. Kim, B.S., Gao, G., Kim, J.Y., and Cho, D.-W. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Adv Healthcare Mater 8, e1801019, 2019.
43. Kim, B.S., Kwon, Y.W., Kong, J.-S., et al. 3D cell printing of in vitro stabilized skin model and in vivo pre- vascularized skin patch using tissue-specific extracellular matrix bioink: a step towards advanced skin tissue engi- neering. Biomaterials 168, 38, 2018.
44. Yurchenco, P.D., and Schittny, J.C. Molecular architecture of basement membranes. FASEB J 4, 1577, 1990.
45. Breitkreutz, D., Koxholt, I., Thiemann, K., and Nischt, R. Skin basement membrane: the foundation of epidermal integrity—BM functions and diverse roles of bridging molecules nidogen and perlecan. Biomed Res Int 2013, 179784, 2013.
46. Jayadev, R., and Sherwood, D.R. Basement membranes. Curr Biol 27, R207–R211, 2017.
47. Frankart, A., Malaisse, J., De Vuyst, E., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruc- tion at the air-liquid interface. Exp Dermatol 21, 871, 2012.
48. Prunie´ras, M., Re´gnier, M., Woodley, D., et al. Methods for cultivation of keratinocytes with an air-liquid interface. J Invest Dermatol 81, 28s, 1983.238
49. Chang, W.G., Andrejecsk, J.W., Kluger, M.S., Saltzman, W.M., and Pober, J.S. Pericytes modulate endothelial sprouting. Cardiovasc Res 100, 492, 2013.
50. Eilken, H.M., Die´guez-Hurtado, R., Schmidt, I., et al. Pericytes regulate VEGF-induced endothelial sprouting through VEGFR1. Nat Commun 8, 1574, 2017.
51. Stapor, P.C., Sweat, R.S., Dashti, D.C., Betancourt, A.M., and Murfee, W.L. Pericyte dynamics during angiogenesis: new insights from new identities. J Vasc Res 51, 163, 2014.
52. Paquet-Fifield, S., Schlu¨ter, H., Li, A., et al. A role for pericytes as microenvironmental regulators of human skin tissue regeneration. J Clin Invest 119, 2795, 2009.
53. Zhuang, L., Lawlor, K.T., Schlueter, H., et al. Pericytes promote skin regeneration by inducing epidermal cell po- larity and planar cell divisions. Life Sci Alliance 1, e201700009, 2018.
54. Alzahrani, H., Ammar, H., Alzahrani, A., and Shoaib, H. Healing of chronic diabetic foot ulcers with a skin substi- tute: patient selection is the key to success. Open J Regen Med 02, 15, 2013.
55. Tahergorabi, Z., and Khazaei, M. Imbalance of angiogen- esis in diabetic complications: the mechanisms. Int J Prev Med 3, 827, 2012.
56. Zhang, X., Sarkar, K., Rey, S., et al. Aging impairs the mobilization and homing of bone marrow-derived angio- genic cells to burn wounds. J Mol Med 89, 985, 2011.
57. Asahara, T., Murohara, T., Sullivan, A., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Sci- ence (80-.) 275, 964, 1997.
58. Bompais, H., Chagraoui, J., Canron, X., et al. Human en- dothelial cells derived from circulating progenitors display specific functional properties compared with mature vessel wall endothelial cells. Blood 103, 2577, 2004.
59. Ingram, D.A., Mead, L.E., Tanaka, H., et al. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood. Blood 104, 2752, 2004.
60. Al-Lamki, R.S., Bradley, J.R., and Pober, J.S. Endothelial cells in allograft rejection. Transplantation 86, 1340, 2008.
61. Briscoe, D.M., Alexander, S.I., and Lichtman, A.H. Inter- actions between T lymphocytes and endothelial cells in allograft rejection. Curr Opin Immunol 10, 525, 1998.
62. Briscoe, D.M., Dharnidharka, V.R., Isaacs, C., et al. The allogeneic response to cultured human skin equivalent in the hu-PBL-SCID mouse model of skin rejection. Trans- plantation 67, 1590, 1999.
63. Dharnidharka, V., Briscoe, D., Isaacs, C., et al. Are pro- fessional antigen presenting cells, (APCS) Necessary to Initiate Graft Rejection? Transplantation 65, 770, 1998.
64. Abrahimi, P., Qin, L., Chang, W.G., et al. Blocking MHC class II on human endothelium mitigates acute rejection. JCI Insight 1, 1, 2016.
65. Abrahimi, P., Chang, W.G., Kluger, M.S., et al. Efficient gene disruption in cultured primary human endothelial cells by CRISPR/Cas9. Circ Res 117, 121, 2015.
66. Merola, J., Reschke, M., Pierce, R.W., et al. Progenitor- derived human endothelial cells evade alloimmunity by CRISPR/Cas9-mediated complete ablation of MHC ex- pression. JCI Insight 4, pii: 129739, 2019.