推荐产品
技术资料/正文
魅罗科技(MeloPEG)水凝胶微针:融合高生物相容性与智能控释的经皮给药平台
307 人阅读发布时间:2025-10-23 09:59
一、前言:微针技术的出现,重新定义经皮给药
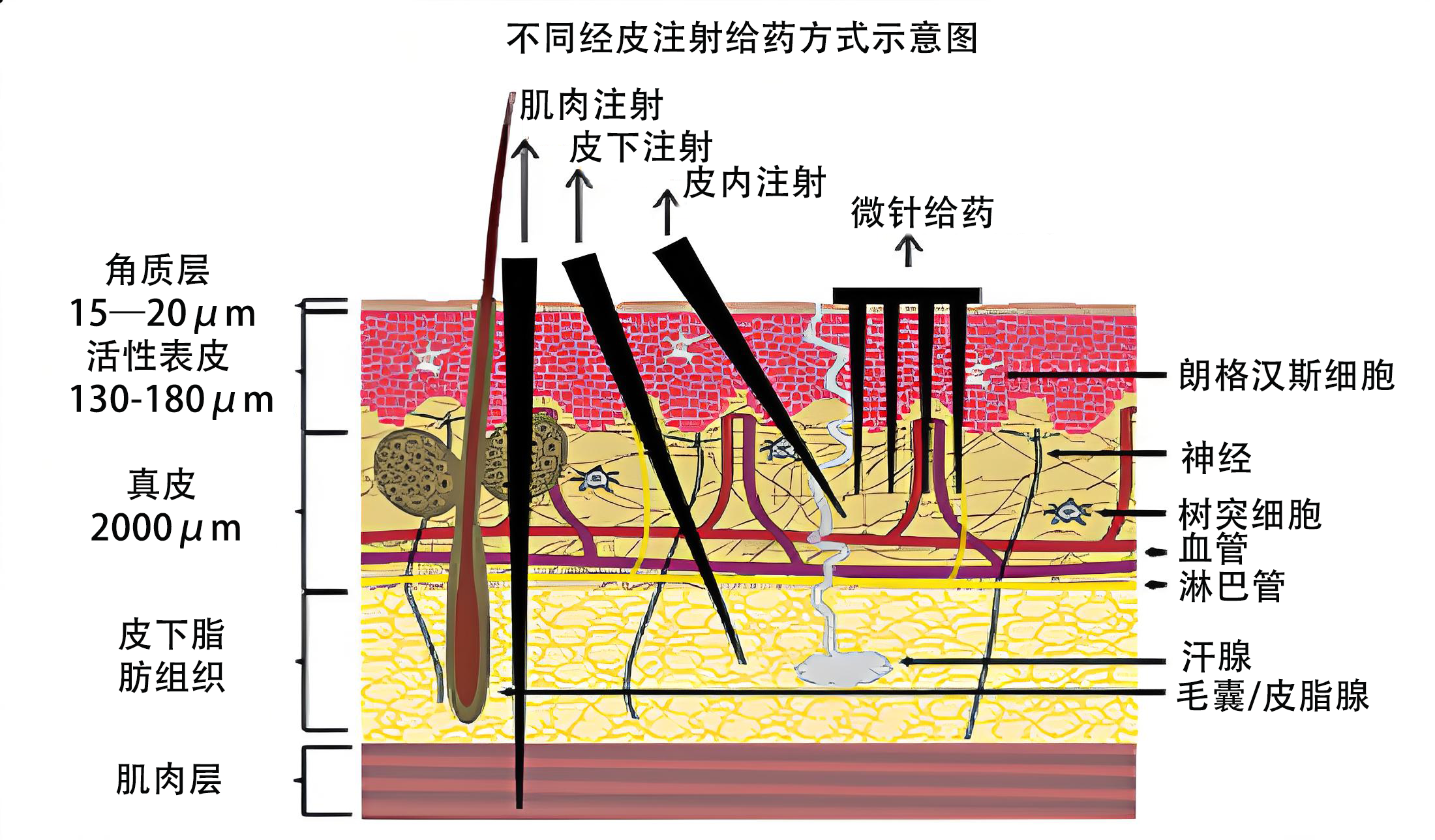
皮肤是人体最大的天然屏障,其角质层厚度约为 10~20 μm,能够有效阻挡外界病原体侵入,但也使得多数药物难以透过皮肤进入体内。传统的口服与注射方式虽然能够满足给药需求,但存在首过代谢、疼痛刺激、感染风险以及患者依从性差等问题。
在这一背景下,微针(Microneedles,MN)技术应运而生。微针是一种微创经皮药物递送装置,由多个微米级针尖以阵列形式排列在基底上组成。微针长度一般为 10~2000 μm,可轻松穿透角质层而不触及真皮神经末梢,实现无痛给药。药物通过这些微通道扩散进入皮肤或体循环,从而达到局部或全身治疗的目的。
微针技术不仅能显著提高药物的透皮吸收率,还具有无痛、便捷、安全、控释精准等优势,正在成为新一代经皮给药系统(Transdermal Drug Delivery System, TDDS)的核心研究方向。
二、微针技术的发展历程与分类
(一)发展历程
微针的概念最早由 Alan Richard Wagner 于 1958 年提出,但受限于当时的微加工技术,未能实现实际应用。直到 1990 年代,随着微电子与微机电系统(MEMS)技术的兴起,科学家首次成功制备出硅基微针阵列,为微针研究奠定了基础。1998 年,美国佐治亚理工学院的 Henry 教授首次将微针用于经皮药物递送,标志着微针正式进入药物输送领域。
(二)按发展阶段划分
第一代:硅、氧化硅微针 —— 加工精度高,但脆性大、成本高;
第二代:金属微针 —— 机械强度高,可重复使用;
第三代:可溶微针(Dissolving Microneedles) —— 以可降解聚合物为载体,实现无痛、安全、可控释放;
第四代:水凝胶微针(Hydrogel Forming Microneedles) —— 近年来发展迅速,以“柔性+智能”结构实现药物的精确传递与回收。
(三)按结构与功能划分
根据针体结构与药物释放方式,微针可分为:
实心微针(Solid MN):用于预处理皮肤、形成微通道;
空心微针(Hollow MN):内部为空腔,可注射液体药物;
包衣微针(Coated MN):药物涂覆于针体表面,实现“coat and poke”递送;
可溶微针(Dissolving MN):针体与药物一体化,刺入皮肤后溶解释放;
水凝胶微针(Hydrogel Forming MN):以吸水膨胀的水凝胶为载体,形成可控传输通道。
此外,还有冷冻微针、智能响应微针等新概念技术正在兴起,进一步拓宽了微针的功能边界。
三、水凝胶微针:以柔性材料实现智能给药
(一)结构组成
水凝胶微针由交联态水凝胶聚合物基质制备而成。与可溶微针不同,水凝胶微针在给药过程中不会溶解,而是在吸水后形成三维多孔网络结构。该结构具备高亲水性和可逆膨胀特性,可在短时间内吸收皮肤组织液,实现药物的扩散传递。
常用的水凝胶材料包括:
天然高分子类:透明质酸(HA)、海藻酸钠(SA)、明胶(Gelatin)、壳聚糖(Chitosan);
合成聚合物类:聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP)、聚丙烯酰胺(PAM)等;
智能响应型材料:对温度、pH 或葡萄糖浓度敏感的水凝胶,用于可调控释放体系。
这些材料具有优异的生物相容性、可调力学性能及良好的交联可控性,是实现安全、精准给药的关键。
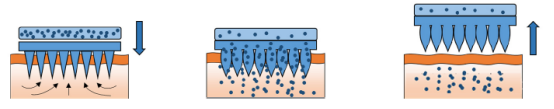
(二)作用机制
水凝胶微针刺入皮肤后,会迅速吸收组织间液,在针体内部形成含水通道。此时,药物通过两种方式递送:
基底载药型:药物储存在微针基底内,经水凝胶孔道向皮肤扩散;
针体载药型:药物与水凝胶共混制备,随水凝胶膨胀逐渐释放。
在整个过程中,水凝胶结构保持完整,不会在皮肤内残留。药物释放结束后,微针可整体移除,避免了可溶微针可能出现的残留风险。
(三)主要特点与优势
无痛、安全、无残留:针体柔软且可完全取出,避免皮肤损伤与交叉感染;
吸水膨胀、可控释放:通过调节交联密度可精确控制药物释放速率;
结构稳定、机械强度可调:能有效穿透角质层,同时保持形变恢复性;
制备工艺简便、适于规模化生产:铸模或注塑工艺均可实现批量制造;
兼容多种药物类型:适用于小分子药物、生物大分子、疫苗及美容活性成分。
四、应用前景与发展趋势
水凝胶微针因其高生物安全性与优异的可控性,已在多个领域展现出广阔前景:
医药领域:用于疫苗、胰岛素、镇痛药及抗肿瘤药物的精准递送;
生物治疗:实现蛋白、多肽及核酸类药物的稳定给药;
医美与皮肤修复:将透明质酸、抗氧化剂等活性物高效传递至真皮层。
未来,随着新型智能响应材料、纳米药物载体与3D微纳制造技术的结合,水凝胶微针有望实现智能化、个体化与可穿戴式给药系统的全面升级,成为经皮给药技术的重要发展方向。