品牌商
上海碧云天生物技术股份有限公司
入驻年限:6 年
- 联系人:
碧云天
- 所在地区:
上海 松江区
- 业务范围:
试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒、技术服务、耗材、实验室仪器 / 设备、论文服务
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
Western Blot 实验技术全攻略
人阅读 发布时间:2021-02-26 10:43
Western Blot 又称为蛋白质印迹,是分子生物学、生物化学和免疫遗传学中常用的基于抗原抗体之间特异免疫反应的一种定量或定性检测蛋白的实验方法。
基本原理:SDS-PAGE 凝胶电泳将不同分子量的蛋白质样品分离,分离后的蛋白被转移到固相支撑物(杂交膜)上,一抗特异性识别目标蛋白,通过 HRP、AP、生物素、或者荧光探针等标记的二抗识别一抗,最终通过显色、荧光或者化学发光等方法将目标蛋白可视化,从而对目标蛋白进行定性和定量分析。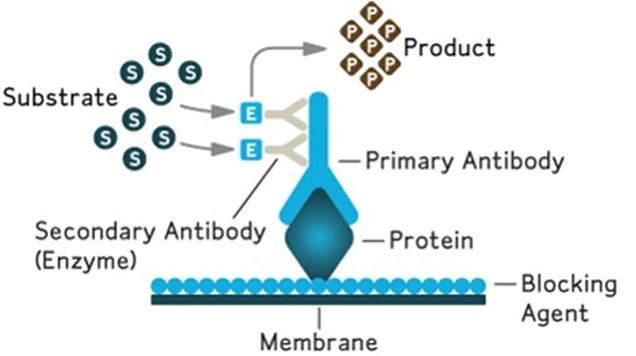
一 蛋白样品制备
蛋白样品对 Western Blot 实验至关重要。下面我们将从蛋白样品制备的方法和试剂选择上给大家一些建议。
了解目标蛋白
目标蛋白因其物种来源和组织特异性的不同,在种类和性质上有很大差异,因此并没有一种制备方法可以适用于所有蛋白的提取。这就需要我们进行全面的分析后才能选择最合适的蛋白制备方法。首先要了解:样品是来自什么物种?目标蛋白定位在哪种组织或细胞器?是可溶蛋白还是不可溶蛋白?是高丰度蛋白还是低丰度蛋白?在制备时需要保持蛋白的天然活性,还是需要变性蛋白?其次要知道:哪种方法或试剂能够防止蛋白降解、聚集、沉淀、变性、去修饰?哪种方法能够去除高丰度蛋白干扰,富集低丰度蛋白?哪种能去除核酸、多糖、脂肪等杂质?
哪种方法能在有限的实验条件下,简便快速地获得高纯度且完整性好的蛋白?
比如说,有些蛋白只在特定的细胞或细胞器中以较低丰度分布,这时候可能需要分离特定的细胞或细胞器,以达到获得的蛋白样品可满足 WB 检测的下限;还有的蛋白在常规裂解液中易聚集或沉淀,尤其是一些多次跨膜的蛋白或核内蛋白,这种情况下就需要大家查阅参考文献来了解目标蛋白的性质和常用的提取方法。
裂解液的选择
蛋白样品制备,首先要选择合适的裂解液。一般裂解液包含以下几个组分:缓冲系统;盐离子浓度;变性剂;蛋白酶、去修饰酶抑制剂;还原剂。常见的蛋白酶抑制剂有:PMSF、Aprotinin、Leupeptin、 Pepstatin,AEBSF-HCl等,其中PMSF对多种不同活性中心的蛋白酶都有极好的抑制作用而且效率高,因此基本是必加的试剂。另外,做磷酸化蛋白的 Western blot 时,还需要加入磷酸酶抑制剂,避免磷酸化形式的蛋白发生去磷酸化。类似地,检测乙酰化蛋白的时候还需要加入去乙酰化酶抑制剂。许多蛋白天然条件下存在二硫键而形成多个分子的聚合体,另有少数蛋白在制样的过程中也会自发形成二硫键,在裂解液中引入还原剂可以有效地还原二硫键,常用的还原剂有B-巯基乙醇,DTT等。常见的上样缓冲液中会含有DTT。
点击了解碧云天裂解液
细胞蛋白样品制备
悬浮细胞:可直接离心收集,并用 PBS 等洗涤1-2 次去除培养液中的血清和杂质便可以裂解。
贴壁细胞:吸净培养液后,直接加入裂解液裂解,或者在吸净培养液后用PBS等洗涤1-2次后,加入裂解液裂解,收集细胞裂解液时可以根据具体情况使用细胞铲和细胞刮进行适当的辅助。也可以在胰酶消化后参考悬浮细胞的方式裂解,但很多蛋白都可以被胰酶消化,并在 WB 检测时可能会检测到消化出来的短片段。根据实验需要,也可用细胞刮或细胞铲刮下或铲下细胞,或用移液器吸取 PBS 将细胞从容器壁上吹打下来,再像悬浮细胞那样洗涤后再裂解。
不管是悬浮细胞,还是贴壁细胞,裂解操作都是相同的:加完裂解液后,将细胞置于冰上,使其充分裂解。对于裂解不充分的细胞也可以再进行冰浴超声。裂解之后离心取上清进行后续的蛋白浓度测定,加上样缓冲液煮沸等操作。有一些研究人员喜欢使用 1XSDS-PAGE 上样缓冲液直接裂解细胞。这样操作的优势是快速便捷,缺点是后续不方便测定蛋白浓度以校准每个上样孔的蛋白量。
组织蛋白样品制备
取好的组织样品需要进行破碎处理,否则难以裂解充分处理。实验室常用的破碎方法有匀浆法、研磨法等。最常见的比较便捷的方法是按照一定比例加入裂解液,用玻璃匀浆器或者适当的电动匀浆设备进行匀浆处理;最稳妥可靠的方法是把组织样品液氮冷冻后再研钵内研磨成粉末,然后再加入裂解液裂解。组织样品充分裂解后,离心取上清进行后续操作。
- 操作过程中的注意事项
- 防止降解
- 使用蛋白酶抑制剂抑制细胞或组织中释放的蛋白酶活性。
- 低温操作。提取蛋白时,避开蛋白酶的最适活性温度。所有的步骤都可在低温下完成,所有的试剂都需预冷,以降低蛋白酶活性,防止蛋白降解。
- 加快提取速度,一次不要处理过多的样品
- 避免杂质的干扰
- 器材污染 在提取蛋白时尽可能使用洁净器具,防止样本被污染。尤其在处理组织样本时,一些反复用的器具如匀浆器、研磨杵、研钵等需保持干净。
- 核酸或脂类的干扰 核酸和脂类都可能与蛋白质结合,如果制备的样品中含有大量的脂类或核酸,则有可能影响目的蛋白泳动速率,或者可能形成大的复合物而不能进入浓缩胶。核酸通常可以通过超声处理或者使用1ml注射器(带针头)反复抽吸的方法打断成小片段。在制备脂肪组织或者脂肪肝组织样品时,在制样后低温离心或将样品放置于低温,大部分油脂会漂浮在液面并很可能结冻,此时设法去除油脂或者吸取相应的水相液体即可有效减小脂类的干扰。
- 蛋白浓度测定
蛋白提取完成后,可以用 BCA 法或 Bradford 法测定浓度,以确保上样量稳定可控,也可以通过 SDS-PAGE 后考马斯亮蓝法染胶或者在转膜后通过丽春红染色等判断每个孔的上样量是否一致,以及蛋白是否裂解充分、有无降解等。
点击了解碧云天蛋白浓度测定试剂盒
二 蛋白电泳
样品制备完成后,需要通过电泳将不同分子量大小的蛋白有效分开,以便能够检测目的蛋白的表达水平。
Western Blot 检测时,相对广泛采用的是 SDS-PAGE。对于 SDS-PAGE,是在电泳体系中加入变性剂 SDS 和还原剂 DTT 或者巯基乙醇等。蛋白质分子的多聚体或者高级结构会被打开,蛋白质氨基酸侧链和 SDS 结合形成蛋白-SDS 复合物,所带的负电荷大大超过了蛋白质原有的电荷量,因此可以有效消除不同蛋白质分子间的电荷差异和空间结构差异。所以 SDS-PAGE 检测时,可以利用分子筛效应将蛋白质依据分子量大小分离开来。

SDS-PAGE 一般采用不连续缓冲系统,即由分离胶和浓缩胶构成,这样对蛋白质的分离除了分子筛效应外,还有堆积效应,将较稀的蛋白样品经过大孔径凝胶的迁移作用而被浓缩至一个狭窄的区带。不连续缓冲系统的分离胶可以是均一胶,也可以是梯度胶。
1. 配胶
由于凝胶浓度决定凝胶孔径的大小,而凝胶孔径影响电泳效果(即凝胶的分子筛效应),所以应根据样品中蛋白质的分子量范围选择合适的凝胶浓度。如下
| 蛋白分子量大小(kDa) | 凝胶百分比(%) |
| 12-45 | 15 |
| 15-60 | 12 |
| 20-80 | 10 |
| 30-120 | 8 |
| 60-200 | 6 |
- 上样
- 内槽补满电泳液后再拔梳子;
- 加样前每个孔如果能用移液器吸入电泳液轻轻吹打一下,会使电泳效果更佳。
- 可在蛋白变性前调整蛋白浓度,使上样量尽量保持一致。如果已经变性的蛋白浓度本身不一致,可以通过加入1X蛋白上样缓冲液调整。此外,上样量不要太多,以避免渗漏到邻近加样孔。
- 加样前,样品都需要充分煮沸。如果有明显的沉淀物或悬浮物(常见的包括可能结合了一些蛋白的基因组DNA,特殊细胞或组织中的不溶物等),需要离心去除,以免干扰蛋白电泳或者使上样量不太均匀。
- 每次电泳时需要使用预染蛋白质分子量标准(蛋白 marker)来观察电泳效果和转膜效果,以及判断蛋白分子量大小。推荐使用彩色预染蛋白质分子量标准以便更加方便直观地观察。
- 为了确保 Western blot 结果的准确性和特异性,可以考虑设置合适正确的对照,具体如下——
阳性对照:明确表达检测蛋白的组织或细胞,用于检测抗体的工作效率和实验操作的正确与否;
阴性对照:明确不表达检测蛋白的组织或细胞,用于检测抗体的特异性;
注意
- 上样后应尽快开始电泳,以减少小蛋白条带的扩散;
- 电泳时通常推荐在上层胶时使用低电压恒压电泳,使样品跑得慢一些,充分浓缩而在溴酚蓝进入分离胶时使用高电压恒压电泳。实际过程中也可以采用恒电流模式,可根据自己的时间来调节。电泳至溴酚蓝靠近凝胶底部即可终止电泳,或者可以根据预染蛋白质分子量标准的电泳情况,预计目的蛋白已经被适当分离后即可停止电泳。
- 关于电泳液,也可以回收 1-2 次作为外槽电泳液,根据实验室情况决定。内槽电泳液请每次新鲜配制。建议先配 10x 的,然后现用现稀释。
三 转膜
转膜,顾名思义,是将电泳后分离的蛋白质从凝胶中转移到固相载体上,同时维持其对位置和分辨率的过程。
转膜方式主要有两种:湿转和半干转。两者原理相同,只是用于固定胶/膜叠层及施加电场的仪器有不同。半干转耗时短,但是更适合小分子蛋白的转印,而湿转蛋白分子量范围较宽,两者的比较见下表,在 Western Blot 实验中,常用的是湿转。
两种转膜方式的比较:
| 湿式转印系统 | 半干转印系统 |
| 小分子、大分子蛋白均可轻松转移 | 比较适合转移小分子蛋白(<120kD) |
| 转膜时间一般较长 | 转膜时间一般较短 |
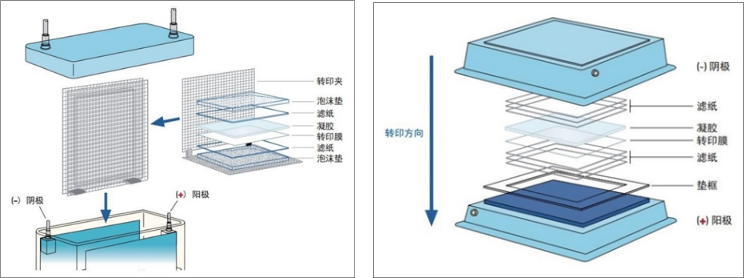
湿式转印系统示意图 半干转印系统示意图
1. 转印膜的选择
杂交膜的选择也是 Western Blot 实验中一个重要的环节,需要根据杂交方案,被转移蛋白的特性及蛋白分子量大小等条件去选择合适材质、孔径和规则的杂交膜。Western Blot 实验中最常用的转印膜有两种:PVDF 膜和 NC 膜(硝酸纤维素膜)。对于两种膜的比较:
| PVDF 膜 | NC 膜 |
| 机械强度高,质地柔韧,易于保存 | 脆而易碎 |
| 化学稳定性好,耐腐蚀,不易降解 | 溶剂不耐受 |
| 蛋白结合能力相对较高 | 蛋白结合能力相对较低 |
| 可用于多次剥离和杂交 | 不利于多次剥离和杂交 |
| 需要甲醇等溶液浸泡预湿活化 | 不需要预湿处理 |
| 价格较高 | 价格较低 |
0.2μm :特别适合小于 20kD 的蛋白;推荐用于低丰度蛋白检测。
0.45μm:更加常用,适合大于 20kD 的蛋白;比表面积较小,背景较低。
在选择时:
- 对于用量较小的情况,优先推荐选择预裁切的 20 片/包装产品,使用比较便捷也可以避免浪费。对于用量较大的情况,推荐使用预裁切的100片/包装或整卷产品。预裁切产品无需再进行裁切,使用非常便捷;并且由于机械化裁切的效率很高,可以避免手工裁切导致的膜裁切时的浪费。
- 一般 Western Blot 推荐使用预裁切的孔径为0.45μm 的 PVDF 膜,也可以使用硝酸纤维素膜。但PVDF膜的蛋白吸收性能比硝酸纤维素膜更好一些,而且不易破裂或卷曲,缺点是需要用乙醇、甲醇或其它适当的溶液中浸泡活化后使用。
- 对于分子量小于20kDa蛋白的检测,可以选择孔径为 0.2μm 的 PVDF 膜。但如果既要检测大分子量又要检测小分子量的蛋白,只要蛋白分子量不是特别小,如 10-15kDa,可以使用孔径为 0.45μm 的 PVDF 膜,此时胶的浓度可以适当提高,例如10-15% 左右,电泳的时间适当增加,以使目标蛋白适当分开但又不会跑出去。
- 转膜操作
转膜之前先提前配 好1x 转膜液,也可以直接购买碧云天配制好的的 Western 转膜液(P0021A/P0021B),提前放在4°C冰箱或冷库进行预冷处理。
PVDF 膜活化
将膜产品浸润在甲醇或安全无毒的 PVDF 膜浸润活化液中活化,保证膜由不透明变成透明,然后小心将膜放入提前配好的转膜液中平衡。如果使用活化液,只需简单地用转膜液洗涤数秒,即可被快速平衡并用于后续的转膜等实验。
转膜装置的组装
在加有转膜液的搪瓷盘里放入转膜用的夹子、两块 转移衬垫、滤纸和已经活化好的膜。将夹子打开使黑的一面保持水平。然后依次放入转移衬垫(海绵垫)-滤纸-胶-PVDF膜-滤纸-转移衬垫(海绵垫),制成“三明治”结构。整个操作在转膜液中进行,并使用专业赶气泡滚子滚动赶走气泡,要保证夹子、海绵垫、滤纸、胶、膜之间没有气泡。将夹子夹好后放入转移槽中,要使夹子的黑面对槽的黑面,夹子的白面对槽的红面。
转膜夹子放入槽中后,加入足够的转膜液,盖上盖子,插好电源,准备转膜。
转膜时会有比较明显的产热现象,并导致转膜液的电阻变小,最终影响转膜效率、转膜液的缓冲能力、甚至过热导致凝胶熔化或黏附在膜上。因此建议转膜时,在转膜槽内用冰盒降温,并将转膜槽置于冰浴中。
对于湿转法,一般转膜的电流在200mA-400mA之间,转膜时间为30-60分钟。也可以在15-20mA转膜过夜。大片段的>50KD的可以选用350mA,小片段的可以用250mA。具体的转膜时间要根据目的蛋白的大小而定,目的蛋白的分子量越大,需要的转膜时间越长,目的蛋白的分子量越小,需要的转膜时间越短。
3. 转膜效果鉴定
如果想看转移后的效果,可对凝胶进行染色,可以用碧云天丽春红染色液,来观察实际的转膜效果。或者用考马斯亮蓝超快染色液对完成转膜的SDS-PAGE胶进行染色,以观察蛋白的残留情况。但其实有一个更简单快速的方法就是通过预染 marker 来判断。看凝胶上是否有 marker 残留以及转印膜上 marker 的清晰度。
点击了解碧云天转膜产品
四 免疫反应与检测
封闭
1.洗涤
转膜完毕和后续的封闭、抗体孵育后,都需要对膜进行洗涤。适当的洗涤可以降低背景,增强信噪比。
常用的洗涤液是 TBST,也可以选择碧云天的 Western 洗涤液。在洗膜盒中加入少量洗涤液,使之能盖住蛋白膜,在摇床上洗涤 5 分钟后,吸尽洗涤液,再加入新的洗涤液洗涤。共洗涤 3 次,每次 5 分钟。
2. 封闭
吸尽洗涤液后,就可以进行封闭了。一般用的封闭液有 5% 的 BSA 和 5% 的脱脂奶粉。脱脂奶粉里含有磷酸化蛋白,不能用于磷酸化蛋白的检测。此外,脱脂奶粉也含有生物素,不能用于生物素标记的抗体系统。BSA 也是常用的封闭液,但 BSA 可能含有 IgG 或其他血清蛋白等污染,这些蛋白可以与某些抗体产生交叉反应,增加非特异性信号。封闭时间室温 1-2h 即可。对于一些背景较高的抗体,可以适当延长封闭时间,如有必要甚至可以 4℃ 封闭过夜。
抗体孵育
一抗孵育
封闭结束后,用 Western 洗涤液或 TBST 对膜进行洗涤。参考一抗的说明书,按照适当比例用 TBST 对一抗进行稀释。室温或 4℃ 在侧摆摇床上缓慢摇动孵育一小时。如果一抗孵育一小时效果不佳,可以4℃缓慢摇动孵育过夜,或根据抗体的说明选择适当的孵育温度和时间。
二抗孵育
一抗孵育结束后,回收一抗,用 Western 洗涤液或 TBST 对膜进行洗涤。洗膜结束后,加入二抗,室温摇床 1-1.5h,然后回收二抗,再次洗膜。
在对抗体标记时,我们经常标记二抗而不是一抗,其优点在于:二抗对某一物种(如小鼠)的所有抗体均具有特异性,因而使用标记的二抗可以免去对每一个一抗进行标记,大大节省了时间和费用;此外,一抗分子可以同时结合几个二抗分子,从而使信号大大增强,提高了实验灵敏度。
检测
ECL 检测法原理
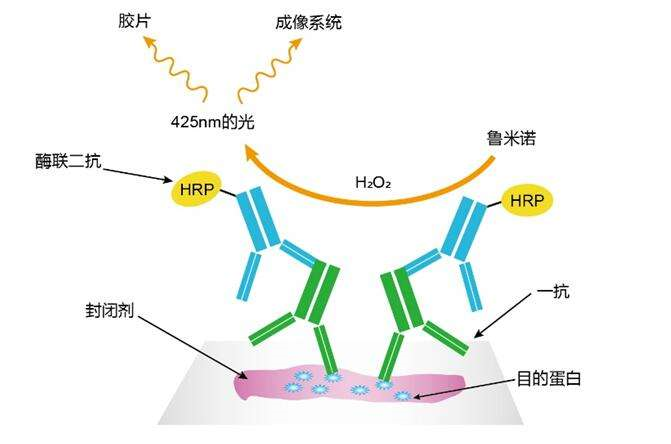
WB 常用的检测方法主要有化学发光检测、底物显色检测和荧光检测(Odyssey 系统),其各种检测方法的区别和优缺点主要如下:

大家可以根据自己的实验需求进行选择。
点击了解碧云天免疫检测产品
膜重复利用
在 Western 中完成了一抗二抗结合和后续的化学发光检测后,有时还需要检测 tubulin、actin 等内参蛋白,或检测其它蛋白进行比较。
点击了解碧云天膜重复利用产品









