上海诺佰佰生物科技有限公司
4 年
手机商铺
- NaN
- 0.5
- 0.5
- 2.5
- 2.5
推荐产品
技术资料/正文
N家干货 | 荧光素酶技术的八大应用
533 人阅读发布时间:2025-06-13 15:50
1.背景介绍
荧光素酶(Luciferase)生物检测技术诞生于1990年,1993年第一个萤光素酶专利获批,1996年双萤光素酶报告基因检测系统推出。
荧光素酶是生物体内催化荧光素(luciferin)或脂肪醛(firefly aldehyde)氧化发光的一类酶的总称,主要来自于自然界能够发光的生物,目前常用的有:萤火虫荧光素酶、海肾荧光素酶、高斯荧光素酶,以及人工改造NanoLuc®荧光素酶。历经30多年的发展,已成为生物相关实验中十分重要的技术工具。主要用于如下:
2.基因表达研究
基因表达研究主要是通过分子生物学克隆技术,将荧光素酶基因插到待研究细胞染色体内,通过单克隆细胞技术,筛选出稳定表达荧光素酶的细胞株。同步将某信号通路的下游响应原件序列构建入报告基因载体,在上游信号不同的条件下,荧光素酶的活性代表了通路下游响应的程度。
3.启动子及转录因子相关研究
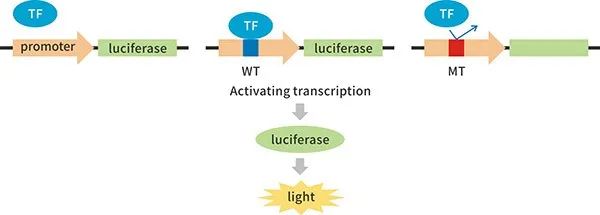
启动子(Promoter)是一段位于结构基因5’端上游区的DNA序列,可活化RNA聚合酶,使之与模板DNA准确结合并启动转录,调控基因表达。
(1)将待测启动子构建至荧光素酶基因的上游,检测启动子的活性。
(2)将启动子区域插入双荧光素酶报告基因载体,同时在实验细胞中共转过表达对应的转录因子,可分析转录因子过表达是否提高或降低荧光素酶活性,检测启动子的表达模式及强度。
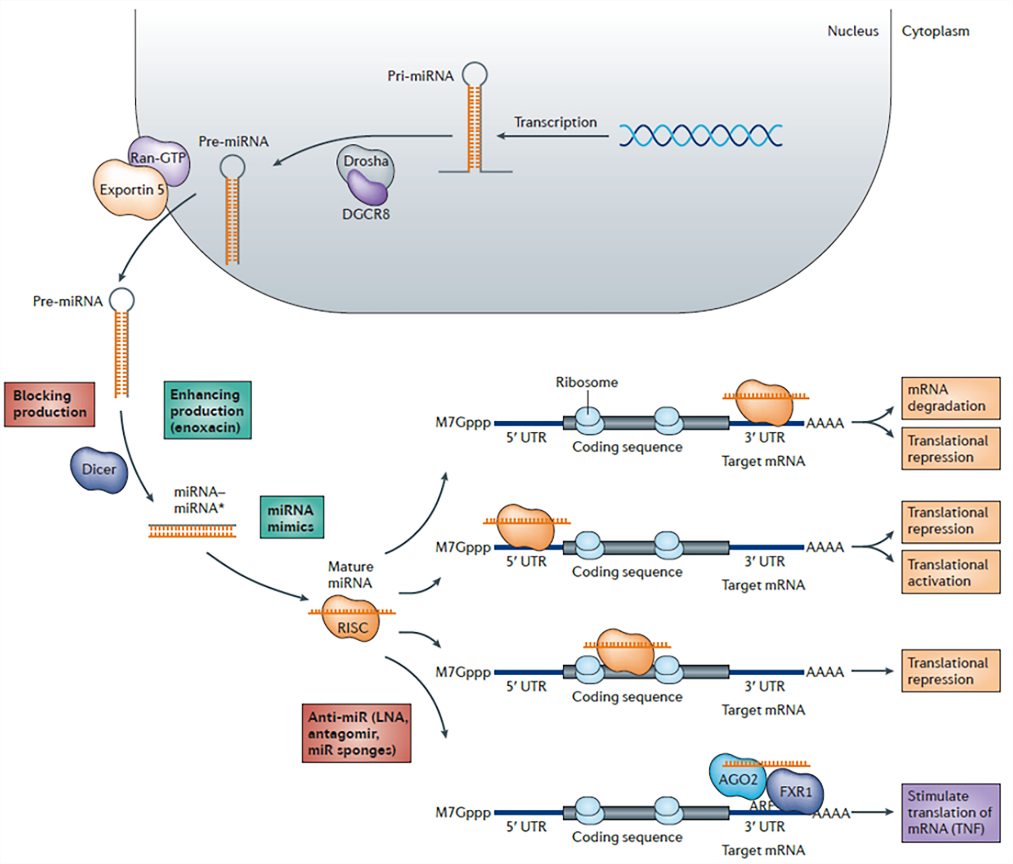
4.验证microRNA与靶基因是否存在调控关系
microRNA,非编码单链RNA分子,它们在动植物中参与转录后基因表达调控。主要通过作用于靶基因的3’UTR起作用。可以将目的基因3’UTR区域构建至报告基因luciferase的下游,再共转入microRNA,如果荧光素酶表达下降,可以说明microRNA对目的基因的抑制作用(见下图):
5.药物靶点筛选
基于荧光素酶技术具有可检测的酶活性、ATP水平和修饰的荧光素底物的能力,同时兼具蛋白小、无内源表达、易于定量和检测多样性的特点,能够帮助小分子和大分子药物的开发,明显提高了筛选通量,并在筛选的过程中得到有关细胞内功能性反应的信息,同时还能够满足灵敏性高、反应迅速、特异性强的要求。
6.蛋白互作-荧光共振能量转移实验
目前,常见的蛋白互作检测技术主要包括酵母双杂交(Y2H)、免疫共沉淀(Co-IP)、双分子荧光互补(BiFC)、荧光共振能量转移(FRET)、生物层干涉(BLI)和Pull-down等。
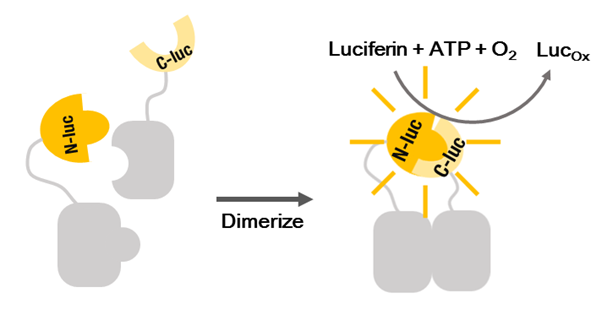
萤光素酶互补(Luciferase Complementation Assay, LCA)是在BiFC基础上发展出来的一种技术,简而言之就是将分开时都不单独发光的荧光酶的C端和N端分别与待检测的目标蛋白融合。如果两个目标蛋白有相互作用,则N端片段和C端片段在空间上靠近并互补,从而发挥萤光素酶活性,催化底物产生光(上图)。因为灵敏度高、操作简单、可用于定量化研究,LCA近些年被广泛应用于动植物的蛋白互作研究。
7.细胞信号通路调控及蛋白酶活性检测
蛋白酶以Caspase-3为例,将萤火虫荧光素酶(firefly luciferase)的N末端和Peptide A (pepA) 融合,将C末端和Peptide B (pepB)融合,中间用Caspase-3的切割位点DEVD分隔开。需要注意的是,pepA可以和pepB互作。
正常情况下,这个PepA-N-Luc-DEVD-PepB-C-Luc融合蛋白没有荧光素酶活性。当caspase-3激活的时候,切割掉DEVD间隔序列,这时候就会产生两个片段:pepA-N-Luciferase(ANLuc)和pepB-C-Luciferase(BCLuc),然后pepA和pepB互作,导致N-Luc和C-Luc被重塑成具有活性的荧光素酶。
8.动物活体成像研究
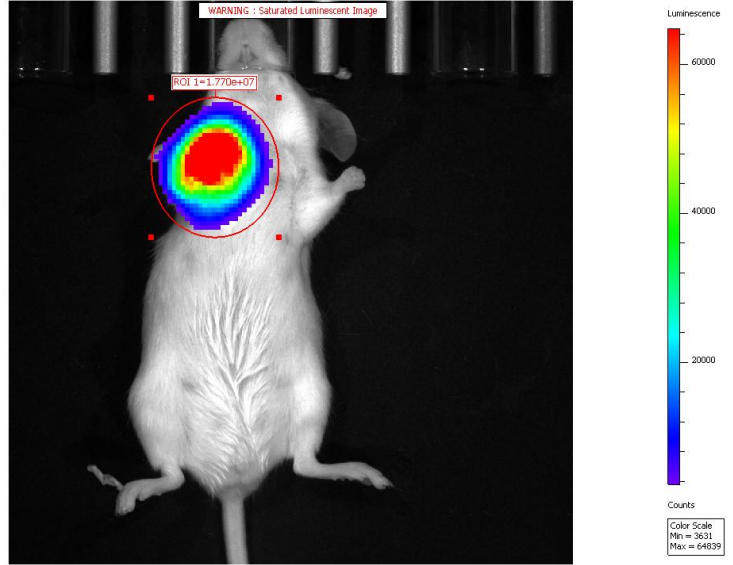
(1)肿瘤学:荧光素酶报告基因活体成像能够让研究人员能够直接快速的测量各种癌症模型中肿瘤的生长、转移以及对药物的反应。非常适合于肿瘤体内生长的定量分析,避免宰杀老鼠;
(2)干细胞与免疫学:萤火虫荧光素酶报告基因做示踪标记干细胞,将目的基因与萤火虫荧光素酶基因融合融合表达,做成转基因小鼠,进行干细胞移植,可以用活体生物发光成像技术示踪干细胞在体内的增殖、分化及迁徙的过程。可以通过标记免疫细胞,观察免疫细胞对肿瘤细胞等的识别和杀死功能,评价免疫细胞的免疫特异性、增殖、迁移及功能等;
(3)蛋白质相互作用:可利用动物体内生物发光成像技术研究活体动物体内蛋白与蛋白的相互作用。
9.ADCC
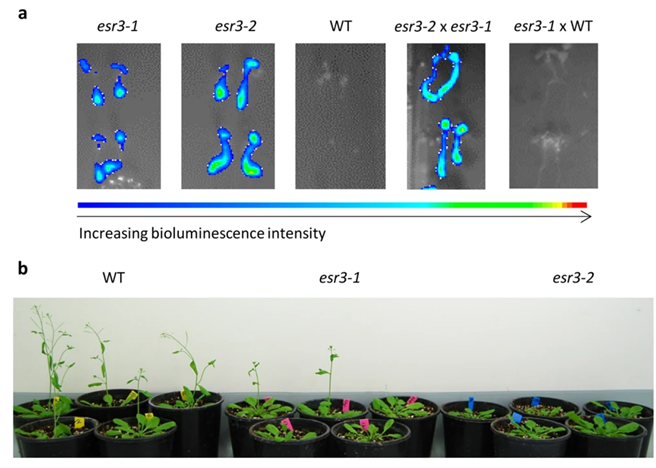
上图为拟南芥突变体体内成像实验。植物也可以进行类似的以生物发光或荧光为基础的活体成像。植物活体成像因其操作简便、可以直接观察或监测植物体内的分子活动,从而被应用于许多研究中,如转基因植物筛选、生物钟节律研究、非生物胁迫研究、抗病虫害侵袭研究等。




