- 公司地址
-
上海市闵行区联航路1239号8B楼3层
邮编:200233
- 联系电话
- 021-****6157登录查看商家电话
- 传真号码
- 021-34786153
- 电子邮箱
- gulingzhi@****bio.com登录查看商家邮箱
- 公司网址
- www.yingbio.com
LncRNA PVT1与食管腺癌的关系揭秘
发布时间:2020-01-11 09:11 | 点击次数:
PVT1在许多肿瘤类型中已作为致癌基因出现。然而,其在Barrett食管(BE)和食管腺癌(EAC)中的作用尚不清楚。本研究的目的是评估PVT1在BE/EAC进展中的作用,并揭示其对EAC的治疗价值。本文通过qPCR检测PVT1在正常、BE、EAC组织中的表达,并进行统计学分析,以确定PVT1表达与EAC(分期、转移、生存)的关系,并检测PVT1反义寡核苷酸(ASOs)的体内外抗肿瘤活性。
结果:
1.PVT1 lncRNA在EAC患者中的过表达与不良预后相关
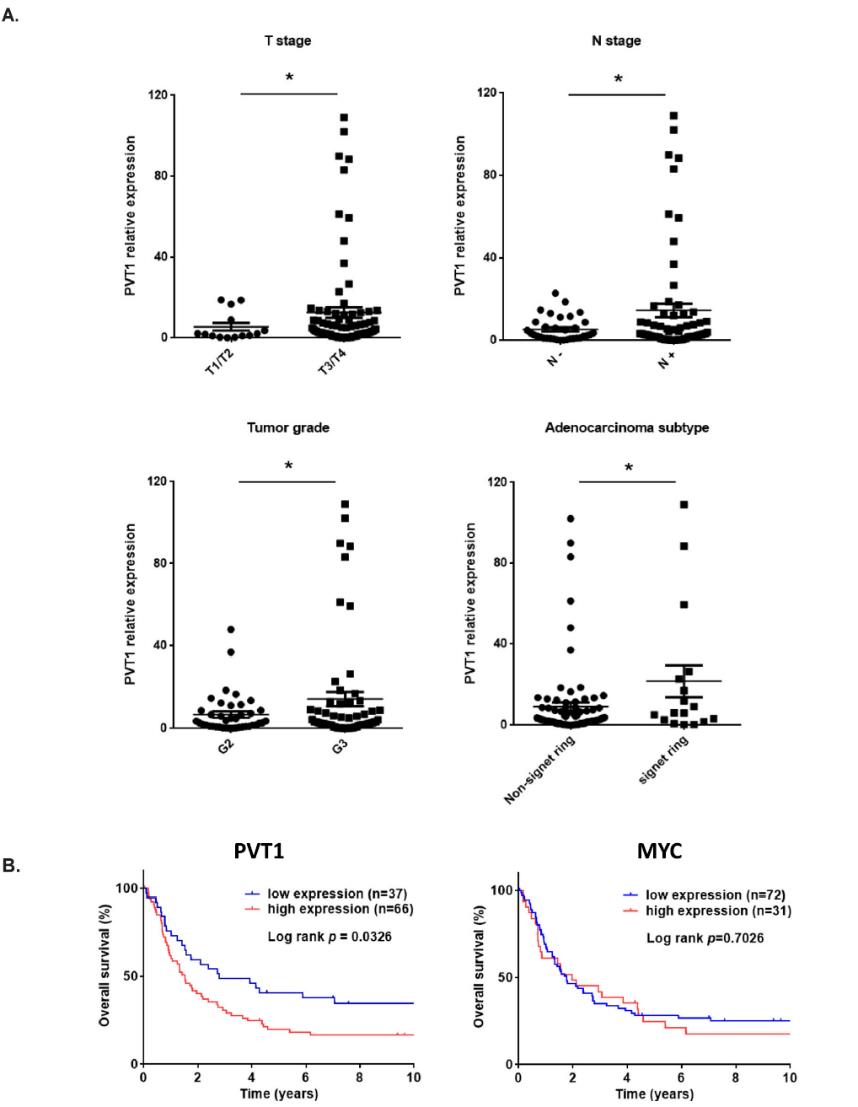
首先,利用TCGA数据集分析了多种癌症类型的PVT1基因组改变,我们发现ESCA是第二大癌症类型,存在20% PVT1扩增,约75%的ESCA病例同时存在扩增和重复(图1a)。进一步分析两种主要的ESCA亚型EAC和ESCC,我们发现EAC患者具有相对较高的PVT1扩增,其在西方人群中的发病率也较高,这使我们关注EAC(图1b)。与ESCA中TCGA RNA Seq数据整合后,无论是复制还是扩增,PVT1的遗传改变与PVT1的表达水平显著相关(图1c),提示EC中PVT1的遗传改变导致其mRNA水平上调。为了证实TCGA数据集的发现,接下来,我们用qPCR在我们自己的患者队列中检测PVT1 lncRNA的表达。结果表明,PVT1 lncRNA的表达升高与BE的进展存在显著的相关性(图1d)。而且MYC mRNA在EACs中也显著升高(图1e)。另外,我们发现PVT1表达与临床特征显著相关。如图2a所示,PVT1高表达与高T期、高N期、肿瘤分级不良显著相关。Kaplan-Meier分析显示,与PVT1 lncRNA表达水平较低的EAC患者相比,PVT1 lncRNA表达水平较高的EAC患者总体生存期较短(图2b)。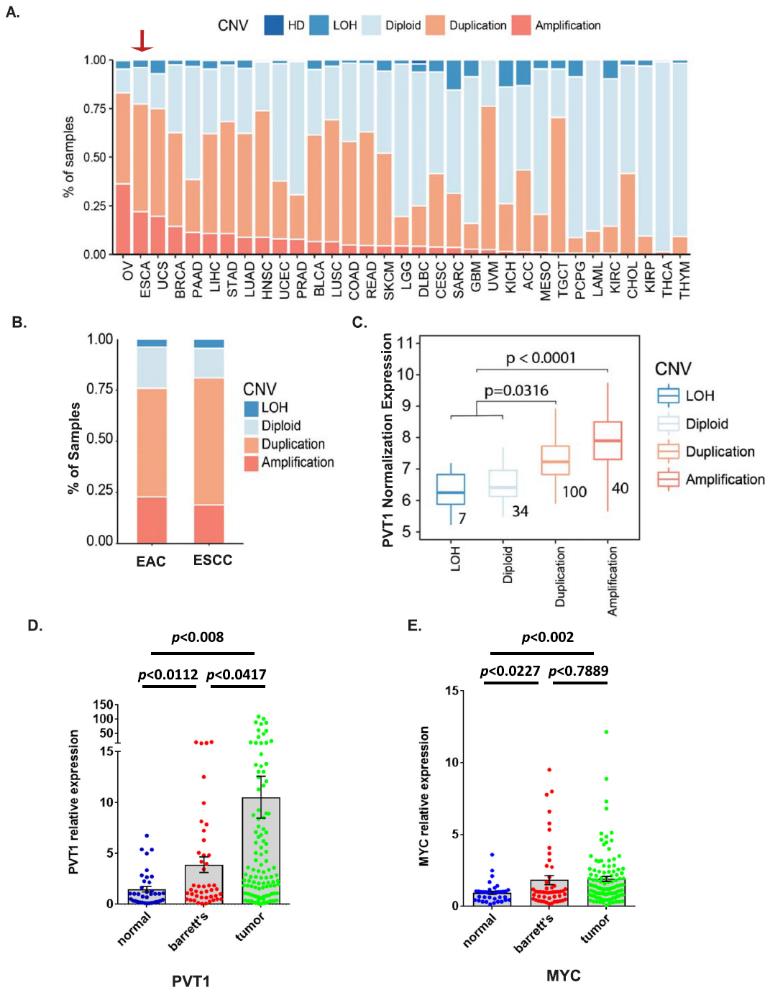
2.PVT1的抑制抑制了EAC细胞在体内外的生长
通过qPCR检测PVT1在正常食管上皮细胞系和4个EAC细胞系的表达。与HET-1A细胞系相比,EAC细胞系中PVT1 lncRNA水平明显升高(图3a)。随后,我们评估了人类PVT1特异性ASOs,发现三种PVT1 ASOs (ASO 4、ASO 5和ASO 6)在EAC细胞系中以剂量依赖的方式有效抑制了PVT1的表达(图3b)。为了进一步阐明PVT1 ASOs对EAC细胞的抑制作用,我们在JHESO和OE19细胞中进行了集落形成和细胞迁移实验。结果表明,与未处理或对照组相比,PVT1 ASOs均可显著抑制EAC细胞的集落形成,且呈剂量依赖性(图3c)。同样,细胞侵袭实验显示,PVT1 ASOs处理EAC细胞后,侵袭细胞数量明显减少(图3d)。为了进一步研究PVT1 ASO抑制PVT1是否会影响体内肿瘤生长,裸小鼠皮下注射JHESO细胞。小鼠随机分为对照组和PVT1组。治疗3周后观察肿瘤生长和肿瘤体积。PVT1 ASO组肿瘤体积及重量较对照组明显下降(图3e)。此外,经qPCR检测,PVT1 ASO治疗组肿瘤组织中PVT1的表达较对照组明显下降(图3f)。这些结果证实了PVT1 ASO对EAC的体外和体内抑制作用。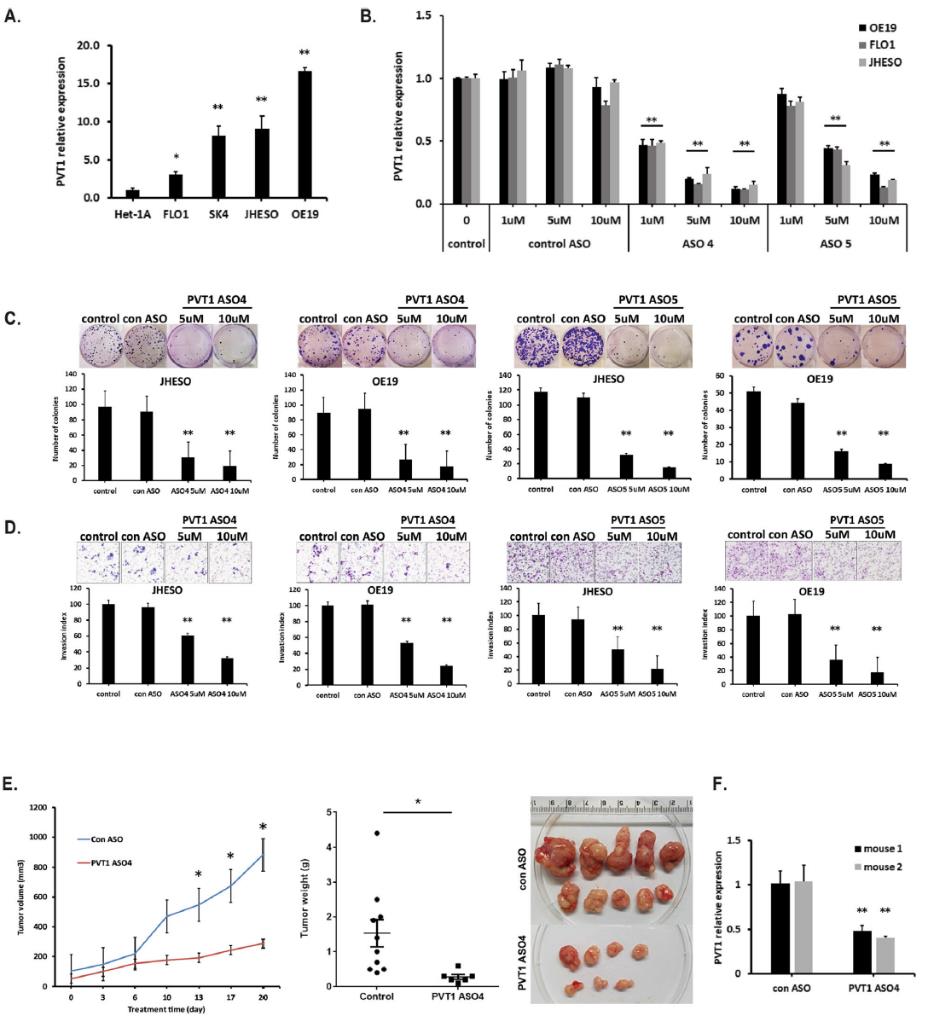
3.PVT1 ASOs抑制EAC细胞的CSC特性
为了评估PVT1对EAC细胞的CSC特性的影响,我们对暴露于PVT1 ASOs的JHESO和OE19细胞系进行了肿瘤球实验。从图4a和图b可以看出,PVT1 ASOs处理后,与对照组ASO治疗的EAC细胞相比,JHESO和OE19细胞中肿瘤球的形成均明显减少。当ASOs敲除PVT1后,ALDH1A1+细胞数量明显减少(图4c)。此外,ALDH1表达的减少与肿瘤球的大小和数量的显著减少相一致。这些结果提示PVT1 lncRNA与EAC的CSC相关,可能在EAC的肿瘤发生/进展中起关键作用。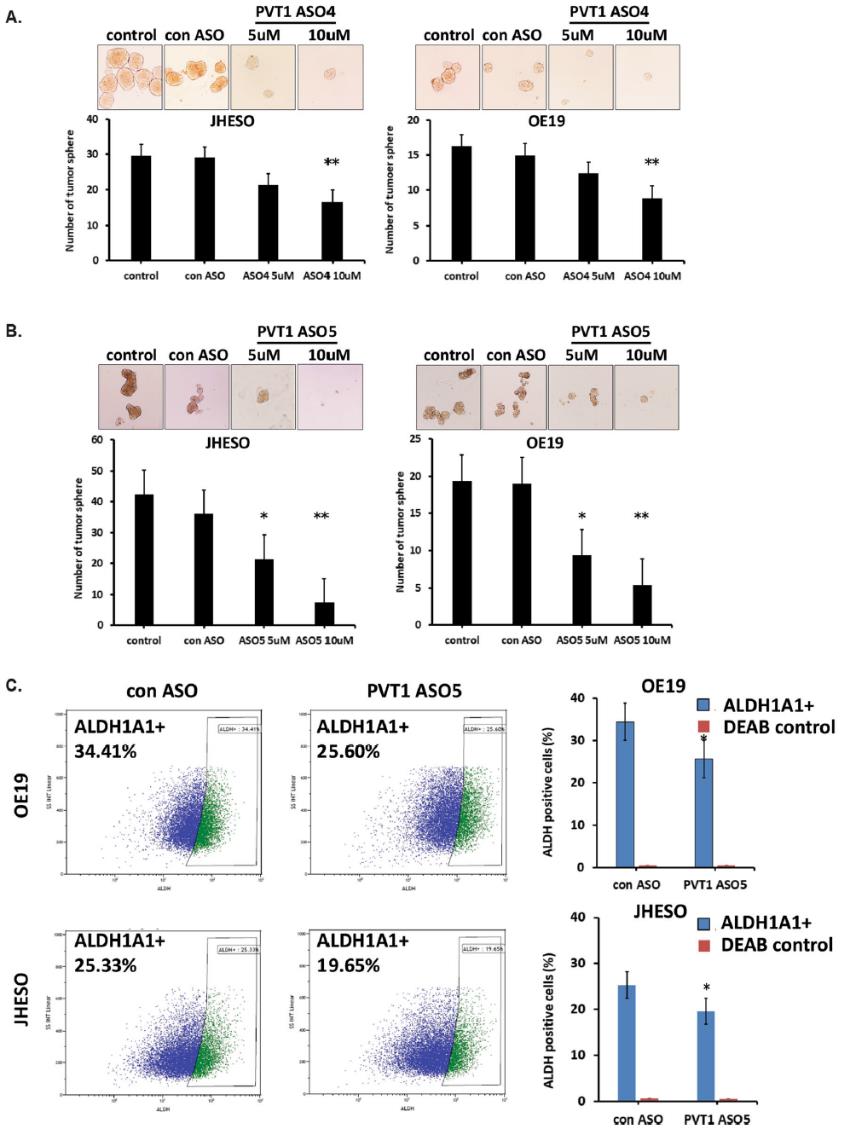
4.YAP1对EAC中PVT1的正反馈调节作用
为了识别EAC中参与调控PVT1的分子通路,我们使用PVT1 ASO对未经处理和处理的EAC细胞系进行了多个信号通路的RPPA分析。结果显示,与对照组细胞相比,经PVT1处理的细胞中YAP1的表达明显下调;相反,磷酸化的YAP1增加(图5a),表明YAP1是PVT1潜在的下游靶标。接着通过qPCR进一步证实了PVT1和YAP1表达之间的相关性,即PVT与YAP1表达显著相关(图5b)。Pearson相关分析表明,YAP1表达与PVT1呈正相关(图5b)。为了进一步证实PVT1与YAP1的正相关关系,我们以PVT1 ASOs为工具,测定EAC细胞系OE19和JHESO中PVT1被抑制后YAP1的变化。如图5c所示,在两个EAC细胞系中,控制YAP1磷酸化和降解的直接上游激酶磷酸化lats1在PVT1 ASO治疗后呈剂量依赖性增加。与之相对应,PVT1 ASO处理的JHESO和OE19细胞中,Ser 127磷酸化的YAP1也显著升高,而YAP1的表达降低(图5c)。免疫荧光染色进一步证实YAP1核表达显著降低,而LATS1磷酸化增加(图5d)。
为了验证YAP1是否反过来影响PVT1的表达,我们在SKGT-4 EAC细胞中产生了可诱导的YAP1 cDNA表达。如图5e所示,成功诱导YAP1可显著增加PVT1表达,与YAP1水平升高及其下游靶点SOX9、CTGF相关;与此相反,通过CRISPR/Cas9基因组编辑技术在SKGT-4细胞中高效敲除YAP1,在两个克隆(YAP1 KO1和YAP1 KO2)中显著降低了PVT1的表达,这与YAP1蛋白和mRNA水平的降低有关(图5f)。总之,这些数据表明,PVT1和YAP1都是相关的,并相互积极调节,这可能为EAC的治疗提供一种新的机制上的见解。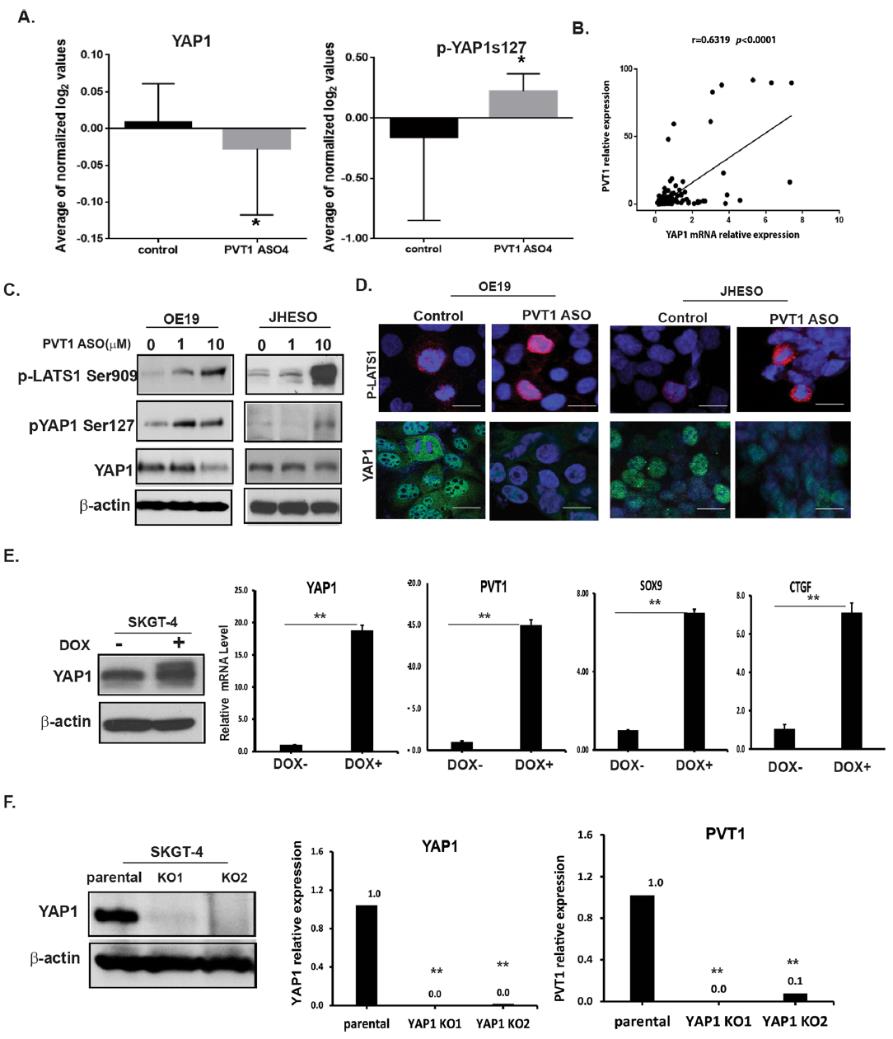
5.同时抑制PVT1和YAP1可增强EAC细胞的体内外生长抑制
为了研究PVT1和YAP1联合抑制是否具有更强的EAC抗肿瘤活性,我们利用PVT1和YAP1特异性ASOs进行了体外和体内实验。如图6a所示,虽然单独使用PVT1 ASO或YAP1 ASO均可显著抑制PVT和YAP1的表达,但二者联合使用ASOs时,二者均可同时抑制PVT和YAP1的表达。在功能上,当用PVT1或YAP1 ASOs处理JHESO和OE19 EAC细胞时,ASO治疗组的菌落形成数量和平均大小均显著减少。此外,与单独使用ASO治疗的EAC细胞相比,联合使用JHESO和OE19细胞的菌落更少(图6b)。这些数据表明,阻断PVT1和YAP1可在体外协同抑制EAC细胞生长。
为了评价其体内抗肿瘤作用,我们在JHESO异种移植小鼠模型中单独或联合使用PVT1和YAP1特异性ASOs,检测了PVT1和YAP1特异性ASOs的抗肿瘤作用。裸鼠皮下注射JHESO细胞后,随机分为4组(分别用对照ASO、PVT1 ASO、YAP1 ASO和联合ASO治疗)。体内异种移植实验表明,与单纯使用ASO手术治疗相比,同时使用两种ASOs治疗可显著降低肿瘤生长(图6c-e),体重没有明显变化(图6f)。综上所述,这些结果表明在EAC细胞中存在着PVT1和YAP1的相互调控,同时抑制PVT1和YAP1比单独抑制任何一个基因更能有效抑制EAC肿瘤的生长。因此,利用特异性ASOs联合抑制YAP1和PVT1为EAC提供了一种新的治疗策略。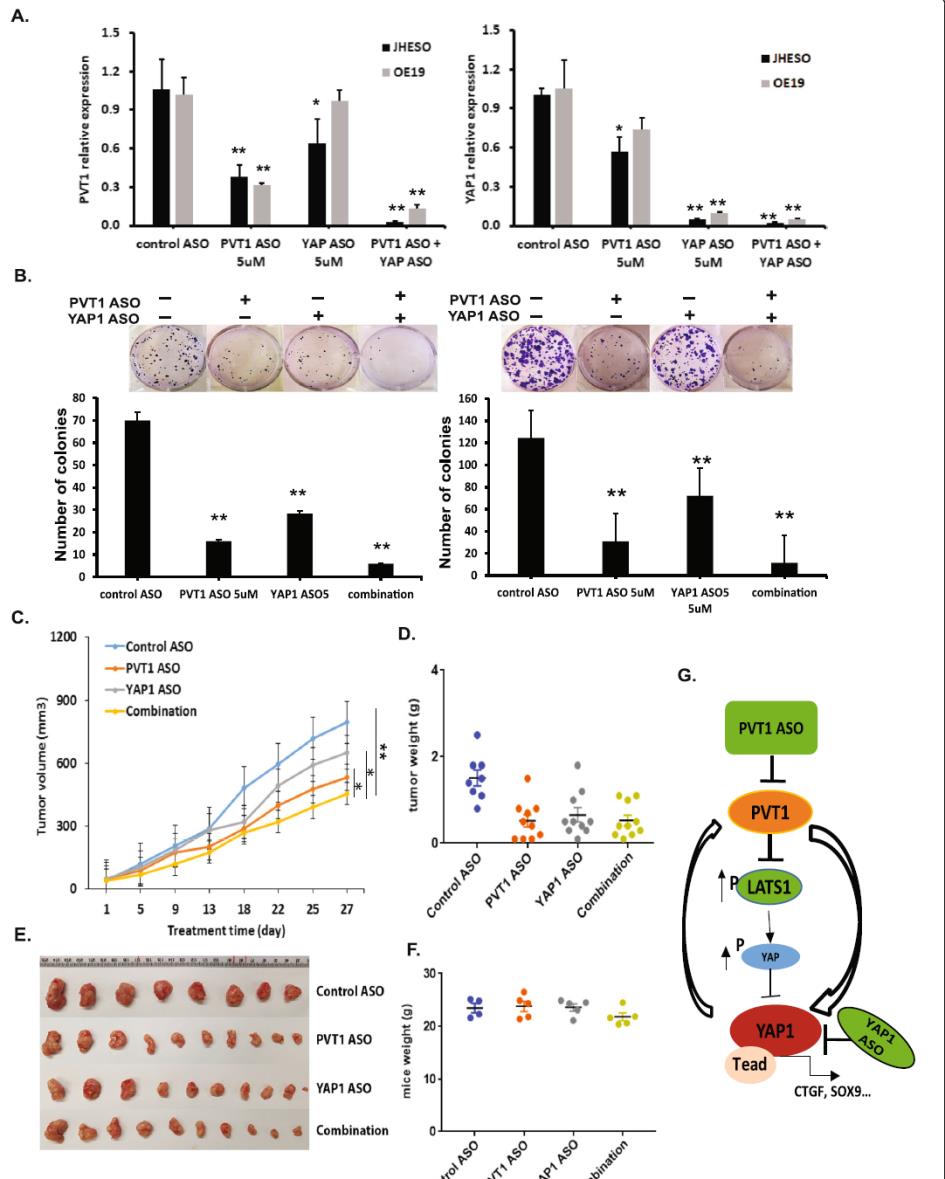
结论:
PVT1对EAC具有侵袭性表型,是一个较差的预后因子。PVT1和YAP1联合靶向治疗提供了最高的治疗指标,代表了一种新的治疗策略。















