CAR-T
概览
在二十世纪八十年代后期,科家学们开始尝试用嵌合抗原受体(Chimeric Antigen Receptor, CAR)T 细胞进行实验,当时三名研究人员通过基因工程改造 T 细胞使其表达识别半抗原的抗体并重定向其特异性1,2。本研究的作者首次提出使用嵌合 T 细胞受体来治疗肿瘤。多年以后,2011 年,Carl June 和他的团队报道了一例使用自体抗 CD19 CAR-T 细胞(CART19)成功治愈的一名慢性淋巴细胞白血病(CLL)病患3。这个研究引发了免疫肿瘤学研究领域的热潮,自此以后,CAR-T 细胞免疫疗法为许多绝望白血病患者带来了新的希望。
设计更好的 T 细胞
在用作临床治疗之前,CAR-T 细胞是在实验室里研制的。从患者身上分离出来原代人 T 细胞,进行激活、扩增和遗传修饰,以表达体外识别所选抗原的 CARs。在这个阶段,为了设计更好的 T 细胞,有许多因素需要加以考虑,其中包括靶点选择和遗传修饰的方法。
1、靶点选择
CARs 是合成的跨膜受体,其含有赋予抗原特异性抗体的胞外 scFv 结构域,和一种细胞内组分,这种细胞内组分通常包括 CD3ζ 和协同刺激(比如 CD28、4-1BB、OX-40)信号域,以模拟 T 细胞信号(图 1)4-5。在抗原识别后,CAR-T 细胞被激活并启动它们的效应子功能,比如细胞因子的产生和细胞毒性,其最终导致任何表达靶点抗原细胞的消除。由于肿瘤抗原通常也在非恶性细胞上表达,因此,靶点选择在 CAR-T 细胞设计中是一项挑战。
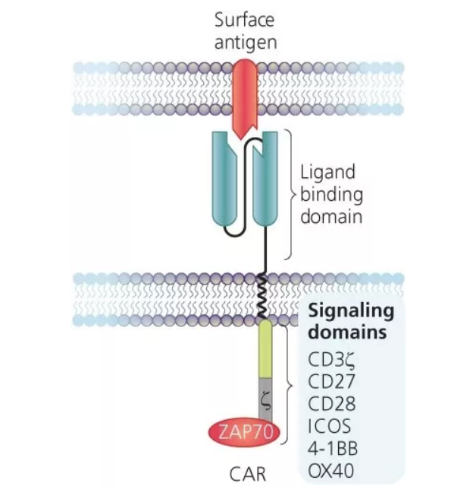
图 1. 嵌合抗原受体(CAR)的结构
摘选自 CAR-T 细胞制备的挂图,通过 Nature Protocols 制作并由 STEMCELL Technologies 提供支持。
以下研究表明可以通过特异性靶点的选择,来减少 CAR-T 细胞疗法副作用:
◆ Targeting AFP-MHC complex with CAR T cell therapy for liver cancer6
Clinical Cancer Research, 2017
利用靶向 AFP-MHC 复合物的 CAR-T 细胞治疗肝癌。
◆ Precision tumor recognition by T cells with combinatorial antigen-sensing circuits7
Cell, 2016
使用组合抗原感应环路使 T 细胞更精确地识别肿瘤。
◆ Systemic immunity is required for effective cancer immunotherapy8
Cell, 2017
触发广泛的系统免疫对有效的癌症免疫疗法是必需的。
2、遗传修饰
通过对 T 细胞遗传修饰表达 CAR,其被重新定向至一特定的靶点。目前,最常用的遗传修饰 T 细胞的方法是使用病毒(比如 γ-逆转录病毒或慢病毒)的载体,这些工程化载体可以携带 CAR 构建体9。简言之,T 细胞被激活,然后用可将其携带的物质释放进细胞的病毒颗粒进行转导,从而导致 CAR 构建体插入转导的 T 细胞基因组里(图 2)。最近,Li 等人发表了关于使用 EasySep™ 分离的 T 细胞的 γ-逆转录病毒的产生和 T 细胞转导的完整方案10。
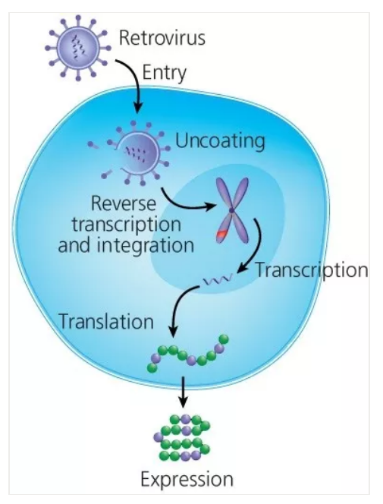
图 2. 通过逆转录病毒转导 T 细胞
摘选自 CAR-T 细胞制备的挂图,通过 Nature Protocol 制作,并由 STEMCELL Technologies 提供支持。
以下研究阐述了通过对 T 细胞进行遗传修饰来定向特定的靶点:
◆ Genome-wide profiling reveals remarkable parallels between insertion site selection properties of the MLV retrovirus and the piggyBac transposon in primary human CD4+ T cells11
Molecular Therapy, 2016
全基因组分析揭示在人原代 CD4+T 细胞里 MLV 逆转录病毒插入位点的选择特性和 piggyBac 转座子之间有着显著的相似性。
◆ Evaluation of TCR gene editing achieved by TALENs, CRISPR/Cas9, and megaTAL nucleases12
Molecular Therapy, 2016
通过 TALENs、CRISPR/Cas9 和 mega TAL 核酸酶实现的 TCR 基因编辑的评估。
◆ In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers13
Nature Nanotechnology, 2017
使用合成的 DNA 纳米载体原位编程白血病特异性 T 细胞。
3、新概念
实验室里的前沿研究在 CAR-T 细胞设计中不断提出了各种新的、令人兴奋的概念。
以下研究介绍了一些关于 T 细胞传送的新概念:
◆ Biopolymer implants enhance the efficacy of adoptive T-cell therapy14
Nature Biotechnology, 2015
生物聚合物植入体增强了过继性 T 细胞疗法的功效。
◆ Engineering T cells with customized therapeutic response programs using synthetic Notch receptors15
Cell, 2016
使用人工合成的 Notch 受体制备具有定制治疗反应程序的工程化 T 细胞。
这些新的概念可以改进治疗效果,但有些也可能增加治疗成本。由于 T 细胞疗法已经成本过高,因此需要进行各项临床试验来确定将这些新概念从实验室应用到临床是否有意义。
与其他疗法相结合
此外,将 T 细胞与他们癌症疗法相结合也是目前科学家们正在探索的领域。
1、化疗
患者在接受 CAR-T 细胞治疗时也可能接受了其他类型的治疗。这些治疗中最常见的就是化疗。以下研究表明了一些化疗可以与 T 细胞疗法互补。
◆ Enhancement of adoptive T cell transfer with single low dose pretreatment of doxorubicin or paclitaxel in mice16
Oncotarget, 2015
单次低剂量的化疗(多柔比星或紫杉醇)预处理可以增强过继转移的 CD8+ T 细胞的活性和寿命,从而提高疗效。
◆ Effector T cells abrogate stroma-mediated chemoresistance in ovarian cancer17
Cell, 2016
卵巢癌中的效应 T 细胞能抵消成纤维细胞对化疗耐药的影响,增强对常规化疗药物的敏感性。
2、降低免疫抑制
肿瘤环境表现出有利于免疫抑制而非免疫功能的条件和因素。这为渗透肿瘤特异性免疫细胞提供了一个艰难的环境,使它们不能维持有效的抗肿瘤反应。多项研究表明,减少免疫抑制因子或逆转抑制性信号通路可以提高 CAR-T 细胞疗法在患者中的有效性。
◆ CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells18
Scientific Reports, 2017
通过 CRISPR/Cas9 介导的基因组编辑破坏了 CAR-T 细胞上 PD-1 的表达,从而这些改造过的 CAR-T 细胞通过降低细胞内的免疫抑制信号表现出优异的抗肿瘤能力。
◆ TLR8 signaling enhances tumor immunity by preventing tumor-induced T-cell senescence19
EMBO Molecular Medicine, 2014
给予 TLR8 配体以激活肿瘤细胞中的 TLR8 信号传导可阻断 T 细胞衰老的诱导和逆转,从而增强抗肿瘤作用。
◆ Histone deacetylase inhibitor sensitizes apoptosis-resistant melanomas to cytotoxic human T lymphocytes through regulation of TRAIL/DR5 pathway20
Journal of Immunology, 2014
使用组蛋白脱乙酰酶抑制剂 SAHA 能上调 DR5 的表达,同时增加抗凋亡性黑素瘤中促凋亡分子的表达。
描述 CAR-T 细胞治疗与其他治疗形式组合效应的研究将为针对特定患者需求的个性化 T 细胞治疗方案提供选择。组合疗法还可以允许使用较低剂量的 T 细胞来达到所需的效果,这可能有助于减少潜在的副作用。抵消肿瘤微环境中的免疫抑制的治疗法相结合的潜力。
CAR-T 集成工作流程
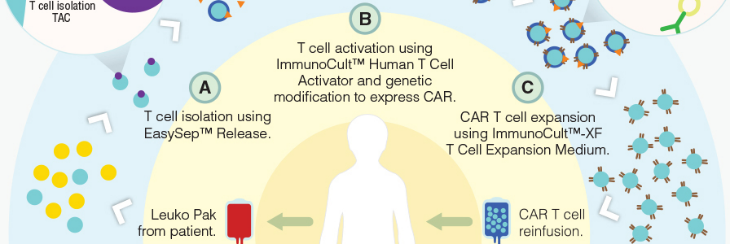
EasySep™ Release CD3 正选试剂盒(产品号 #17751)
使用无柱免疫磁珠分选,从新鲜或冻存的外周血单个核细胞(PBMCs)或经洗涤的白细胞单采术样本中分离出纯度高达 99% 的 CD3+细胞。在 30 分钟内获得的不带磁珠的 CD3+细胞,具活性和功能性,并可立即用于下游应用。

图 1. 使用 EasySep™ Release 人 CD3 正选试剂盒分离高纯度的 T 细胞
起始样本为人 PBMC,通过人 EasySep™ Release CD3 正选试剂盒进行分选,分选后的组分中 CD3+细胞含量通常可达 98.7±0.9%(平均值±标准差,使用 EasySep™ 紫色磁极)。
ImmunoCult™人 CD3/CD28 T 细胞激活剂(产品号 #10971)
ImmunoCult™人 CD3/CD28/CD2 T 细胞激活剂(产品号 #10970)
在不使用磁珠、饲养层细胞或抗原的情况下,这种可识别和交联 CD3 及共刺激分子的可溶性抗体复合物能强化人 T 细胞的激活和扩增效果。这些激活剂提供的温和刺激能维持细胞的高活性,并无需独家授权用于 T 细胞免疫疗法的制备。
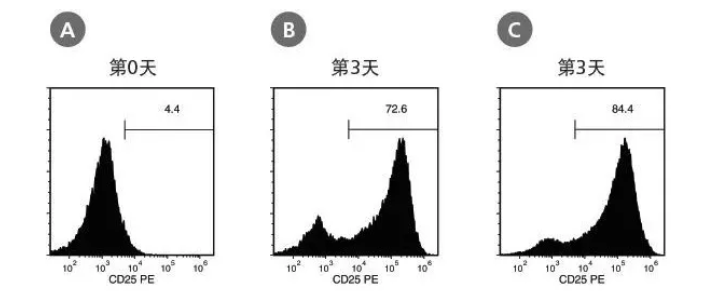
图 2. T 细胞在经过 ImmunoCult™ 人 CD3/CD28 或 CD3/CD28/CD2 T 细胞激活剂刺激后被活化
通过 EasySep™ 分选的 T 细胞使用添加了人 ImmunoCult™ CD3/CD28 T 细胞激活剂或人 ImmunoCult™ CD3/CD28/CD2 T 细胞激活剂的 ImmunoCult™-XF T 细胞扩增培养基在第 0 天开始培养。以 CD4+ T 细胞和 CD8+ T 细胞设门,并通过 CD25+在第 0 天和第 3 天的表达评估 T 细胞的活化程度。培养开始时的 CD25+细胞群含量为(A)5.63±2.4%(平均值±标准差)。经三天活化后,以人 ImmunoCult™ CD3/CD28 T 细胞激活剂和人 ImmunoCult™ CD3/CD28/CD2 T 激活剂活化的 CD25+细胞群含量分别为(B)75.4±13.8% 和(C)88.8±3.2%(平均值±标准差)。
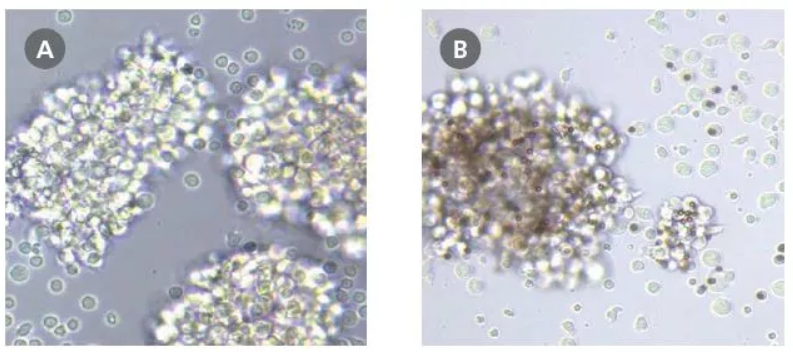
图 3. 使用 ImmunoCult™ 人 CD3/CD28/CD2 T 细胞激活剂活化的 T 细胞呈现被活化的形态
分别使用(A)可溶性人 ImmunoCult™ CD3/CD28/CD2 T 细胞激活剂和(B)基于磁珠的激活竞品试剂对通过 EasySep™ 分选的 T 细胞进行激活后的图像。
ImmunoCult™-XF T 细胞扩增培养基(产品号 #10981)
无血清和无异种成分的扩增培养基,使 T 细胞获得一致性的扩增效果。这种无需血清补充的培养基,能够强化 T 细胞的扩增,其扩增水平与含血清的培养基相当,且消除了性能的差异。

图 4. 使用添加了 ImmunoCult™ T 细胞激活剂的 ImmunoCult™-XF T 细胞扩增培养基进行培养时,T 细胞表现出强劲的扩增能力和高活率
将 T 细胞在添加了人 ImmunoCult™ CD3/CD28 T 细胞激活剂、人 ImmunoCult™ CD3/CD28/CD2 T 细胞激活剂或基于磁珠的激活竞品试剂的 ImmunoCult™-XF T 细胞扩增培养基(含 rhIL-2)中扩增超过 14 天。在第 0 天至第 14 天测定其扩增倍数及活率(请注意,扩增过程中 T 细胞未被重新活化)。
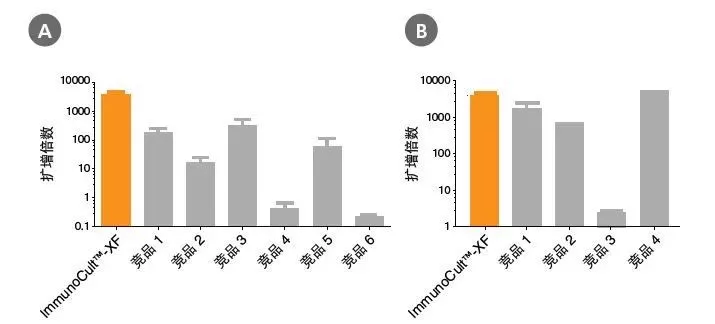
图 5. 相比于其他无血清及血清补充成分的培养基而言,ImmunoCult™-XF T 细胞扩增培养基有更强的 T 细胞扩增能力
T 细胞被人 ImmunoCult™ CD3/CD28/CD2 T 细胞激活剂活化,并培养在(A)ImmunoCult™-XF T 细胞扩增培养基或无血清的竞品培养基(含 rhIL-2,每个供体三个重复),或(B)ImmunoCult™-XF T 细胞扩增培养基或含血清补充成分的竞品培养基(含 rhIL-2,每个供体三个重复)中。在培养期间的第 0 天以及每 7 至 8 天,使用人 ImmunoCult™ CD3/CD28/CD2 T 细胞激活剂对 T 细胞进行刺激。相对于初始接种密度,在第 21 天分析 T 细胞的扩增倍数。(A)与所有测试的无血清竞品培养基相比,ImmunoCult™-XF T 细胞扩增培养基显示出对总 T 细胞更显著的扩增能力。竞品 1 到 6 代表无血清的竞品培养基。每一列误差线代表平均值±标准差(ImmunoCult™-XF T 细胞扩增培养基与其他所有无血清的培养基的对比中,P<5x10-13,通过线性混合效应模型与线性回归方法进行测试,n = 4 至 19 个供体)。(B)与所有测试的含血清补充成分的竞品培养基相比,ImmunoCult™-XF T 细胞扩增培养基显示出对总 T 细胞相似或更显著的扩增能力。竞品 1 到 4 代表含血清补充成分的竞品培养基。每一列误差线代表平均值±标准差(ImmunoCult™-XF T 细胞扩增培养基与其他所有含血清补充成分的培养基的对比中,P<0.0006,但竞品 4 除外,通过线性混合效应模型与线性回归方法进行测试,n = 1 至 19 个供体)。
CryoStor® CS10 冻存液(产品号 #07930)

将人 T 细胞保存在无血清、无动物源成分的、含 10% 二甲基亚砜(DMSO)的冻存液中。采用 USP 组分,cGMP 制造的 CryoStor® CS10 在冷冻、储存及解冻过程中为细胞提供了一个保护性环境。
参考文献
1. Gill S et al. (2016) Chimeric antigen receptor T cell therapy: 25 years in the making. Blood Rev 30 (3): 157-67.
2. Gross G et al. (1989) Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc Natl Acad Sci U S A 86 (24): 10024-8.
3. Porter DL et al. (2011) Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med 365: 725-33.
4. Srivastava S et al. (2015) Engineering CAR-T cells: design concepts. Trends Immunol 36(8):494-502.
5. Fesnak AD et al. (2016) Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer 16: 566-81.
6. Liu H et al. (2017) Targeting alpha-fetoprotein(AFP)-MHC complex with CAR T-cell therapy for liver cancer. Clin Cancer Res 23(2): 478-88.
7. Roybal KT et al. (2016). Precision tumor recognition by T cells with combinatorial antigen-sensing circuits. Cell 164(4): 770-9.
8. Spitzer MH et al. (2017). Systemic immunity is required for effective cancer immunotherapy. Cell 168(3): 487-502.
9. Dai H et al. (2016) Chimeric antigen receptors modified T-cells for cancer therapy. J Natl Cancer Inst 108(7).
10. Li G et al. (2017) Gammaretroviral production and T cell transduction to genetically retarget primary T cells against cancer. Methods Mol Biol 1514: 111-118.
11. Gogol-Döring A et al. (2016) Genome-wide profiling reveals remarkable parallels between insertion site selection properties of the MLV retrovirus and the piggyBac transposon in primary human CD4+ T cells. Mol Ther 24(3): 592-606.
12. Osborn MJ et al. (2016) Evaluation of TCR gene editing achieved by TALENs, CRISPR/Cas9, and megaTAL nucleases. Mol Ther 24(3): 570-581.
13. Smith TT et al. (2017) In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers. Nat Nanotechnol 12(8): 813-20.
14. Stephan SB et al. (2015) Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nat Biotechnol 33(1): 97-101.
15. Roybal KT et al. (2016) Engineering T cells with customized therapeutic response programs using synthetic Notch receptors. Cell 167(2): 419-32.
16. Hsu FT et al. (2015) Enhancement of adoptive T cell transfer with single low dose pretreatment of doxorubicin or paclitaxel in mice. Oncotarget 6(42): 44134-50.
17. Want W et al. (2016) Effector T cells abrogate stroma-mediated chemoresistance in ovarian cancer. Cell 165(5): 1092-105.
18. Rupp LJ et al. (2017) CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells. Sci Rep 7(1): 737.
19. Ye J et al. (2014) TLR8 signaling enhances tumor immunity by preventing tumor-induced T-cell senescence. EMBO Mol Med 6(10): 1294-311.
20. Jazirehi et al. (2014) Histone deacetylase inhibitor sensitizes apoptosis-resistant melanomas to cytotoxic human T lymphocytes through regulation of TRAIL/DR5 pathway. J Immunol 192(8): 3981-9.
关于我们
STEMCELL Technologies 是加拿大知名的生物科技公司,总部位于温哥华。在过去的 25 年里,STEMCELL 已为全球 70 多个国家提供近 3000 种分子生物学工具,以支持干细胞、免疫学、癌症、类器官和基因编辑、细胞治疗和再生医学等领域的科学研究。我们的 mTeSR™1、MethoCult™ 和 EasySep™ 已经成为多能干细胞培养、造血干细胞鉴定以及无柱细胞分选的金标准;许多工具为广大的科研实验室所熟知。2018 年我们获得了加拿大联邦政府和省政府 4500 万加币的联合注资,以支持公司未来在细胞治疗以及再生医学领域的研发与生产。
联系电话:400-885-9050
地址:上海市黄浦区南昌路 45 号城汇大厦 21B-D

