嵌合抗原受体-CAR
嵌合抗原受体-CAR 的基本结构
1989 年,Gross 和他的同事提出了嵌合抗原受体(Chimeric Antigen Receptor, CAR)的概念,他们将抗体的抗原结合区 scFv 与 CD3-ζ 链或 FcεRIγ 的胞内部分融合形成嵌合抗原受体。CAR 的基本结构包括一个肿瘤相关抗原(tumor-associated antigen, TAA)结合区(通常来源于单克隆抗体抗原结合区域的 scFV 段),一个胞外铰链区(Hinge area),一个跨膜区(Transmembrane region)和一个胞内免疫受体酪氨酸活化基序( Immunoreceptor tyrosine-based activation motif, ITAM)。嵌合抗原受体(CAR)是 CAR-T 的核心部件。
TAA 仅存在于肿瘤细胞表面,不在任何正常组织中表达。不同 TAA 可以作为 CAR-T 细胞的靶抗原,对 CAR-T 起定向作用。靶抗原的选择对于 CAR 的特异性、有效性以及基因改造 T 细胞自身的安全性等都是关键的决定因素。因此,选择合适的靶点蛋白,是 CAR-T 细胞免疫治疗在肿瘤临床研究应用中的一个重要挑战。CAR 以抗原依赖、非 MHC(Major histocompatibility complex) 限制的方式结合肿瘤抗原, 这使得经过 CAR 改造的 T 细胞相较于天然 T 细胞表面受体 TCR 能够识别更广泛的肿瘤细胞。
嵌合抗原受体-CAR 的发展
随着科学技术研究的持续推进,CARs 至今已经发展到了第四代。第一代 CARs 包含胞外单链可变片段 scFv、跨膜区和单个胞内激活信号 CD3ζ 或 FcεRIγ ,第一代 CAR-T 细胞只能引起短暂的 T 细胞增殖和较少的细胞因子分泌,其体内抗肿瘤活性受到极大限制,T 细胞增殖减少最终导致 T 细胞的凋亡;第二代 CARs 在一代基础上引入了一个共刺激分子,提高了肿瘤杀伤效力;第三代 CARs 中则搭载了多个共刺激因子,如 CD28、CD134(OX40)和 CD137 (4-1BB)等,共刺激分子可以激活 T 细胞内的 JNK、ERK、NF-κB 等信号通路,在延长 T 细胞抗肿瘤活性、增殖活性、存活周期及细胞因子(如 IL-2、TNF-α 和 IFN-γ)的分泌等方面均有显著提高;第四代 CARs 在第三代的基础上增加了可选择性的标记及编码 CARs 扩增、自杀的启动子。
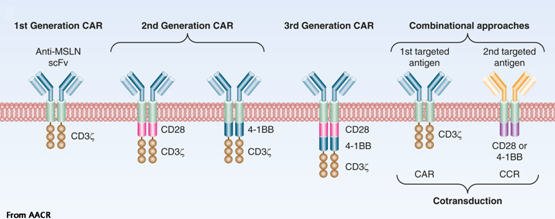
图 1. 四代嵌合抗原受体(CARs)结构示意图
嵌合抗原受体-CAR 相关肿瘤靶点蛋白
根据肿瘤的存在方式,可以分为实体瘤和非实体瘤。实体瘤临床上常有明确的肿块,主要应用以外科为主的综合治疗;而非实体瘤大多为血液系统恶性肿瘤,通常表现为无明确的肿块,以化疗为主。应用 CAR-T 细胞免疫疗法治疗不同肿瘤的过程中,肿瘤相关靶点蛋白的选择对治疗效果非常关键。
目前,已有研究证明抗 CD19 的 CAR-T 细胞在治疗 B 细胞非霍奇金淋巴瘤(NHL),急性淋巴细胞白血病(ALL)和慢性淋巴细胞白血病(CLL)方面取得重大突破;同时在实体瘤的各种临床试验中 CAR-T 疗法也表现出很好的治疗效果。CAR-T 细胞免疫疗法在肿瘤治疗中展示了巨大的应用潜力和发展前景。
参考文献
1. Yu et al. Chimeric antigen receptor T cells: a novel therapy for solid tumors. Journal of Hematology & Oncology. 2017;10:78
2. Jinghua Wang, Penghui Zhou. New Approaches in CAR-T Cell Immunotherapy for Breast Cancer. Medicine and Biology. 2017;1026
3. 陈杰,王宇环等;嵌合抗原受体 T 细胞介绍及抗肿瘤临床应用;中国细胞生物学学报:2014, 36:2
