流式大牛在线畅谈高阶流式分选技巧——下篇
上篇我们将 Sony cell sorting webinar 两位资深专家中 Dr. Peter Lopez 的演讲内容作了整理译制,为各位流式小伙伴提供了一篇高阶流式分选技巧的纯干货推送。现在,我们继续将另一位嘉宾 Dr. Rui Gardner 的演讲内容整理为新一篇的文章,接着为大家奉上干货满满的实用技巧~
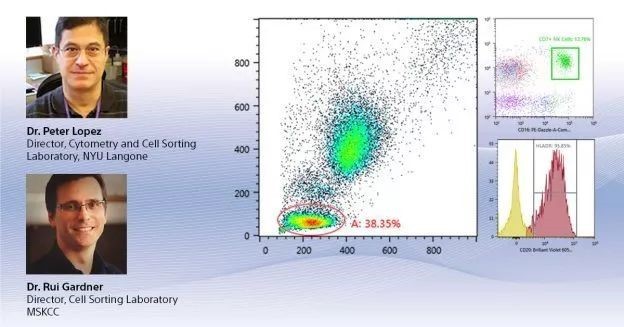
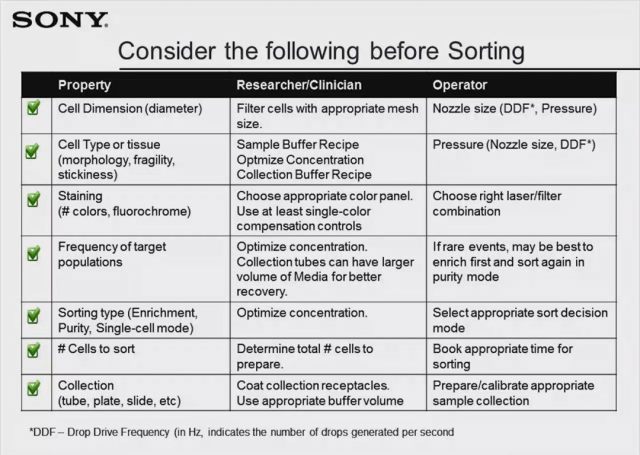
Gardner 博士:今天我与大家讨论的主题是在日常的分选操作中如何确保成功。为获得理想的实验结果,我们在正式的分选实验之前就需要做好充分的实验准备。首先我们需要考虑分选什么样的细胞,是实体组织处理得到的细胞,还是贴壁培养亦或悬浮培养的细胞?细胞的大小和脆弱性又直接决定了喷嘴的直径、液流压力和液滴的震荡频率。其次我们想分选多少细胞?这取决于目的细胞在样本中的比例以及分选所需时间。接着是分选需要什么标准的纯度?不同的分选模式(富集模式,纯度模式和单细胞模式)对应着不同的分选纯度。最后我们会用分选到的细胞来做什么样的后续实验?这关乎到收集管的种类与收集 buffer 的成分,以及分选过程中仪器的实际性能能否满足需求。大家可以参考下表,根据实验种类和目的优化相应的分选条件。

▊ 样本制备的成功要素
一个成功的分选实验,首先需要我们准备状态良好的样本。为制备良好的单细胞悬液,我们可以参考以下五点建议:添加 DNAse,避免核酸物质引起的团聚;中和 Trypsin,避免细胞过度消化;显微镜观察细胞,确保没有明显可见的团块与死细胞;滤膜过滤,以及上样前保证样本充分混匀。同时,对于高浓度的细胞样本,我们需要稀释样本以避免形成团块,降低冲突事件的发生几率;而对于低浓度的细胞样本,分选速度过低会延长分选时间,导致死细胞增多,提高上样速度后又可能降低分辨率。上述两个条件最终会影响分选结果的回收率,故而我们需要平衡这两者,选择一个合适的样本浓度,这可以根据所分选的细胞种类来调整。

▊ 分选前的仪器设置
样本准备完毕后,我们需要设置正确的仪器条件,以执行分选程序。分选和分析极为相似,但分选要求更为严格。我们必须调整合适的电压条件,以获得最佳的信噪比;同时记录单染样本和 FMO 样本,计算补偿矩阵,以便设置最精确的 gate。在正式分选之前,仪器设置这一步可能会耗费我们半个小时甚至一个小时,此时样本细胞极有可能会重新沉淀聚集,我们需要在分选前对样本再次过滤,以确保严格的单细胞悬液状态。

▊ Tube 分选校正
对于 tube 分选,在分选之前,我们还需确认侧液流的轨迹与落点。在 Sony 的分选仪上,这一步将由软件自动完成,所以我们不用太费精力。而在其他的分选系统上,我们仍需手动调整侧液流的偏转方向。此时,我们需要留意侧液流的偏转角度和收集管的倾斜角度是否一致,当两者不一致时千万不能调整液滴偏转至 tube 中间,因为这极有可能会导致液滴落在 tube 侧壁上;同时我们还需要控制 tube 中收集液体积,确保液滴可以被接收到;某些情况下,一侧的 tube 收集的细胞很多,当 tube 中液体很多时,液滴落下可能会造成一些飞溅,污染到另一侧的 tube,因此及时使用 splatter shield 也很重要。

▊ 孔板分选校正
对于孔板分选,我们同样需要确认液滴的落点处于孔板的孔中间。建议使用角度适配器调整孔板接收角度,以便液滴垂直落入孔中;如果条件允许,也可将非目的细胞加电偏转,使目的细胞垂直进入收集孔板。分选之前,我们可以在板盖上进行液滴打点,约 30-50 个液滴足以分辨打点位置。若使用单细胞分选模式,还可以使用 HRP 显色原理,确认孔板分选精确度(具体操作方法可参考链接 https://www.well.ox.ac.uk/ogc/a-colorimetric-method-to-determine-efficiency-of-facs-sorting/)。

▊ 分选过程中的参数监控
在分选过程中,我们需要对仪器的运行参数定时进行了解,以确保仪器稳定运行,以下 7 个参数可以帮助我们掌握仪器运行状态。首先是液滴断点和液流稳定性,Sony 分选仪可以智能化自行判断,帮我们节省很多精力;其次是收集液体积,我们需要预估分选需要的液滴体积,确保最后的收集液不会溢出;分选速度,一般由液滴频率决定,建议控制在频率的 1/4 以下;上样速度实时变化,可以用于预测液流压力变化和上样管路是否通畅;回收率,了解分选过程中丢弃的细胞数量;散点图细胞群体的位置变化,可以反映液流是否稳定以及上样速度是否过快。

当分选开始后,我们需要预估其持续时间,这一般取决于两个因素:上样速度和目的细胞比例。如 slide 表格所示,在 20000 eps 的上样速度下,不同的细胞比例,其分选耗费的时间也不相同。并且,由于冲突事件发生的可能性,我们需要在原来计算的分选时间的基础上,再额外加上约 50% 的时间。

▊ 分选结果评估
当分选结束后,我们需要安排收集管回测以验证分选结果。结果回测常用的检测参数为纯度,用于评估收集管中混杂了多少非目的细胞。然而我们需要了解的是,纯度并不是最理想的回测指标。有时候回测纯度很低,但仪器实际分选表现很好,低纯度可能是因为分选后细胞状态的变化引起;还有些时候回测纯度很高,但仪器分选表现其实并不理想,因为我们可以通过稀释样本来提高分选纯度,这种情况下仪器性能会首先影响回收率,而非纯度。
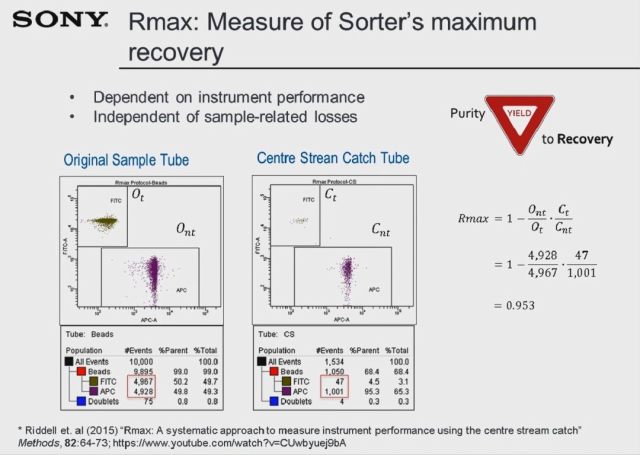
我们实验室在分选方面做了大量工作,过去的分选经验告诉我们相比于纯度,回收率其实是更好的回测评价指标。在下面这张 slide 中,我们将使用 Rmax 来描述仪器分选过程中的最大回收率。左侧的样本是两群 beads,分选完成后回测,可以看到 APC gate 共有 1001 events,同时 FITC gate 中出现了 47 events,因此实际的最大回收率 Rmax 为 95.3%。Rmax 可以更好地反映出在非目的细胞群体中,有多少 events 是因为仪器的错误分选而产生的。
▊ 内容总结
最后回顾一下,今天 Peter 和我主要在分选的基本原理和操作细节方面,和大家讨论了分选实验的一些注意事项。首先是选用合适的喷嘴或者芯片,调整最佳的细胞浓度;接着准备良好的细胞样本,设置合适的仪器参数,尤其是要理解 sorting 这一过程可能会对细胞功能产生影响;最后是采用合适的回测指标评价回测结果,例如 Rmax 方法。

◂ Q&A 环节 ▸
Q1:分选样本的最佳浓度条件如何确定?
Lopez 博士:就像 Gardner 博士的 slide 刚才所说的,样本浓度一般取决于两个因素:目的细胞群体占全部细胞的比例和我们需要多少目的细胞。因为某些情况下我们的分选时间是有限的,这需要我们合理控制分选时间。那么我们可以根据以上条件,参考 slide 中的表格,反向计算最初的样本浓度。一般来说反向计算得到的数字,再乘以 1000,即可获得最终的细胞浓度。
Gardner 博士:Peter 的解释非常正确,我想再补充一点,样本浓度也取决于细胞类型。因为分选过程中会有非常多的因素干扰,所以很难来回答哪个浓度是最合适的。一般来说常见的样本浓度会控制在 10E6/ml 范围,对于粘稠细胞或者大尺径细胞,1~5E6/ml 会合适一些,而对于 lymphocytes 来说 10~20E6/ml 的浓度也很常见。上述浓度都有很大的调整范围,这需要我们仔细优化。
Q2:收集管对制造材质(PS/PP)有要求吗?
Gardner 博士:通常我们推荐使用 PP flow tube 来作收集管。
Q3:如何调节样本流速,对 eps 高低有什么要求吗?
Gardner 博士:这是一个好问题!一般我们会使用低流速来保证荧光信号的分辨率,当样本流速提高了,分辨率将会随之下降。所以我们会在分选时尽量使用低的样本流速,但这不代表不能使用高流速。提高样本流速虽然可能导致分辨率下降,但只要我们仍然可以明显区分不同的细胞群体,这也可以接受。但是在提高流速的同时,我们也会丢失更多的目的细胞,降低回收率,所以在提高流速的同时需要确保其不会超过喷嘴震荡频率的 1/4。总的来说,提高流速时我们需要兼顾分辨率、回收率、液流稳定性以及分选速度,在这些条件中间取得平衡。
Lopez 博士:我想补充一点,不同仪器所使用的流速表并不相同,有些仪器使用样本压力表示,有些仪器使用百分比或者上样体积显示,这可能会有些区别,不过最重要的还是要根据实际的样本条件和分选需求来调整流速。
▊ 多功能自动化分选平台 MA900
Soni 博士:我要对 Lopez 博士和 Gardner 博士今天的精彩演讲表示感谢,同时也要为各位听众介绍我们 Sony 最新款的智能型多功能自动化分选平台 MA900,具有基于微流控芯片技术的高度自动化校准功能,可以实现 12 色检测和 4 路分选,以及 96/384 孔板分选等强大功能,让分选实验更加简单。同时,我们也有个人型自动化分选仪 SH800S,同样是基于微流控芯片技术,可以实现高度智能的自动化校准工作,具有 6 色检测(6 channels + 2 scatters),2 路分选和孔板分选功能。若各位想继续了解我们的产品,请访问 www.sonybiotechnology.com 网站查看更多产品信息。


图片来源:索尼生物
公司介绍

索尼公司生命科学业务部前身为 1995 年成立于美国伊利诺伊州立大学创新研发中心的 iCyt Mission Technology,迄今为止拥有 24 年的研发历史,iCyt Mission Technology 于 2010 年被索尼集团全资收购成为独立子公司。
联系我们
公司地址:上海浦东新区居里路 361 号
联系电话:021-61216282, 18521790856
传真::021-61216128
邮箱:Tony.Yu@sony.com
邮编:201203
