知己知彼,科学抗疫 | 质谱流式技术在病毒研究中的应用
引言
2020 年伊始,这场突如其来的疫情,瞬间改变了十几亿中国人的生命轨迹。此次疫情 的罪魁祸首名为」SARS-Cov-2」,民间称其为新型冠状病毒,与当年引发 SARS 及中东呼吸症 的病毒同属冠状病毒大家族。由病毒引起的人类疾病种类繁多,从伤风、流感、水痘等一般 性疾病,到天花、艾滋病、禽流感等严重疾病。有些病毒可以引起慢性感染,如乙肝病毒。
有些病毒感染后在潜伏期虽无症状,但却可以成为其他疾病的致病因子,如疱疹病毒。 人类与病毒的斗争已持续数千年,随着科学技术的发展,研究人员不断开发和应用最新 科技手段对病毒及其相关领域进行研究,寻找攻克病毒的方法。
Fluidigm 的质谱流式技术,可在单细胞水平实现四十种以上蛋白标志的同时检测,可以 对细胞群体进行更加全面、精细的分型,并深入分析细胞内信号通路,对于了解病毒感染机 制,疫苗研发及治疗方案设定均具有重大意义。近年来国际上已经有多个实验室利用质谱流 式技术进行病毒、疫苗等相关领域的研究,并已经有多篇文章发表在《Nature》、《cell》等 高影响力的杂志上。
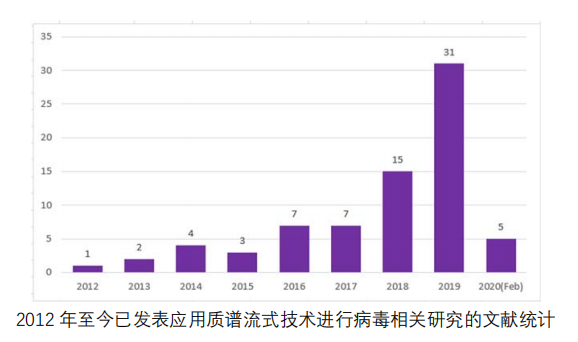
在当下抗击「SARS-Cov-2」病毒疫情的特殊时刻,我们回顾和整理了近 10 年来质谱流式 技术在病毒及相关研究中的应用和进展,供相关专业的科研人员参考,以此为对抗此次疫情 以及其他所有危害人类健康的病毒性疾病贡献我们的绵薄之力。
质谱流式技术在病毒疫苗研究中的应用和进展
接种疫苗是人类预防和控制病毒性传染疾病的重要手段之一,每当有流行病肆虐,疫苗 总是备受关注。新冠肺炎已出现无症状感染者人传人的病例,防不胜防,因而疫苗的研发进 展更是成为人们关注的焦点。
质谱流式技术 (Mass Cytometry,也称 CyTOF),是一种高通量单细胞蛋白质分析技术。 利用金属标签抗体标记细胞表面和内部的蛋白标志物,通过质谱的方式进行单细胞分析,质 谱流式可以实现对细胞上几十个蛋白的同时检测,系统了解样本中各个细胞的表型和功能。 经历了十余年的发展,质谱流式已经发展到第三代(产品名 Helios),广泛应用于血液、免 疫、干细胞、癌症等不同的研究领域。在疫苗相关领域主要有两个方面的应用:一是抗原表 位的筛查,二是疫苗相关免疫机制的研究,下面分别进行讲述。
01 抗原表位筛查
多肽-MHC 四聚体是筛查 T 细胞抗原表位的有效手段。利用 T 细胞表面的 TCR 受体和 多肽-MHC 分子的特异性结合,利用流式检出针对表位肽段的 T 细胞。由于单个 TCR 分子 的亲和力较弱,形成四聚体后,多分子协同结合显著提高了 TCR 分子对四聚体整体的亲和 力,进而提高检出效率。[16] 质谱流式很早就开始被用来筛选抗原表位。 2013 年 Nature Biotechnology 发表了 Even Newell 等关于轮状病毒表位筛选的文章。 在这项研究中,四聚体上的荧光基团改为金属标签,以适用质谱流式检测。在金属标签的使 用上,Even Newell 创造性的使用了三金属组合的方式标记四聚体,这样做有两个好处:首 先、可以显著增加筛选的通量,例如用 10 种金属就可以实现 120 种抗原肽的筛选。其次、 三个金属信号可以相互印证,排除随机背景信号的影响,提高筛选结果的灵敏度和可靠性。 [16] 在此项研究中,结合磁珠细胞富集等手段,质谱流式可以筛查出比例低至 1/100000 的 特异性 CD8+T 细胞。最后共筛选出了 6 个新的轮状病毒表位,其中 4 个是新发现的。[1]
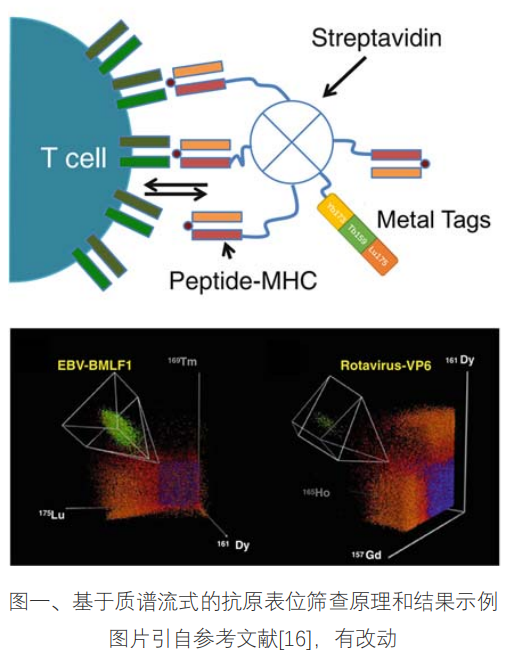
在筛选 T 细胞表位的同时,质谱流式还可以对抗原特异的 T 细胞进行多参数的表型和 功能分析;利用筛查表位富余的检测通道,Even Newell 等还同时检测了 23 个相关的表面的 表达,对筛查出的特异性 T 细胞进行深入的表型分析。这些信息可以帮助我们全面的分析 T 细胞对于病原体或者疫苗的反应情况。[1]
2019 年,Even Newell 带领的研究团队利用相似的技术路线完成了一项登革热病毒的相 关研究。这项研究中,他们从 430 个备选多肽中找到了 21 个表位。同时检测的还有 27 个 与 T 细胞激活和转移相关的表面 marker,揭示出这些病毒特异性 T 细胞分化为两种表型和 功能不同的记忆细胞,一种处于终末分化的静息状态,而另一种则保持一定的增殖能力。[3]
到今天,质谱流式的抗体标签已经扩充到 44 个,这就意味着在未来表位多肽筛查的通 量以及对 T 细胞表型分析的深度还可以有很大的扩展空间。
02 疫苗相关免疫机制的研究
作为外来抗原,疫苗引发的免疫反应是有各类免疫细胞一起参与的系统性反应。各类先 天性免疫细胞(粒、单核、巨噬、DC、NK 等)和获得性免疫细胞(T,B)均参与其中。质 谱流式以前所未有的水平分析样本表型和功能,帮助我们了解疫苗作用的深层免疫机制。
斯坦福大学很早就开始了这方面的尝试。早在 1997 年,斯坦福就开始了 LPCH 疫苗计 划(LPCH Vaccine Program),这是一项跨学科疫苗研究计划,意在加强疫苗的基础和应用研究。质谱流式出现后,很快就被应用于相关的疫苗研究工作中。
2014 年斯坦福大学 Mark Davis 实验室发表了一篇关于流感病毒疫苗的研究论文。在这 项体外疫苗研究中,研究人员利用质谱流式检测了 PBMC 样本上 19 个表面 marker 和 11 个 胞内信号通路分子的表达水平,系统分析了流感疫苗和 resiquimod(TLR7&8 激活剂)刺激 前后 PBMC 中不同免疫亚群信号通路的改变。数据表明,在人血清存在的情况下,疫苗可以 快速的激活包括单核、DC、NK 以及粒细胞等在内的多种免疫细胞类型,但是其信号通路激 活的方式与典型的 TLRs 反应有显著区别。[14]
除了这种对于疫苗免疫反应的系统性研究,还有一些实验室将研究的重点放在了特定类 型的免疫细胞上。多年来,法国巴黎南大学 Anne-Sophie Beignon 教授带领的研究团队利用 食蟹猕猴(cynomolgus macaques)动物模型和修饰的安卡拉疫苗(MVA)进行了多项疫苗 免疫相关研究。
2016 年,该实验室开展了一项 B 细胞的相关研究,研究人员利用质谱流式检测了 25 个 marker 的表达,揭示了在静息态 (steady state) 下循环 B 细胞表型的复杂性和多态性,以及疫 苗免疫条件下所诱发的 B 细胞亚群组成变化。

通过 SPADE 聚类,研究人员找出 14 个随免疫时间改变的 B 细胞亚群(DECs),通过 表型分析可以确定,它们中有一部分属于静息或激活型的记忆 B 细胞亚群,有些则是新发现 的亚群。进一步的分析表明,在所有 DEC 中,DEC9(一个静息记忆 B 细胞亚群)的比例在 免疫过程中呈现先增长后降低的变化过程,与血清抗体的滴度变化呈现显著的相关性,提示 它可能发挥比较关键的作用。[7]
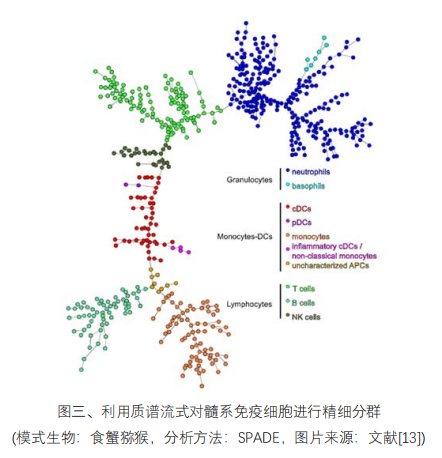
2018 年,该实验室研究了髓系免疫细胞在疫苗初次免疫和二次免疫后反应性的差异。 利用质谱流式平台,研究团队获得所有时间点样本上 19 个表面 marker 和 12 个胞内 Cytokine 的表达数据。聚类的结果反映出髓系细胞复杂的多样性,此外,各亚群细胞对于对两次免疫 的反应模式也不尽相同。利用多因子分析,研究人员找到了一些关键亚群,相比初次免疫, 它们在二次免疫后具有更强的反应性,表达更强的免疫活性 marker。这表明,和适应性免 疫一样,髓系免疫细胞对于初次和二次免疫的反应也是不同的。[13] 在 2019 年发表的另一 项研究工作中,他们在 NK 细胞上也发现了类似的情况。这让我们重新审视先天性免疫,这 对与未来优化疫苗设计至关重要。[12]
除此以外,质谱流式还被应用于大量病毒感染相关的研究,揭示出在天然病原体作用 下,各种免疫细胞复杂的表型和功能变化。了解这些过程也会对疫苗的设计有一定的指导作 用。 [6]
小结:
综上所述,质谱流式已经大量应用于疫苗相关的研究领域。当今,疫苗研究领域还面 临诸多挑战,例如:寻找更有效的抗原表位,疫苗设计和剂型等方面的优化,寻找可以预 测疫苗免疫反应的生物标志物,以及根据个体间差异制定个体化免疫方案等等,这些都需 要大量的数据支持。作为一个优秀的高通量多参数单细胞分析平台,质谱流式技术将对这 些问题的解决起到重要的推动作用 [6,15]。
参考文献
1. Combinatorial tetramer staining and mass cytometry analysis facilitate T-cell epitope mapping and characterization Newell EW, Sigal N, Nair N, Kidd BA, Greenberg HB, Davis MM. Nat Biotechnol. 2013 Jul;31(7):623-9. doi: 10.1038/nbt.2593. Epub 2013 Jun 9.
2. High-Dimensional Phenotypic Mapping of Human Dendritic Cells Reveals Interindividual Variation and Tissue Specialization Alcántara-Hernández M, Leylek R, Wagar LE, Engleman EG, Keler T, Marinkovich MP, Davis MM, Nolan GP, Idoyaga J. Immunity. 2017 Dec 19;47(6):1037-1050.e6. doi: 10.1016/j.immuni.2017.11.001. Epub 2017 Dec 5.
3. Large-Scale HLA Tetramer Tracking of T Cells during Dengue Infection Reveals Broad Acute Activation and Differentiation into Two Memory Cell Fates Chng MHY, Lim MQ, Rouers A, Becht E, Lee B, MacAry PA, Lye DC, Leo YS, Chen J, Fink K, Rivino L, Newell EW. Immunity. 2019 Dec 17;51(6):1119-1135.e5. doi: 10.1016/j.immuni.2019.10.007. Epub 2019 Nov 19.
4. High-dimensional immune profiling of total and rotavirus VP6-specific intestinal and circulating B cells by mass cytometry Nair N, Newell EW, Vollmers C, Quake SR, Morton JM, Davis MM, He XS, Greenberg HB. Mucosal Immunol. 2016 Jan;9(1):68-82. doi: 10.1038/mi.2015.36. Epub 2015 Apr 22.
5. Systems immunology allows a new view on human dendritic cells Schultze JL, Aschenbrenner AC. Semin Cell Dev Biol. 2019 Feb;86:15-23. doi: 10.1016/j.semcdb.2018.02.017. Epub 2018 Feb 24.
6. Application and utility of mass cytometry in vaccine development Reeves PM, Sluder AE, Paul SR, Scholzen A, Kashiwagi S, Poznansky MC. FASEB J. 2018 Jan;32(1):5-15. doi: 10.1096/fj.201700325R. Epub 2017 Nov 1.
7. Identification of Vaccine-Altered Circulating B Cell Phenotypes Using Mass Cytometry and a Two-Step Clustering Analysis Pejoski D, Tchitchek N, Rodriguez Pozo A, Elhmouzi-Younes J, Yousfi-Bogniaho R, RogezKreuz C, Clayette P, Dereuddre-Bosquet N, Lévy Y, Cosma A, Le Grand R, Beignon AS. J Immunol. 2016 Jun 1;196(11):4814-31. doi: 10.4049/jimmunol.1502005. Epub 2016 May 2.
8. Coordinated regulation of NK receptor expression in the maturing human immune system Strauss-Albee DM, Horowitz A, Parham P, Blish CA. J Immunol. 2014 Nov 15;193(10):4871-9. doi: 10.4049/jimmunol.1401821. Epub 2014 Oct 6.
9. Techniques to Study Antigen-Specific B Cell Responses Boonyaratanakornkit J, Taylor JJ. Front Immunol. 2019 Jul 24;10:1694. doi: 10.3389/fimmu.2019.01694. eCollection 2019.
10. Spatiotemporal Modeling of the Key Migratory Events During the Initiation of Adaptive Immunity Hayes AJ, Rane S, Scales HE, Meehan GR, Benson RA, Maroof A, Schroeder J, Tomura M, Gozzard N, Yates AJ, Garside P, Brewer JM. Front Immunol. 2019 Apr 5;10:598. doi: 10.3389/fimmu.2019.00598. eCollection 2019.
11. Baseline immune profile by CyTOF can predict response to an investigational adjuvanted vaccine in elderly adults Lingblom CMD, Kowli S, Swaminathan N, Maecker HT, Lambert SL. J Transl Med. 2018 Jun 5;16(1):153. doi: 10.1186/s12967-018-1528-1.
12. NK cell immune responses differ after prime and boost vaccination Palgen JL, Tchitchek N, Huot N, Elhmouzi-Younes J, Lefebvre C, Rosenbaum P, DereuddreBosquet N, Martinon F, Hocini H, Cosma A, Müller-Trutwin M, Lévy Y, Le Grand R, Beignon AS. J Leukoc Biol. 2019 May;105(5):1055-1073. doi: 10.1002/JLB.4A1018-391RR. Epub 2019 Feb 22.
13. Prime and Boost Vaccination Elicit a Distinct Innate Myeloid Cell Immune Response Palgen JL, Tchitchek N, Elhmouzi-Younes J, Delandre S, Namet I, Rosenbaum P, DereuddreBosquet N, Martinon F, Cosma A, Lévy Y, Le Grand R, Beignon AS. Sci Rep. 2018 Feb 15;8(1):3087. doi: 10.1038/s41598-018-21222-2.
14. The Split Virus Influenza Vaccine rapidly activates immune cells through Fcγ receptors O'Gorman WE, Huang H, Wei YL, Davis KL, Leipold MD, Bendall SC, Kidd BA, Dekker CL, Maecker HT, Chien YH, Davis MM. Vaccine. 2014 Oct 14;32(45):5989-97. doi: 10.1016/j.vaccine.2014.07.115. Epub 2014 Sep 6.
15. Personalized vaccinology: A review Poland GA, Ovsyannikova IG, Kennedy RB. Vaccine. 2018 Aug 28;36(36):5350-5357. doi: 10.1016/j.vaccine.2017.07.062. Epub 2017 Jul 31.
16. High-dimensional analysis of human CD8(+) T cell phenotype, function, and antigen specificity Newell EW, Lin W. Curr Top Microbiol Immunol. 2014;377:61-84. doi: 10.1007/82_2013_354.
17. The newborn human NK cell repertoire is phenotypically formed but functionally reduced Strauss-Albee DM, Liang EC, Ranganath T, Aziz N, Blish CA. Cytometry B Clin Cytom. 2017 Jan;92(1):33-41. doi: 10.1002/cyto.b.21485. Epub 2016 Nov 8.
18. Peptide-MHC class I and class II tetramers: From flow to mass cytometry Christophersen A. HLA. 2020 Mar;95(3):169-178. doi: 10.1111/tan.13789. Epub 2020 Jan 23.
19. Multiplex peptide-MHC tetramer staining using mass cytometry for deep analysis of the influenza-specific T-cell response in mice Fehlings M, Chakarov S, Simoni Y, Sivasankar B, Ginhoux F, Newell EW. J Immunol Methods. 2018 Feb;453:30-36. doi: 10.1016/j.jim.2017.09.010. Epub 2017 Sep 30.
20. Multiplex MHC Class I Tetramer Combined with Intranuclear Staining by Mass Cytometry Simoni Y, Fehlings M, Newell EW. Methods Mol Biol. 2019;1989:147-158. doi: 10.1007/978-1-4939-9454-0_11.
文章来源:富鲁达(上海)仪器科技有限公司
联系我们
为更好地保障疫情防治需要,丁香通诚邀您提供相关信息,不限于:可供应产品信息、捐赠意向、技术资料等内容,请通过邮件 biomart@dxy.cn 联系我们!
直击抗疫科研前线,丁香通与你同在!
