研发 | 新型冠状病毒肺炎相关临床试验进展情况汇总解读
武汉加油!
湖北加油!
中国加油!
自 2019 年 12 月开始在湖北省武汉市发生的新型冠状病毒肺炎事件,对中国民众的影响将从春节影响到 2 月底(保守估计)。截止到 2020 年 2 月 1 日 24 时,中国大陆地区收集到的情况:累计报告确诊病例 14380 例,现有重症病例 2110 例,累计死亡病例 304 例,累计治愈出院病例 328 例,共有疑似病例 19544 例。
2020 年 1 月 30 日,世界卫生组织正式宣布将目前的新型冠状病毒疫情定性为「国际关注的突发公共卫生事件」。根据世卫组织的官方定义,这意味着这一始于中国武汉的疫情已经威胁世界各国的公共卫生安全,并且需要国际社会的共同响应。虽然 WHO 在随后发布的说明中对于中国政府和民众抗疫所作出的努力和贡献给予了高度评价,但这还是引发了世界各国针对本次疫情担忧的加剧,并逐步采取了限制针对措施。境外相关地区和国家为了应对本次新型冠状病毒肺炎而采取的措施,不仅会对中国经济,也会对世界经济产生一定的影响。
在疫情开始确定并开始实施严格管制初期,中国国家药监局和相关省局,就采取了积极应对措施:到目前为止,已经有多家企业的近 10 个检测试剂盒被批准,用于临床诊断和检测。但是民众更关心的有效治疗药物,则还没有更明确的结论。WHO 在相关指南中答复如下:
问题 05:目前有针对新型冠状病毒的疫苗吗?
答复:新发疾病需要时间才能研发出接种的疫苗,而开发新疫苗可能需要数年时间。
问题 06:有针对新型冠状病毒的治疗方法吗?
答复:对于由新型冠状病毒引起的疾病,没有特效的治疗方法。但是,许多症状都可以治疗,因此可以根据患者的临床状况进行治疗。此外,对感染者的支持治疗可能非常有效。
为了积极应对有效治疗药物缺乏的窘迫现状,国家药监局发布了《NMPA 行政受理服务大厅「延长 2020 年春节假期有关事宜」公告》,其中第五条专门提到:防控新型冠状病毒感染肺炎等特殊产品的申报,可随时与大厅联系。同时,不管是国内制药企业,还是境外制药企业,都从目前上市或者在研药物中,积极筛选和评估,在积极寻找可以应对本次病毒肺炎挑战的有效药物。
本文搜集和整理截止到 2020 年 2 月 2 日最新的相关药物临床试验信息,希望可以为民众和制药同仁提供帮助。
说明:下面药物介绍顺序仅仅代表本文写作顺序,不代表本人对药物疗效推荐的优先程度。
第一部分:阿比多尔(Arbidol)
1.1 检索地址
https://clinicaltrials.gov/ct2/show/NCT04246242?recrs = ab&cond = 2019&draw = 2&rank = 1
1.2 研究目的
为了确定阿比多尔在 2019 年新型冠状病毒(2019-nCoV)患者中的疗效和安全性。根据随机双盲对照临床试验原则,将 2019-nCoV 患者分为三组,第一组给药:Arbidol,200 mg,tid(每天给药 3 次);第二组给药 arbidol,400 mg,tid(每天给药 3 次);第三组不使用 Arbidol(阿比多尔);分别持续 5 天。针对三组患者的其他抗病毒和综合治疗方法是一致的。然后研究人员将比较第一个结果:28 天死亡率;第二个结果:ICU 住院时间,机械通气时间,住院费用,抗生素使用费用,SOFA 评分,CURB-65 评分,APACHE 评分和其他临床指标。
1.3 临床试验信息要点介绍
说明:本部分根据 clinical trials 官网顺序进行截图介绍。
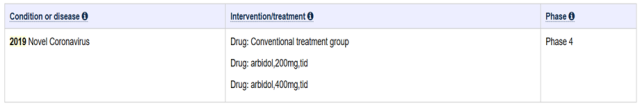
解析:从上面截图可以看出,阿比多尔本次临床试验适应症是针对 2019-nCoV,患者分为三组。因为阿比多尔是上市多年药物,因此本次试验属于上市后 4 期临床试验。
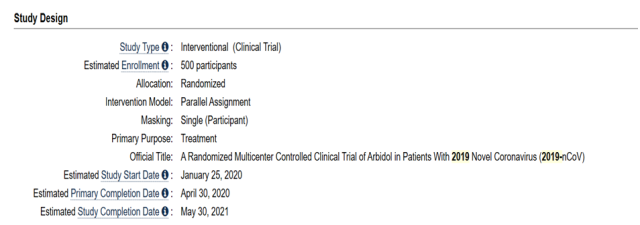
解析:从上面截图可以看出,本次临床试验需要招募 500 名受试者。根据上面截图可以知道,本次研究主题:这是一项评价阿比多尔(Arbidol)针对 2019-nCoV 感染的随机多中心对照临床试验。估计试验开始时间是 2020 年 1 月 25 日,估计试验初步完成时间是 2020 年 4 月 30 日,最终完成时间是 2020 年 5 月 30 日。

解析:从上面对受试者要求看,儿童、成年和老年患者都可以参加本次临床试验。对于患者性别无特殊要求,都可以参加。本次试验不接受健康志愿者。
解析:这次临床试验编号是 NCT04246242,所有相关信息请检索这个号码。下面是两个联系人的联系方式,包括电话和邮箱。本次临床试验发起人是中南大学湘雅医院。
1.4 其他相关参考信息
2020 年 1 月 21 日,江苏吴中发布公告:盐酸阿比多尔片为公司全资子公司医药集团在产在销产品之一。该产品为预防和治疗流行性感冒药,通过抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制。目前尚无证据表明该产品对新出现的「新型冠状病毒」有疗效。
应该说,吴中制药上述公告还是很谨慎和客观的。在本次临床试验得出明确结论之前,确实没有证据证明阿比多尔对于本次 2019-nCoV 感染患者有效。
第二部分:甲基强的松龙
2.1 检索地址
https://clinicaltrials.gov/ct2/show/NCT04244591?cond = 2019-nCoV&draw = 2&rank = 3
2.2 研究目的
这是一项多中心、随机、对照临床研究,研究人员将评估接受糖皮质激素与标准护理的 2019-nCoV 患者的疗效和安全性。
2.3 临床试验信息要点介绍

解析:从上面截图可以看出,本次临床试验针对 2019-nCoV 患者。治疗方法是给与甲基强的松龙,并结合标准护理。

解析:从上面截图可以看出,本次临床试验招募 80 名受试者。对于药物不进行设盲,也就是说,患者知道自己使用了甲基强的松龙。估计临床试验开始时间是 2020 年 1 月 26 日,估计临床试验初步结束时间是 2020 年 4 月 25 日,估计临床试验正式结束时间是 2020 年 12 月 25 日(此结束时间值得考虑)。
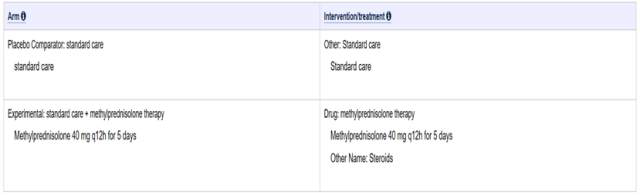
解析:从上面截图可以看出,甲基强的松龙给药剂量是 40 mg,每 12 小时给药一次,连续给药 5 天。
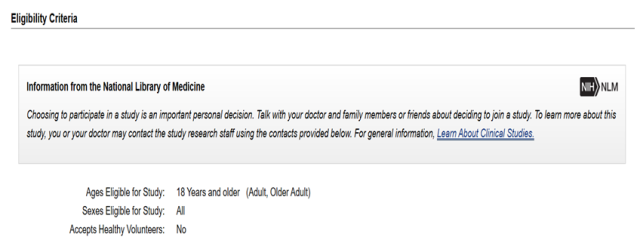
解析:对于患者招募标准,根据上面截图,18 岁以上患者都可以入组参加临床试验。对于患者性别没有要求。本次临床试验不招募健康志愿者。

解析:本次临床试验的编号是 NCT04244591,可以以后检索本次临床试验的进展情况。本次临床试验的发起单位有:北京协和医院 ICU 病区、北京协和医院、中大医院、中南医院、武汉大学人民医院等。
第三部分:Recombinase Aided Amplification (RAA) Assay
3.1 检索地址
https://clinicaltrials.gov/ct2/show/NCT04245631?cond = 2019-nCoV&draw = 2&rank = 1
3.2 研究目的
开发一种简单、快速和便捷携带的用于 2019-nCoV 检测的重组酶辅助扩增(RAA)分析方法。
3.3 临床试验信息要点介绍
由于本次临床试验目的不是研究治疗药物,只是研究一种用于临床样品检测方法,因此本文不予详细介绍。本次临床试验号码是 NCT04245631,感兴趣读者可以随时检索。
第四部分:连花清瘟胶囊/颗粒
4.1 检索地址
http://www.chictr.org.cn/showproj.aspx?proj = 48889
4.2 研究目的
1. 评价连花清瘟胶囊/颗粒治疗新型冠状病毒感染的肺炎的临床疗效。2. 评价连花清瘟胶囊/颗粒治疗新型冠状病毒感染的肺炎的安全性。
4.3 临床试验信息要点介绍
说明:由于下面信息来自中国官网,内容是中文,不再给与翻译和解析。


说明:在中国临床试验注册中心官网,可以检索到涉及连花清瘟胶囊的两个临床试验。另外一个编号是 ChiCTR2000029433,请读者自己检索阅读。
第五部分:痰热清注射液
5.1 检索地址
http://www.chictr.org.cn/showproj.aspx?proj = 48881
5.2 研究目的
观察大剂量中药注射液治疗新型冠状病毒感染肺炎临床疗效及其安全性;期望形成疗效确切、方便推广的中医治疗方案。
5.3-临床试验信息要点介绍

干预措施:痰热清注射液加入 5% 葡萄糖注射液或 0.9% 氯化钠注射液 500 ml,静脉滴注,控制滴数每分钟不超过 60 滴,每日 1-2 次;使用剂量由医生根据临床情况决定,建议 40 ml/天或以上,但最多不得超过 80 ml/天。
第六部分:三种抗病毒方案
6.1 检索地址
http://www.chictr.org.cn/showproj.aspx?proj = 48782
6.2 研究目的
评价三种抗病毒方案治疗普通型新型冠状病毒感染的肺炎患者的疗效和安全性。
6.3 临床试验信息要点介绍

解析:从上面截图可以看出,这项临床试验共招募患者 120 人,分为三组,每组 40 人。第一组(A 组)给药利巴韦林+干扰素α1b;第二组(B 组)给药洛匹那韦/利托那韦软+干扰素α1b;第三组(C 组)给药利巴韦林+洛匹那韦/利托那韦软+干扰素α-1b。
第七部分:糖皮质激素(甲泼尼龙)
7.1 检索地址
http://www.chictr.org.cn/showproj.aspx?proj = 48777
7.2 研究目的
评价激素应用于重度新型冠状病毒感染的疗效与安全性,探索最优治疗模式。
7.3 临床试验信息要点介绍

干预组给药方案:洛匹那韦/利托那韦片(每片含洛匹那韦 200 mg,利托那韦 50 mg),一日 2 次,一次 2 片; α-干扰素雾化吸入(每次 500 万 U,加入灭菌注射用水 2 ml),每日 2 次;甲泼尼龙 静脉注射 1~2 mg/kg·d 持续 5 天。
对照组给药方案:洛匹那韦/利托那韦片(每片含洛匹那韦 200 mg,利托那韦 50 mg),一日 2 次,一次 2 片; α-干扰素雾化吸入(每次 500 万 U,加入灭菌注射用水 2 ml),每日 2 次,不使用激素。
第八部分:血必净注射液
8.1 检索地址
http://www.chictr.org.cn/showproj.aspx?proj = 48768
8.2 研究目的
评价血必净对肺炎严重指数(PSI)的改善作用 ,及 28 天预后的影响。
8.3 临床试验信息要点介绍
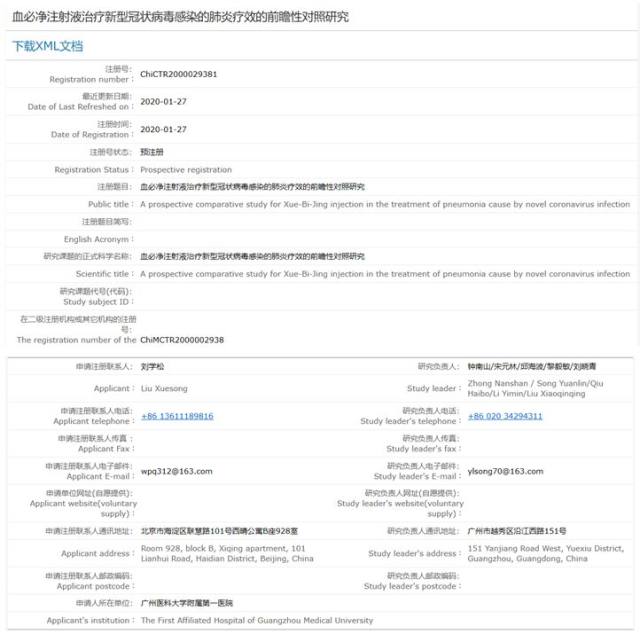
解析:根据注册信息核实,分为两个试验组。一组给药血必净注射液,一组给予常规治疗。
第九部分:洛匹那韦/利托那韦和干扰素α2b 联合治疗
9.1 检索地址
http://www.chictr.org.cn/showproj.aspx?proj = 48684
9.2 研究目的
评价与标准治疗相比,洛匹那韦/利托那韦和干扰素α2b 联合治疗新型冠状病毒感染的成人住院患者的疗效和安全性。
9.3 临床试验信息要点介绍

解析:根据临床试验注册信息,试验组给药:洛匹那韦利托那韦片(每片含洛匹那韦 200 mg,利托那韦 50 mg),一日 2 次,一次 2 片; 干扰素α2b。对照组给药:常规治疗。
第十部分:瑞德西韦
10.1 检索地址
下面是丁香园 insight 数据库检索地址,可以查询到吉利德的瑞德西韦(Remdesivir)的临床试验注册信息:
https://db.dxy.cn/v5/cde?element = 瑞德西韦&isTag = 1
而截止到 2020 年 2 月 2 日中午,在 clinical trials 官网、cde 临床试验登记平台和中国临床试验注册中心官网,都没有查询到瑞德西韦的临床试验登记信息。猜测是登记数据还在处理过程中。
10.2 研究目的
根据网络流传截图,显示研究目的:一项随机双盲对照多中心临床试验,用于评价瑞德西韦对于 2019-nCoV 患者的疗效和安全性。
10.3-临床试验信息要点介绍
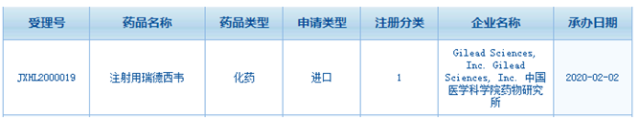
下面这张截图是从国家局数据库截取的显示瑞德西韦注册信息,从截图看,瑞德西韦以注射途径给药。
下面截图来自网络,目前在 clinical trials 官网还看不到信息。

解析:上面信息显示临床试验开始时间是 2020 年 2 月 3 日,预估完成时间是 2020 年 4 月 27 日。

解析:上面信息显示临床试验发起方是首都医科大学,主要研究人员是中日友好医院的曹彬教授。

解析:上面信息显示招募受试者 270 人,随机分组。

解析:上面信息显示临床试验的受试者分为 2 组,一组接受瑞德西韦的治疗,另外一组接受安慰剂治疗。
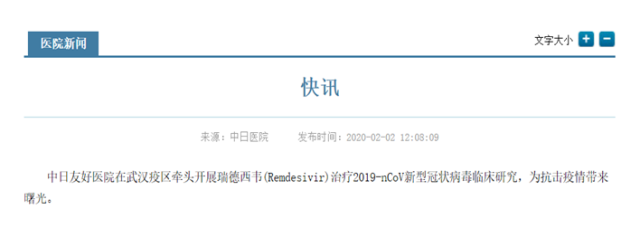
2020 年 2 月 2 日中午,中日友好医院官网发出快讯:
补充说明:在中国临床试验注册中心(CHICTR)官网,检索冠状病毒等关键词,可以检索到共 17 条相关信息。除了上面介绍的涉及具体药物的信息,还有很多临床治疗方案的信息。请感兴趣的读者,自己检索和阅读。
补记:2020 年 2 月 2 日晚间,舒泰神 (300204) 披露公告称,公司及全资子公司北京德丰瑞生物技术有限公司 (以下简称「德丰瑞」) 向国家药品监督管理局提交了关于 BDB-001 注射液用于治疗冠状病毒感染所致相关疾病的治疗的临床试验的申请。
具体来看,此次申请的药品名称为 BDB-001 注射液,拟定适应症为冠状病毒可特异性地过度激活补体系统,此产品可抑制病毒等因素造成的补体系统激活所致的炎性反应,用于冠状病毒等感染者的治疗,预防肺炎的发生、防止肺炎重症化、降低急性呼吸窘迫综合征的发生率。
结语
上面汇总的信息时效性截止到 2020 年 2 月 2 日,这些信息会随着科研进展而变化,请感兴趣读者自行关注。另外,针对新型冠状病毒肺炎,目前没有经过证实的有效药物。在上述临床试验结束并得出明确结论之前,隔离和预防感染仍然是非常必要的手段。
参考文献
1- clinical trials 官网信息
2- cde 官网信息
3- NMPA 官网信息
4- 吉利德官网信息
5- 吴中制药官网信息
6- 河北以岭药业官网信息
7- 协和临床用药速查手册(2015 年第一版)
8- 中国临床试验注册中心
9- 中国药典 2015 版三部
10- 中日友好医院官网
| 作者简介 |
zhulikou431,高级工程师、PDA 会员、ISPE 会员、ECA 会员、PQRI 会员、资深无菌 GMP 专家,在无菌工艺开发和验证、药品研发和注册、CTD 文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
作者:zhulikou431
文章来源:微信公众号「CPhI 制药在线」
* 本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(邮箱:biomart@dxy.cn),我们将立即进行删除处理;同时转载内容不代表本站立场。
联系我们
为更好地保障疫情防治需要,丁香通诚邀您提供相关信息,不限于:可供应产品信息、捐赠意向、技术资料等内容,请通过邮件 biomart@dxy.cn 联系我们!
直击抗疫科研前线,丁香通与你同在!
